
氏名:新矢 恭子
神戸大学大学院医学研究科微生物感染症学講座人獣共通感染症学分野 准教授
鳥取大学農学部獣医学科卒業。山口大学大学院連合獣医学研究科博士課程修了。獣医学博士。2004年より東北大学医学系研究科助手。2005年より鳥取大学農学部助教授。2007年より現職。主として、インフルエンザウイルス感染症の病態学、インフルエンザウイルスポリメラーゼのフィデリティ変化に関する研究をしている。

氏名:鈴木 泰博
名古屋大学大学院情報科学研究科複雑系科学専攻 准教授
北陸先端科学技術大学院大学情報科学研究科博士前期課程修了。京都大学博士。1997年より東京医科歯科大学難治疾患研究所助手。うち2003年から2年間 ATR研究所人間報科学研究所客員研究員。2005年より現職。主として、複雑系、システム生物学、自然計算などを研究している。
生体内で糖鎖は、多くの場合、プロテオグリカン、糖タンパク質または糖脂質の形で複合糖質として存在し機能していると言われている。プロテオグリカンはコアとなるタンパク質に2糖の繰り返し構造からなる長鎖の糖鎖を有しているのが特徴で、細胞外マトリックスの主成分の一つとして動物の組織に普遍的に存在する。糖タンパク質では、数種類の単糖がプロテオグリカンで見られるような繰り返し構造を持たずにタンパク質と結合している。糖タンパク質の糖鎖は、アミノ酸のアスパラギン酸に結合しているN結合型と、セリンやスレオニンに結合するО結合型糖鎖に分類されている。糖脂質は、スフィンゴ糖脂質とグリセロ糖脂質に分類されている。スフィンゴ糖脂質はスフィンゴシンに長鎖脂肪酸がアミド結合してできる化合物セラミドに単糖(主にガラクトース)が結合したもので、スフィンゴ糖脂質は大きくセレブロシドと、ガングリオシドに分類される。グリセロ糖脂質はグリセロールを1分子以上含む糖脂質で、一部の動物細胞、植物細胞や細菌に含まれることが示されている。
動物の細胞表面に存在する糖鎖は、主に膜に存在するタンパク質や脂質をコアに細胞外側に付加されるかたちで糖タンパク質・糖脂質として存在し、生体内で重要な機能性分子として働いていることが知られている。これらの細胞膜複合糖質は、多くの細胞で恒常的に発現して細胞表面を覆っていたり、常に流動的な脂質二重膜で構成される細胞膜にあって、機能的マイクロドメインに位置することでシグナル伝達やエンドサイトーシスに関わっていたりすることが知られている。それらの糖鎖を構成する単糖のうち、シアル酸は糖鎖の最末端位置に存在することが知られており、そのため、様々な内在性および外来性分子の認識または制御に直接的にかかわっていると考えられている。このシアル酸分子には著しく構造の多様性があることが知られており、特に外界と接触する粘膜面や免疫系に関与するシアル酸の変化とそれを認識する分子の動物種間での多様性は、動物の進化過程で獲得された性状であると考えられている1-3。
(1)インフルエンザウイルス由来のレクチン。レクチンとは、糖鎖を認識する分子の総称である。レクチンには、動物の生体内で発生、分化や恒常性維持のために機能している内在性レクチンに加え、細菌、ウイルスや植物に由来する外来性のレクチンなどがある。インフルエンザウイルスは、ウイルス粒子の構造蛋白質として、粒子表面にヘマグルチニン(HA)とノイラミニダーゼ(NA)という糖タンパク質を有し、いずれの分子も動物細胞上に発現しているシアル酸付加糖鎖を認識し、結合することが知られていることから、動物にとっての外来性レクチンの一つである。なかでもA型インフルエンザウイルスは、人を含む他種多様な動物種に感染する人獣共通感染症の原因微生物の一つであり、ウイルスが宿主とする各動物種の細胞表面に存在するシアロ糖鎖の種類によって、糖鎖を認識するHAやNAに構造変化や糖鎖修飾がおこっていることが知られている。つまり、鳥由来ウイルスのHAはガラクトースにシアル酸がα2,3結合したものを、ヒト由来ウイルスのHAは主としてα2,6結合したものを認識する傾向があることが知られている4。
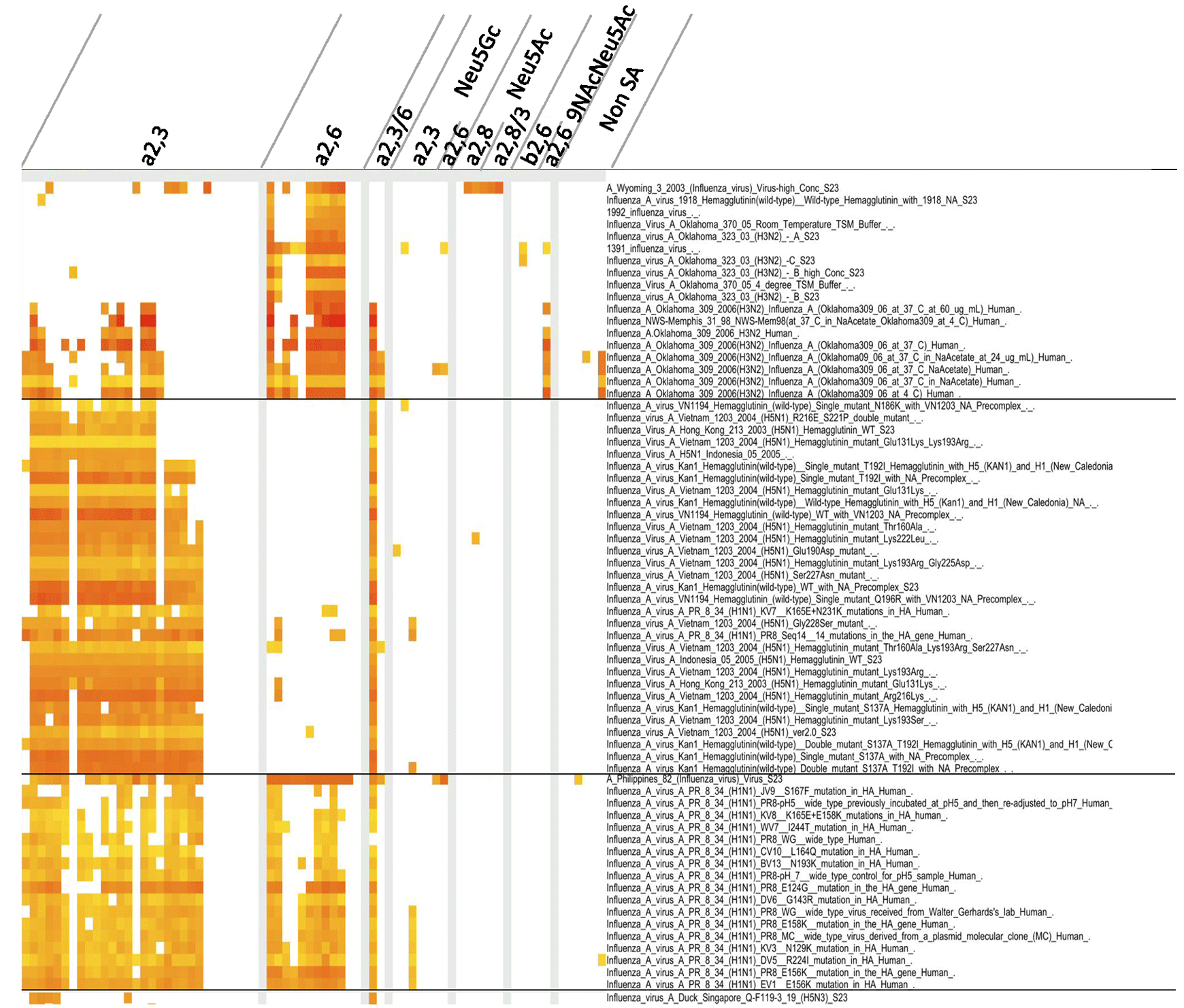
Fig.1 インフルエンザウイルスの糖鎖結合性。
インフルエンザウイルスのGlycan arrayデータをCFGデータベースより集めた。その糖鎖結合特性は、ODANGOシステムにより解析した。つまり、レクチン-糖鎖結合特性を結合強度によって強い結合と弱い結合の2群に分けた。弱いレクチン-糖鎖結合の群では、正規分布を示していたが、強いレクチン-糖鎖結合の群では正規分布の外れ値となった。この外れ値を示すレクチン-糖鎖結合を「特異的な結合」と判断し、陽性と判断した。糖鎖リストは、リンク先のエクセルファイルにて示す(http://dl.dropbox.com/u/23655125/Shinya_et_al_Table1_glycan-list.xlsx)。ODANGOシステムによる解析は名古屋大学大学院情報科学研究科複雑系科学専攻鈴木研究室による。
私たちは、The Consortium for Functional Glycomics (CFG; http://www.functionalglycomics.org/static/consortium/consortium.shtml)内のインフルエンザウイルスのGlycan arrayデータを用い、解析ソフトウエア「ODANGO ver.1」(Demo Movie; http://www.youtube.com/watch?v=rJJVAxnH-3s)による糖鎖結合パターン解析を行った(Fig. 1)。その結果、インフルエンザウイルスの糖鎖結合様式は、ウイルス株によって、実に様々なパターンを示すことが判明した。2003年に人から分離されたウイルス株では、高濃度のウイルス試料を除いて、α2,6結合のシアロ糖鎖に特異的に結合する傾向が見られた。これは、以前から証明されている結果と同じだった4。2006年に人から分離されたウイルス株では、α2,3およびα2,6結合の両方のシアロ糖鎖を認識していた。また、人から分離されたH5ウイルスは、ミュータントを含め、主にα2,3結合のシアロ糖鎖を認識しているが、いくつかのミュータントは、α2,6結合のシアロ糖鎖の一部も認識しているのが観察された。いっぽう、ワクチンウイルスA/Philippines/2/82 (H3N2)と実験室株であるA/Puerto Rico/8/34(H1N1)は、いずれも鶏卵でのウイルス継代の影響を反映していると思われるが、人由来のウイルスであるにもかかわらずα2,3とα2,6結合の両方の糖鎖を認識していた。水禽由来のA/Duck/Sigapore/Q-F119-3/19(H5N3)では、α2,3結合のシアロ糖鎖を認識していた。
これらのことから、H5亜型を含め、インフルエンザウイルス由来レクチンには、比較的糖鎖結合のレンジが広いものが含まれることがわかった。
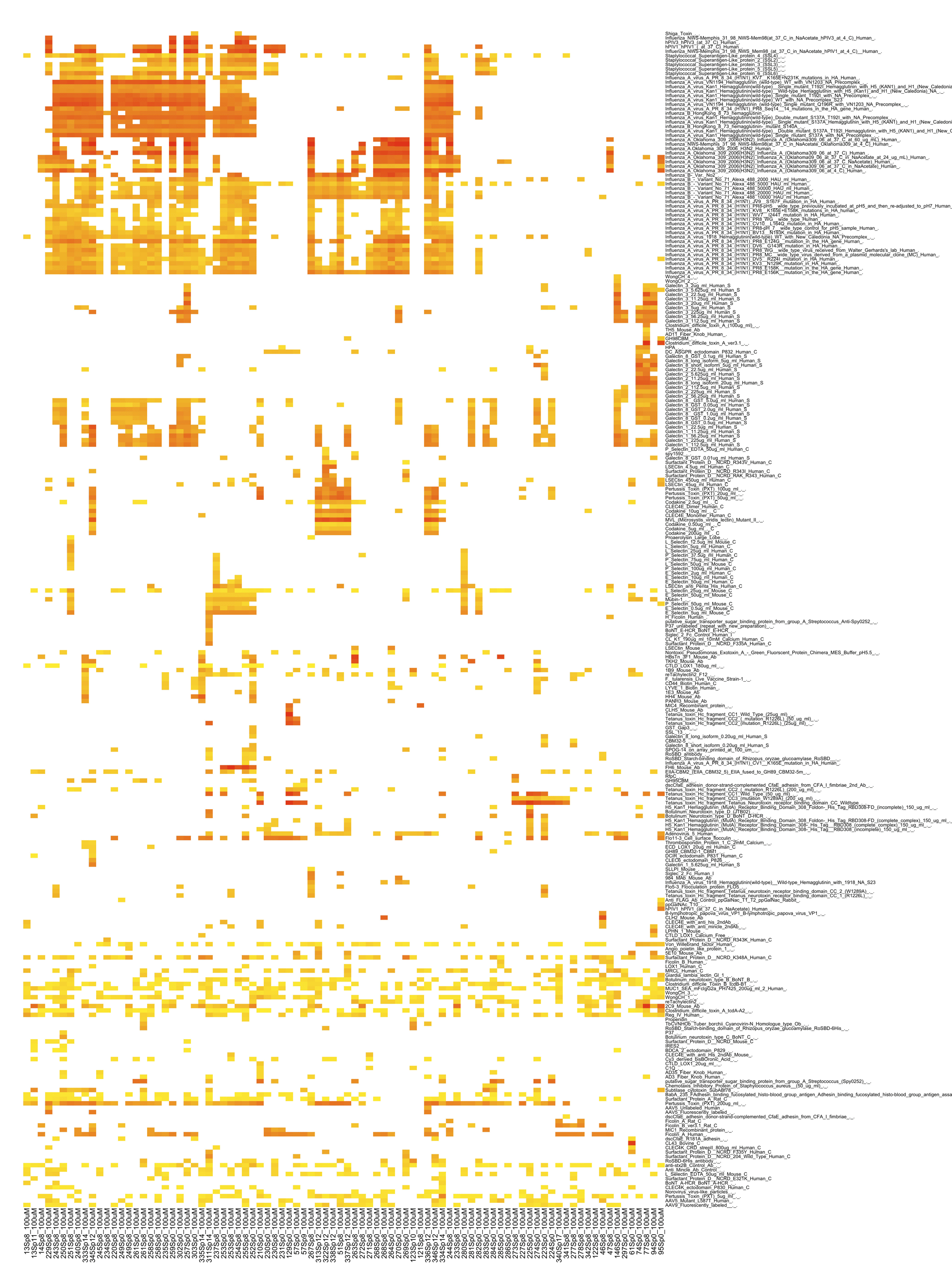
Fig.2 インフルエンザウイルスを含む病原体由来のレクチンと他の内在性レクチンの糖鎖結合性。
インフルエンザウイルスを含む病原体由来のレクチンと他の内在性レクチンの糖鎖結合性。各Glycan arrayデータをCFGデータベースより収集した。その後の解析はFig.1と同じ。ODANGOシステムによる解析は名古屋大学大学院情報科学研究科複雑系科学専攻鈴木研究室による。
(2)インフルエンザウイルスレクチンと内在性レクチンの糖鎖認識の違い。
インフルエンザウイルスは宿主内に侵入後、局所で増殖する。この際、大量の子孫ウイルスの生産にともなって、インフルエンザウイルス由来のレクチンであるHAおよびNAが発現する。外来性のレクチンが生体内で大量に発現することにより、生体ではどのような反応が起こり得るのかについては、あまり研究が進められていない。
私たちは、前述のCFGのGlycan arrayデータとODANGOシステムを活用し、生体内の内在性レクチンとインフルエンザウイルスや細菌由来の外来性レクチンの糖鎖結合様式を比較した(Fig. 2)。その結果、インフルエンザウイルスを含め、アデノウイルス、スタフィロコッカスや百日咳菌の細菌毒素などの病原体レクチンは、非常に広い糖鎖結合特性を示していることがわかった。いっぽう、生体内の内在性レクチンでは、多くのものは限られた構造の糖鎖を認識している特徴があった。しかしながら、ガレクチン1、8などの内在性レクチンは、例外的に、多種の糖鎖を認識していた。また、インフルエンザウイルス由来レクチンと内在性レクチンの糖鎖結合パターンを比較した場合、インフルエンザウイルス由来レクチンは、ガレクチン1や8などの内在性レクチンが認識している糖鎖群の多くを同様に認識していることがわかった。インフルエンザウイルスなどの微生物の感染によって生体が病気を発症するとき、その原因微生物は生体の恒常性攪乱物質として働いている、と表現されることがある。感染により生体内で大量に発現する外来性のレクチンは、生体内レクチンと類似した糖鎖結合パターンを示すことで、内在性レクチンが関与する体内の恒常性を大きく乱す原因となる可能性があることを意味している。
(1)生体内のシアロ糖鎖分布。前述のように、生体には多くのシアロ糖鎖が分布して機能していると言われている。私たちは、インフルエンザウイルスの研究を進める過程で、人の呼吸器や水禽の腸管の粘膜上皮でのα2,6型およびα2,3型シアロ糖鎖の分布を調べる機会を得た。植物レクチン(Sambucus nigraレクチンおよびMaackia amurensisレクチン。各々、α2,6結合型のシアロ糖鎖とα2,3結合型のシアロ糖鎖を認識すると言われている。)を用いた検索の結果、水禽でインフルエンザウイルス増殖部位とされている結腸粘膜上皮細胞には、従来の報告と同様、α2,3結合型のシアロ糖鎖が検出された5。また人の組織検索において、人の鼻粘膜呼吸部の上皮細胞では、α2,6結合型のシアロ糖鎖が主体となっている中に疎らにα2,3結合型のシアロ糖鎖が分布していること、気管や気管支上皮細胞上には主にα2,6結合型のシアロ糖鎖が分布していること、そして、終末細気管支と呼吸細気管支の間にあるクララ細胞と肺胞II型細胞には、α2,3結合型のシアロ糖鎖が分布していることが判明した6。このことは、水禽由来のウイルスがα2,3結合型のシアロ糖鎖を認識するHA分子を有していること、および、人の上気道で効率よく増殖する人由来ウイルスがα2,6結合型のシアロ糖鎖を認識するHAを有していることとよく一致している。また、α2,3結合型のシアロ糖鎖を認識する高病原性鳥インフルエンザウイルス感染患者の組織検査で、重症の肺炎を特徴とすること、その際、気管や気管支上皮には、感染の形跡が見られないか、すでに再生上皮を主体としており一過性の感染の形跡をみるにとどまることが多いのも、ウイルスのHA分子の糖鎖認識特性と各型のシアロ糖鎖の組織内分布をよく反映していると考えられる7。
(2)HA分子の糖鎖認識の変化にともなう組織内標的細胞の変化の可能性。上述のように、人の呼吸器内では、感染するインフルエンザウイルスのHAの糖鎖認識特性の違いにより、ウイルスが効率よく増殖する組織部位が異なることが示唆されている。このことは、2009年の世界流行ウイルスのHA変異株を用いた実験の結果が、その一部を明確に証明しており、HAの糖鎖認識がα2,3型結合のシアロ糖鎖に傾いたウイルスは、人の肺胞II型細胞への感染性が上昇することがわかっている8。このように、人の呼吸器組織内でのシアロ糖鎖分布が判明してから同組織を対象としてシアロ糖鎖の分布に重心を置いたウイルス学的研究は比較的良く進められているが、同じく多くの機能性シアロ糖鎖を発現していることが知られている免疫細胞に対するウイルス感染性の変化とその影響についてはあまり調べられていない。ウエブスター博士らの研究グループでは、糖鎖認識特性の変化したH5ウイルスはオリジナルのウイルスと抗体産生刺激能が異なることを報告しており、ウイルスの糖鎖認識の違いが生体の免疫系への刺激を変えている可能性があることを示している9, 10。事実、免疫細胞上に発現しているシアロ糖鎖は、その細胞種によって様々であることが知られている。インフルエンザウイルス感染によって局所に動員される免疫細胞とウイルスの糖鎖−レクチン結合の関係に重点を置いた更なる研究の進展が望まれる。
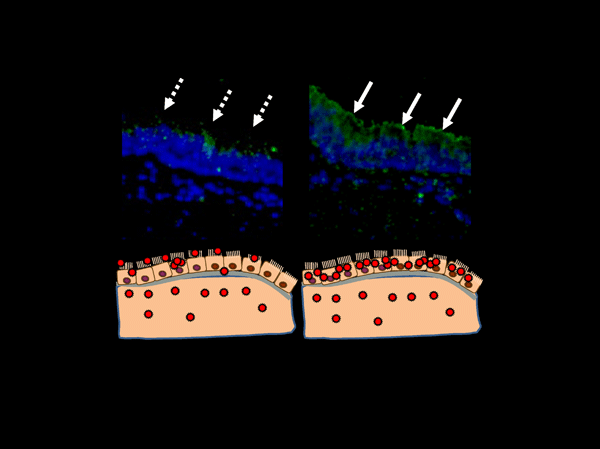
Fig.3 A型インフルエンザウイルスHAの糖鎖結合性変化の意義。
人の気管支上皮細胞に発現しているシアロ糖鎖に糖鎖結合特性が一致しているウイルスは、人の気管支上皮細胞により効率よく結合した(右上:文献13より引用)。感染成立のために、ウイルスを標的細胞に効率よく集結する機構と考えられる。
レクチンは内在性・外来性にかかわらず、抗原抗体結合の場合と異なり、比較的弱い結合を量で補うという方法で糖鎖に結合していると言われている12。この点を考慮すると、インフルエンザウイルスのHA分子によるシアロ糖鎖結合性は、双方の発現量に大きく影響されていると考えられる。つまり、生体内に発現したある型のシアロ糖鎖に特異的に結合するHA分子を持つことで、その標的細胞により多くのウイルス粒子を集結する効率を上昇させる、という点にインフルエンザウイルスにとっての生物学的利点があると考えられる。事実、私たちの実験結果は、人の呼吸器上皮細胞に発現しているシアロ糖鎖に糖鎖結合特性が一致しているウイルスが、人の呼吸器上皮細胞により効率よく結合することを示している13。シアロ糖鎖はインフルエンザウイルスの受容体と称されてきた。しかしながら、シアル酸以外で、広くウイルス・寄生虫・細菌や酵母などと結合し、抗原提示のためのリガンドを取り込む抗原レセプターとしての役割を果たす分子群へのウイルス結合なども挙げられており、また、ウイルスの感染効率が悪い細胞においても、ウイルスを高濃度で感染させた場合には、ウイルスの感染が成立することはよく知られている現象である。Glycan Arrayのデータでも、高濃度のインフルエンザウイルスは通常の濃度のウイルスのシアロ糖鎖認識と異なる糖鎖結合性を示しているのが観察される(Fig. 1)。つまりインフルエンザウイルスの分子結合特性は曖昧で幅広いことがわかる12,14-16。したがって、シアロ糖鎖は、ウイルス接着とエントリーにかかわるウイルス受容体機能のうち、ウイルスを効率よく標的細胞に集結・接着させる媒介分子として有効に活用されていると考えられる。ウイルスは標的細胞に集結する効率を上げることによって、雑多な分子が存在する生体局所で、速く効率よく感染を成立させることができる(Fig. 3)。
インフルエンザウイルスのもう一つの糖鎖結合分子、NA分子の生体内発現における病態への関与についてはあまり調べられていない。私たちは以前に、インフルエンザウイルス由来のNA分子を全身に発現するトランスジェニックマウスを作成することを試みて失敗に終わった経験がある。インフルエンザウイルスのNA分子はシアル酸分解機能があり、その機能が、シアロ糖鎖が関与したシグナル伝達を必要とする個体発生過程で、強く影響した結果ではないかと考察している。また、ウイルスの感染により脱シアル化が起こった状態の免疫細胞に刺激を加えると、ウイルスが感染していない場合の刺激よりも強い反応が起こることが判明している。感染局所に発現されるインフルエンザウイルス由来のシアル酸分解酵素が、生体内で様々な機能を有しているシアロ糖鎖を脱シアル化することで、その病態にどの様な影響を及ぼしているのか、更なる研究の発展が望まれる。
謝辞
ウイルスや生体を用いた実験データは、東京大学医科学研究所、河岡義裕博士との共同研究による。ODANGOシステムを用いたデータ解析は、名古屋大学大学院 情報科学研究科 複雑系科学専攻 複雑系計算論講座、角田健治氏、藤江正宏氏との共同研究による。英文校閲はBruce Collins氏による。