氏名:柳澤 勝彦
国立長寿医療研究センター・痴呆疾患研究部
アルツハイマー病(AD)の発症機構を議論する上で最も重要な課題の一つは、可溶性のアミロイドβ蛋白質(Aβ)がどのような機序で重合し、神経毒性を発揮するアミロイド線維やオリゴマーに成長するのかという問題である。この課題に関して、筆者らは、Aβは脳内においてガングリオシドと結合し構造変化を獲得したガングリオシド結合型Aβ(ganglioside-bound Aβ: GAβ)が形成され、これがAβ重合の内因性の「種」となって働く可能性を示し1、その後、この仮説は国内外の多数の研究グループにより支持されている2。
興味深いことに、AD発症の危険因子である脳老化やアポリポ蛋白質E4の発現は、Aβの重合開始部位である神経突起末端において、GAβ形成に適したガングリオシドの密集した特異なマイクロドメインの形成を誘導することが示されている2。加えて、以前よりAD脳神経細胞の病理学的所見として注目されているエンドサイトーシスの異常は、この神経突起末端部でのGAβ依存性Aβ重合を促進することも明かにされている2。さらに、最近、超高磁場NMRを用いた解析により、ガングリオシドとの結合によるAβの構造変化が確認され、またガングリオシドの存在下で形成されるアミロイド線維には、高い神経細胞毒性が備わることも確認された3。これらの一連の研究で明らかにされた事実は、ADを含む多数のヒトのアミロイド蓄積性疾患(アミロイドーシス)に共通する分子機序、即ち、生理的には単体で存在する生体内の蛋白質が構造変化を獲得し、細胞毒性を伴う異常な重合体に成長する過程を解明する上で、重要な手がかりを提供していると考えられる。
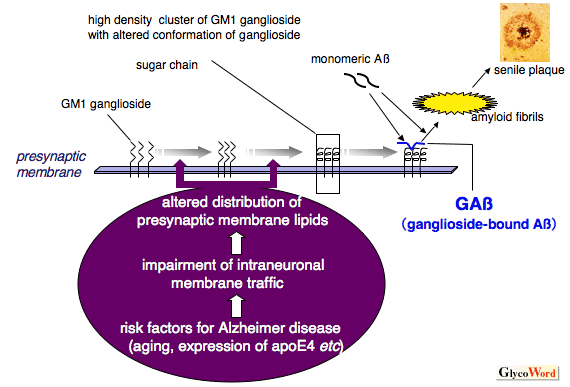
図 アルツハイマー病脳において想定されるガングリオシド誘導性のアミロイド形成の分子機序