
氏名:高橋 忠伸
静岡県立大学 薬学部 生化学分野
1999年静岡県立大学薬学部薬学科卒業。2001年静岡県立大学大学院薬学研究科博士前期課程薬学専攻修了。2004年静岡県立大学大学院薬学研究科博士後期課程薬学専攻修了。2004年4月より科学技術振興機構戦略的創造事業(CREST)博士研究員(プログラム名「ウイルス感染における糖鎖機能の解明と創薬への応用」)。2006年4月より静岡県立大学薬学部生体情報分子解析学助手。2007年5月より静岡県立大学薬学部生化学分野助教。

氏名:鈴木 隆
静岡県立大学 薬学部 生化学分野
1979年静岡県立静岡薬科大学卒業。1981年静岡薬科大学大学院薬学研究科修士課程修了。1984年静岡薬科大学大学院薬学研究科博士課程修了。1984〜1990年シノテスト研究所研究員。1991年静岡県立大学薬学部生化学講座助手。1994年静岡県立大学薬学部生化学講座講師。1996年静岡県立大学薬学部生化学講座助教授。1998〜1999年文部科学省在外研究員(米国St. Jude Children’s Research Hospital客員研究員)。2006年4月より静岡県立大学薬学部生化学分野教授。
硫酸化糖脂質の3-O-硫酸化ガラクトシルセラミド(スルファチド)は、脳、腎、呼吸器や消化器等の組織に存在している。細胞においては、ゴルジ装置、細胞膜、リソソームに局在が見られる。スルファチドの代謝は多くのガングリオシドに比較して極めて単純である。スルファチドの合成は、小胞体でUDP-ガラクトースからセラミドへのガラクトース付加によって開始される。この反応はUDP-ガラクトース:セラミドガラクトシルトランスフェラーゼ(CGT; EC 2. 4. 1. 45)によって触媒される1。生成したガラクトシルセラミド(GalCer)はゴルジ装置へ輸送され、3'-phosphoadenosine 5'-phosphosulfate (PAPS):セレブロシドスルフォトランスフェラーゼ(CST; EC 2. 8. 2. 11)によって硫酸基を付加されてスルファチドが合成される2。CSTは、ホモ二量体タンパク質で、後期ゴルジ装置に局在性する3。一方、スルファチドは主にリソソームに存在するアリールスルファターゼ(ASA; EC 3. 1. 6. 8)によって脱硫酸化されることで分解される。この分解反応は、スフィンゴ糖脂質活性化タンパク質-1(SAP-1)、いわゆるサポシンB(SapB)を必要とする。SapBはスルファチドを膜から抽出し、ASAの反応性を高めている4(図1)。近年、スルファターゼに依存しない別のスルファチド分解経路の存在が示唆されている。神経芽細胞腫はスルファチドの脱硫酸化を介さずに、エンドサイトーシスされたスルファチドからセラミドを生成できることが示されている5。スルファチドのセラミド部分は様々な構造を示す。すべてのスフィンゴ糖脂質のセラミド部分と同様に、そのアシル基の長さは異なり、水酸化を受けていることもある。
リソソーム酵素ASAの欠損6やSapBコード領域の変異7はリソソーム中へのスルファチドの蓄積を起こし、脱髄疾患の異染性白室ジストロフィー(MLD)を発症させる。スルファチドは、神経系、糖尿病、免疫系、血栓形成、細菌感染、エイズウイルスなどのウイルス感染に関連した、生物学的に多機能な糖脂質である。筆者らの最近の研究から、スルファチドがインフルエンザA型ウイルスの増殖を促進させる機能を持つことが明らかになった。スルファチドは、インフルエンザA型ウイルス感染細胞において、新たに生合成されたウイルス膜糖タンパク質のヘマグルチニン(HA)と細胞膜上で結合することで、新生ウイルス核タンパク質(vRNP)複合体の核外輸送を誘導することで感染細胞の子孫ウイルス産生を促進させていた8。本総説では、筆者らの研究により明らかになったインフルエンザA型ウイルス感染におけるスルファチドの機能ついて紹介する。
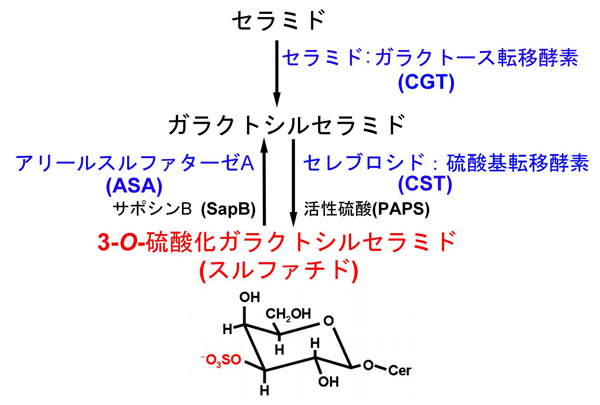
図 1 スルファチドの代謝経路
下部にスルファチドの構造を示す。スルファチド(赤字)は、二つの転移酵素(CGT、CST)によりセラミドからガラクトシルセラミドを経て合成される。また、スルファチドはASAにより硫酸基(スルファチド構造中の赤い部分)が分解され、ガラクトシルセラミドへ代謝される。本研究で使用したスルファチド代謝酵素遺伝子を青字で示した。
インフルエンザA型ウイルスはヒトを含む多くの哺乳動物やトリに感染伝播する。ウイルス表面には二つのスパイク状糖タンパク質、HAとノイラミニダーゼ(NA)が存在する。ウイルスのHAが細胞膜表面に存在するシアル酸へ結合すると感染が開始される。シアル酸はインフルエンザA型ウイルスの受容体であることから、HAとシアル酸の結合機構は今まで活発に研究されてきた9。一方、NAはシアル酸を破壊するシアリダーゼ活性を有しており、感染細胞からの子孫ウイルスの播種を有利にしている。また最近、ウイルスがエンドサイトーシスを介して細胞へ進入する過程において、NAのシアリダーゼ活性がウイルスの感染増殖に重要であるとの報告もなされている10,11。スルファチドは、インフルエンザA型ウイルスが増殖できる様々な上皮細胞や動物組織に普遍的に見られる。著者らは、スルファチドがシアル酸を含んでいない糖脂質であるにもかかわらず、インフルエンザA型ウイルスと結合できることを世界で初めて発見した12。
筆者らはインフルエンザA型ウイルス感染におけるスルファチドの機能を明らかにすることを目的に、CGT欠損のためスルファチドを合成できないアフリカミドリザル腎臓由来(COS7)細胞とCOS7細胞にスルファチドの発現に必要な遺伝子を導入した細胞、さらにインフルエンザA型ウイルスの分離に使用するイヌ腎臓(MDCK)細胞のスルファチドをノックダウンした細胞を用いて、インフルエンザA型ウイルスA/WSN/33 (H1N1)株の感染増殖性を比較した。
具体的には、スルファチドを豊富に発現するMDCK細胞から得たCST遺伝子とCGT遺伝子をCOS7細胞へ導入し、スルファチドを安定的に高発現する二つの細胞クローン(SulCOS1およびSulCOS2)を取得した。これらの細胞におけるウイルスの感染増殖性をウイルス抗原の免疫染色により確認した結果、スルファチド高発現細胞におけるウイルスの増殖性は、親株細胞と比較して明らかに促進されていた(図2)。またスルファチド高発現細胞の培養上清中の子ウイルス感染価(ウイルス増殖性の指標)は、親細胞の500から3000倍もの高い数値を示した。対照的に、スルファチド高発現細胞におけるウイルスの初期感染性は、親細胞と比較して約28%減少した。
細胞内在性スルファチドの発現を抑制させた場合のウイルス増殖性におよぼす影響を評価するために、MDCK細胞を用いて、スルファチドを特異的に分解する酵素(ASA)遺伝子の導入とCST mRNAに対するRNA干渉(RNAi)によりスルファチド発現抑制細胞を作製した。ASA遺伝子を安定的に発現させたMDCK細胞のウイルス増殖性は、親細胞の培養上清中の子ウイルス価と比較したとき、約60分の1に減少した。一方、初期感染性はわずかな増加が見られた。MDCK細胞の内在性CST mRNAに対してRNAiを適用した場合も、ウイルス増殖性は顕著に減少した。また、他のインフルエンザA型ウイルス株も亜型(H1N1、H3N2、H5N3)や宿主(ヒト、トリ)に関係なく、スルファチド高発現細胞においてその増殖性は著しく増加した。これらの結果から、動物細胞に発現するスルファチドはインフルエンザA型ウイルスの増殖性を顕著に促進することが判明した。また、スルファチドはシアル酸のようにウイルスの感染成立に関わる受容体ではないことが判明した。

図 2 スルファチド発現細胞でインフルエンザA型ウイルス増殖性が高い
スルファチドを合成できない親細胞へ、二つのスルファチド合成酵素(CGT、CST)遺伝子を導入して2株のスルファチド発現細胞(赤字)を作製した。インフルエンザA型ウイルス感染細胞は、ウイルス抗原染色により青い細胞として確認される。ウイルス感染後37℃で24時間培養した細胞を光学顕微鏡40倍率下(上段)および培養プレートウェルのイメージ(下段)で示した。スルファチド高発現細胞のウイルス増殖性が親細胞に比べて極めて高いことが分かる。
筆者らは以前の研究において、マウス抗スルファチド単クローン抗体(GS-5)の作製に成功している13。そこで、インフルエンザA型ウイルス感染増殖におけるGS-5の作用を調べるため、ウイルス感染前、感染時、感染後のMDCK細胞へそれぞれGS-5を添加した。その結果、ウイルス感染前と感染時にGS-5を添加してもウイルスの感染性や増殖性に影響を与えなかったが、ウイルス感染後にGS-5を添加した場合にはウイルス増殖を強力に抑制することが判明した。GS-5のウイルス増殖抑制効果は、感染後0〜2時間のGS-5添加では認められず、感染後4〜24時間のGS-5添加で観察された。ウイルス膜タンパク質HAやNAは、37℃においておよそ感染5時間後から細胞表面上に発現することから、細胞表面においてウイルスタンパク質がスルファチドとなんらかの相互作用を持つことが示唆された。さらに、GS-5は、亜型(H1N1、H3N2、H5N3)や宿主(ヒト、トリ)に関係なくインフルエンザA型ウイルス株の増殖を抑制することが判明した。このため、細胞膜表面のスルファチドがインフルエンザA型ウイルス増殖に関与しているものと示唆される。
さらに、抗スルファチド抗体がin vivoでもインフルエンザA型ウイルスの増殖阻害効果を示すことを確認するために、GS-5を感染1日前から5日間、毎日一回経鼻的に投与したC57BL/6マウスにマウス病原性インフルエンザA型ウイルス A/WSN/33 (H1N1)株を経鼻的に接種した。その結果、GS-5の投与は、100%の致死的なウイルス感染から50%のマウスを回復させ、マウス肺での子ウイルス価を顕著に減少させた。
インフルエンザA型ウイルスのNPは感染細胞の核内で、ウイルスRNAポリメラーゼ(PB1、PB2、PA)と8分節のウイルスRNAゲノムと共に、ウイルスリボ核タンパク質(vRNP)複合体を形成する。一度、核に集積したvRNA複合体は細胞質へと輸送されていく。一方、ウイルス表面糖タンパク質HAとNAは、ゴルジ装置で糖鎖付加を受けて細胞膜表面上へ輸送される。筆者らは、インフルエンザA型ウイルスA/Memphis/1/71 (H3N2)株を感染させた細胞内で新たに合成されたウイルスNP、HA、NAの細胞内分布をそれぞれの特異的単クローン抗体で検出した。感染7時間後のスルファチド高発現細胞では、大部分の新生HAとNAは細胞表面へ移行し、核に集積した大部分の新生NPは細胞質へ移行していた。親COS7細胞では、大部分の新生HAとNAは細胞表面へ移行していたが、大部分の新生NPは核に留まっていた。またウイルス感染後にGS-5添加したスルファチド高発現細胞では、新生HAが通常の細胞膜表面への移行を見せたのにも関わらず、新生NPは核に留まっていた。この結果から、おそらく細胞表面上のスルファチドはウイルス増殖過程中のvRNP複合体の核外輸送を促進することにより、感染性子孫ウイルス粒子の形成を増加させることが示唆される。
スルファチドによって制御されるウイルスNPの核外輸送にHAまたはNAが関与するのか調べるために、インフルエンザA型ウイルスA/Memphis/1/71 (H3N2)株を感染させたスルファチド高発現細胞へ、ウイルス-スルファチド間の結合を阻害するマウス抗H3 HA単クローン抗体(2E10)を添加した。新生NPの核から細胞質への輸送は、GS-5添加時と同様に2E10添加によっても抑制された。一方、ウイルス-スルファチド間の結合を阻害しないマウス抗H3 HA単クローン抗体(1F8)、マウス抗N2 NA単クローン抗体(SI-4)の添加は、ウイルスNPの核外輸送を抑制しなかった。これらの結果は、細胞表面上へ移行したHAとスルファチドが結合することが新生NPの核から細胞質への輸送を誘導することを示唆している。
筆者らはHAとスルファチドが直接結合することを明らかにするため、バキュロウイルス-タンパク質発現システムを用いて昆虫細胞でインフルエンザA型ウイルスA/duck/Hong Kong/313/4/78 (H5N3)株のHAを作製した。昆虫細胞上に発現したHAはウイルスのHAと同様の赤血球吸着活性や抗原性を示した。そこで、昆虫細胞上に発現したHAを界面活性剤で抽出後、HAのC末端に付加したHis-タグ配列によりアフィニティー精製した。また、精製したHAは高い赤血球凝集活性を有し、HAの赤血球凝集活性は抗H5HA単クローン抗体により特異的に阻害された。さらに、このHAはシアロ糖鎖とスルファチドの両方に結合性を示した。これにより、HAがスルファチドへ結合するウイルスタンパク質であることが明らかになった14。一方、スルファチドはNAのシアリダーゼ活性を酸性領域で阻害する活性を有していることから15、スルファチドとNAの相互作用も今後検討する必要があるものと思われる。
スルファチドは細胞表面に移行したHAと結合すると、なんらかの細胞内シグナルを開始して、インフルエンザA型ウイルスの新生vRNP複合体の核から細胞質への輸送を促進させる機能があるものと考えられる8(図3)。抗スルファチド単クローン抗体の投与は、ウイルス感染後でさえ、ウイルス増殖を強力に抑制し、致死的感染マウスを回復させた。抗ウイルス剤の開発は、おそらく次のインフルエンザA型ウイルスの世界的大流行(パンデミック)に対する備えにおいて、極めて重要な要素となる。現在、オセルタミビル(タミフル)に代表されるNA阻害剤がインフルエンザの予防や治療に使用されている。しかしながら、2007年に北欧で発生したAソ連H1N1型のオセルタミビル耐性ウイルス株は2008年までに世界中に拡大しており、薬剤耐性ウイルスの出現が深刻な問題として残っている。現在流行しているほとんどのヒトインフルエンザA型ウイルスは、アマンタジンのようなウイルスM2イオンチャンネル阻害剤にも耐性化している。インフルエンザA型ウイルスのHA-スルファチド間の結合阻害剤は、従来の薬剤耐性化ウイルスや、感染が進行して重篤な状態の患者にさえ使用できる、もっと効果的な新規抗ウイルス剤となる可能性を秘めている。
しかしながら、スルファチドは神経系、糖尿病、免疫系、止血/血栓形成、細菌感染、ウイルス感染に関与する極めて多機能な糖脂質である。それ故に、もし、スルファチドに対する直接的な結合剤やスルファチド代謝経路に影響する遺伝子的操作または薬理学的因子により、宿主細胞側のスルファチドやその発現をブロックしたとき、これを適用した宿主にはスルファチドの機能に関連する多くの副作用が発症するものと予想される。
インフルエンザ治療において、ウイルスHA上のスルファチド結合部位を特異的に標的とする阻害剤は、予測される副作用を防ぐとともに、子孫ウイルス粒子の形成・産生を直接阻害できるものと予想される。一方、従来のNA阻害剤は子孫ウイルスの感染細胞からの遊離のみを阻害し、子孫ウイルス粒子の形成・産生を阻害しない。このため、HA-スルファチド間の結合阻害剤はNA阻害剤よりも強力な抗ウイルス活性を有することが予想され、インフルエンザ治療に極めて有効なツールとなるかもしれない。
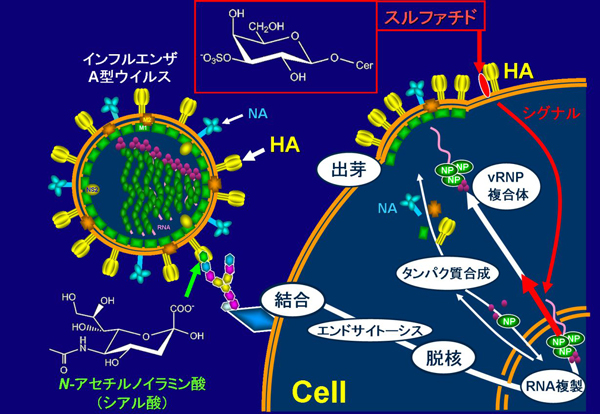
図 3 スルファチドのインフルエンザA型ウイルス増殖促進機構
インフルエンザA型ウイルスは宿主細胞表面上の糖鎖末端に存在するシアル酸を受容体として結合する。その後、エンドサイトーシスされたウイルスは、エンドソーム/リソソーム中の酸性条件を引き金に細胞融合を起こし、ウイルスゲノムを細胞質へ脱核する。核で複製されたウイルスゲノムは、新しく合成されたウイルスのNPやRNAポリメラーゼとウイルスリボ核タンパク質(vRNP)複合体を形成して、核内から細胞質へ輸送される。一方、感染細胞内で新しく合成されたウイルス膜糖タンパク質HAやNAは、細胞膜表面へ移行する。vRNP複合体、HA、NAは他のウイルス構成タンパク質とともに、細胞膜表面から出芽して子孫ウイルス粒子を形成する。スルファチドは細胞表面へ移行したHAと結合すると細胞内へシグナルを開始し(細胞内の細い赤矢印)、vRNP複合体の核外輸送を促進する(細胞内の太い赤矢印)ものと考えられる。これにより子孫ウイルス粒子の形成とウイルス増殖が促進される。