
氏名:Davide Vigetti
Davide Vigetti は、1996年にUniversity of Milan (イタリア)で生物学の学位を優等で取得した。その後、University of Insubria (Varese、イタリア)理学部へ移り、進化および発生生物学のPh.D.を2001年に取得している。研究テーマは、脊椎動物におけるプリン分解経路の進行性消退の分子機序についてであり、両生類であるアフリカツメガエルをモデルとして使用した。2004年にUniversity of Insubria 医学部生化学の助手となった彼は、そこで糖質科学の世界に魅了された。そしてUDP-糖前駆体がXenopusのみならず哺乳類細胞にも持つ重要な役割を同定することで、HA合成を制御する細胞内機序についての研究を始めた。

氏名:Michela Ori
Michela Ori は、University of Pisa(イタリア)生物学科、細胞および発生生物学ユニットの若きグループリーダーである。2001年1月にUniversity of Pisaにて、Xenopusをモデルシステムに使用した、頭部神経堤細胞の発生に伴うホメオティック遺伝子Hoxa2の役割についての研究「細胞と発生における分子生物学および生物物理学」でPh.D.を取得した。このプロジェクトに携わる間にフランス・ストラスブールにあるIGBMCのF. M. Rijli教授の研究室に1年間籍を置いた。ピサに戻ってからも同教授の研究グループとは有効な研究協力体制を維持し、Xenopusの神経堤細胞発生の遺伝子制御の研究を続ける一方で、発生神経生物学の分野でも新しいプロジェクトを発足させた。発生生物学への興味は、細胞同士そして細胞外の環境と細胞はいかにして相互作用するのか、という問題を提起した。とくにUniversity of ParmaのR. Perris教授との共同研究の結果Xenopusの発生におけるヒアルロン酸の役割に関する新しい研究を発足させた。2005年からは、自身の研究室を立ち上げ、頭部神経堤細胞の発生および筋肉の再生における、ヒアルロン酸、ヒアルロン受容体そしてバーシカンの役割の研究に重点をおいている。そしてアフリカツメガエルは今も最愛のモデルシステムである!

氏名:Alberto Passi
Alberto Passi M.D.、Ph.D.は、University of Insubria, Medical School 生化学の教授であり、同大学の運動・スポーツ科学部長そして生物医学・実験・臨床科学学部(DSBSC)生化学研究室の部長でもある。Ph.D.取得後は、細胞外マトリックスの代謝に科学的興味を寄せるようになった。当初は、細胞培養、肺および血管系組織を用いて、細胞外マトリックスの高分子における遊離基とプロテアーゼの影響を含む、プロテオグライカンの代謝の研究にいそしんでいた。Cleveland Clinic(アメリカ)のVincent Hascall教授の研究室でサバティカルを過ごしてからは、彼の研究はヒアルロン酸に移行していった。特に注力したのはヒアルロン酸代謝とその制御についてである。現在のPassi研究室の主要な研究テーマは、グリコサミノグリカン合成におけるUDP-糖前駆体の役割と、グリコサミノグリカン代謝に関わる酵素の共有結合修飾についてである。
ヒアルロン酸(HA)は、胚性細胞外マトリックス(ECM)に豊富に存在し、生体に決定的な機能を持ったグリコサミノグリカン(GAG)である。HAは、間質性マトリックスの正しい組み立て、シグナル伝達受容体(CD44、RHAMM、TLR4/2、LYVE-1およびHAREなど)に結合して細胞挙動を左右することからその重要性が認識されている。本稿では、脊椎動物発生の研究に馴染み深いモデル生物である両生類Xenopus laevis(アフリカツメガエル)を使用し、HAとその代謝にかかわる酵素の重要性について述べる。同時に、個体発生は系統発生を繰り返すという生物発生原則の観点から、HAと他のGAGにおける進化の問題についても論じたい。
ECMは、生体において多種多様の役割を担っている。構造的、機械的そして栄養物と廃棄物の交換を可能にする栄養上の機能をもつ。その上、病原体と戦い、生理学的細胞交代の残骸の除去を目的に血管から組織に移動してくる免疫細胞にとってECMは「戦場」である。さらにECMは、成長因子、細胞分裂誘起物質、ケモカイン、サイトカインのようなシグナル分子に結合し、組織微小環境を細胞の増殖、遊走そして分化に適した状態にすることもできる。胚発生期におけるモルフォゲンの濃度勾配は、正しい順序の時空的シグナル伝達を可能にする特異なECM成分によって維持される。このECM組成は、組織あるいは細胞の機能に応じて変化する。さらに、生理的、病理的な刺激に対する反応にとって、ECMの再構築は重要なステップであることは広く認識されている。
ECMにおける多糖類成分の存在は、単細胞から多細胞生物への進化の過程で保存されてきた。糖が存在する最大の理由は、特定の細胞間の認識や相互作用を可能にする多様性にある。脊椎動物の主要なECM多糖類は、HA、コンドロイチン硫酸、デルマタン硫酸、ヘパラン硫酸そしてケラタン硫酸である。通常はタンパク質と共有結合はしていないHAを除けば、これらはプロテオグライカン(PG)のGAG鎖を構成している。
HAは非硫酸化の直鎖型GAGで、ベータ1,4とベータ1,3のグリコシド結合で交互に連結したD -グルクロン酸とN-アセチルグルコサミンの繰り返しで構成されている。ゴルジ体で合成されるほかのGAGとは対照的に、基質として細胞質UDP-GlcUAおよびUDP-GlcNAcを使う3種のHA合成酵素(HAS 1、2および 3)によってHAは細胞膜で直接合成される1。後者の化合物は、細胞質で順番にUDP-グルコース合成酵素(UGPP)とグルクロン酸回路系酵素(UGDH)によって合成される。ポリマー鎖の長さが一様でないのは、HASが異なる生化学的特性をもつだけでなく2、HA分解酵素であるヒアルロニダーゼ(Hyal)がいくつか存在するためである3。
硫酸化とコアタンパク質の存在に起因する、ほかのGAGのもつ構造の複雑さに比べるとHAの化学構造が比較的に単純である。したがって、その分子量の多様さ、HAと相互作用するタンパク質の構造が、生物学的意義の情報をHAに取り込む唯一の方法となる。つまり、細胞学的特性に対するHAの影響の度合いは、分子量に大きく左右される4。こうした関係から、脊椎動物発生研究のモデル生物である両生類Xenopus laevisにおけるHA含量が細胞挙動を制御できることは明白であり、これこそが本稿の主要なテーマである。同時に個体発生は系統発生を反復するという生物発生原則の観点から、HAや他のGAGの進化に関する相違点についても論じたい。
GAGの形成は、細胞内におけるUDP-糖の有無に依存する5。このような細胞生合成の特徴は、細胞代謝エネルギーが同化経路に利用されていること示唆している。つまり、GAGを生成する細胞のエネルギーバランスはプラスでなくてはならない。実際にUDP-糖前駆体は、エネルギー消費の高い分子である。なぜなら、UDP-糖は合成する上で解糖と競合するためである。この理由から、酸素が十分に供給される健常組織ではGAG合成が容易であることがわかる。酸素がUDP-GlcUA合成に必要な酸化反応を起こし、健常組織が解糖を下方制御するためである(Fig. 1)。ウロン酸を含有しないケラタン硫酸(KS)以外のすべてのGAGにとって、UDP-GlcUAの合成は重要な手順である。さらに、KSは脈管系を持たない酸素供給の乏しい角膜や関節軟骨内部といった組織に主として存在する6, 7。このような部域で、KSがCSのための代替を務めると考えられる。合成にはウロン酸を要するので、必然的に十分な酸素の供給が求められるからである8。KSが胎生組織にはほとんど存在せず、酸素があまり供給されない組織や、老化組織に増加することは驚くべきことではない。
UDP-GlcUA の合成は、UDP-GlcUAを前駆体UDP-Glcから産生するグルクロン酸脱水素酵素(UGDH)の活性を要する。この反応が成立するには、NADの存在が必要である。NADは、UDP-Glc のC-6糖が2段階酸化をする間にNADHに還元される。これはかなり珍しい反応である。同じC-6糖の二重酸化は、アルコール基からカルボン酸基に還元されてUDP-Glc から2つNADH/molを産生するが、これも自然界では珍しい。こうしたGAG合成の特徴により、エネルギーバランスにおけるUDP-GlcUAの重要性を認識できる。グルコースからUDP-GlcUA に至るすべての同化経路への段階を考慮すると(Fig. 1)、UDP-GlcUA合成で消費されたエネルギーは、ATP分子を産生する上で生じるNADHのミトコンドリアの再酸化によって完全に取り返されていることが明白になる。事実、UAとヘキソサミンが1:1の割合で存在するGAGの化学量論を考えれば、GAGの非硫酸化骨格合成にかかるエネルギーは、UDP-GlcのC-6酸化によって賄われている。このことは、硫酸化がないためにエネルギーがGAGの主鎖合成に使われるHAにとっては特筆すべきことであり、このGAGを合成するためのエネルギーバランスは、UDP-GlcUA合成により生成されたNADHの再酸化にすべて補われてしまうのである。
われわれがGAG合成におけるUDP糖前駆体濃度の影響について調べた結果、細胞のUDP-GlcUA濃度の変化はHA合成に影響するだけでなく、この合成に関与する酵素の遺伝子発現パターンを修飾するということが証明できた。このことは細胞質と原子核との間に情報交換が存在することを示す5。
ここで注目したいのは、合成を確認できるのは初期脊椎動物からであるため、HAが生体の進化の歴史に登場するのが、比較的遅いことである。ただし、いくつかの微生物病原体は、宿主の免疫システムから逃れるためにHAを合成することができる。しかし、こうしたHASは哺乳類のHASと相同であるため、おそらくHAS酵素を宿主から獲得したと考えられるが、これらのHA合成経路の起源に関してはまだはっきりとしたことはわかっていない (この件に関しては、HA Todayに掲載されているWiegelによる論文を参照)。
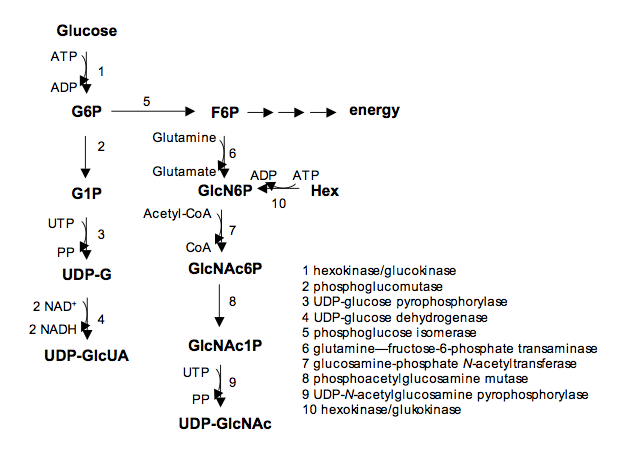
Fig. 1
FHA前駆体生合成の細胞内生化学経路。G6P 、グルコース-6-リン酸、G1P 、グルコース-1-リン酸、UDP-G 、UDPグルコース、UDP-GlcUA 、UDP-グルクロン酸、F6P 、フルクトース-6-リン酸、GlcNAc6P 、N‐アセチルグルコサミン‐6‐リン酸、GlcNAc1P 、N‐アセチルグルコサミン‐1‐リン酸、UDP-GlcNAc 、UDP-N-アセチルグルコサミン。Hex、ヘキソース。各生化学反応は、番号付けされた特定酵素により触媒されている。
GAGは他のECM成分と同じように組織内で代謝回転する。細胞外のHyalと、リソソームの中におけるベータグルクロニダーゼとヘキソサミン酵素との協調的行動は、遊離型ヘキソサミンとGlcUAの産生に結びつく。ヘキソサミンは生合成経路で急速に再循環され、UDP-ヘキソサミンを、そしてやがては新しい多糖類を産生する(Fig. 2) 9。GlcUAの運命は、より代謝的重要性が高く、植物と一部の微生物においてのみ、明瞭なGlcUAの再循環が知られている。GlcUAからGlcUA -1- リン酸 (GlcUA-1P) への直接リン酸化およびGlcUA-1P からUDP-GlcUA への転換もこのような生物でのみ起こる10。脊椎動物の場合、GlcUAは一連の酸化還元反応と脱炭酸反応に入り、ペントースリン酸経路の中間体である、D-キシロース-5-リン酸に転換される(Fig. 2) 11。エネルギーバランスの面では、ペントース最終生成物は、UGDHによるUDP-Glcの初期酸化によって決まる。
事実、3-ケト-グルコン酸からD-キシロースへの脱炭酸は、完全に酸化したC-6生成物を同化作用の過程で排除する。HA代謝のこのエネルギー的側面から明確にわかるのは、細胞が細胞外ポリマーの生合成過程でエネルギーを獲得し、いかにしてペントース経路におけるウロン酸成分の再循環によって最終的なバランスが補正されるか、という高度な機構である。HAが脊椎動物において大量に代謝回転することを考えれば、ウロン酸を再循環させる経路が、L-キシルロース還元酵素欠乏症に起因する、重要なヒト代謝性疾患であるペントース尿症に関与していることは、驚くべきことではない。患者には、尿から大量のL-キシルロースが検出されるが、重い合併症がないという特徴がある。
興味あることに、GlcUAは、ビタミンC生合成の出発物質であり、これはモルモットとヒトを含む霊長類を除き、ほとんどの脊椎動物に存在する経路である。しかし、ビタミンC生合成のためのGlcUAは、UDP-GlcUAの細胞内分解に由来すると考えられ、GAGの代謝回転とビタミンCとを関連づけた論文はない12。対照的に、マウスやラットといった特定の脊椎動物(ヒトは除く)のためのビタミンと考えられているミオイノシトールは、ミオイノシトールオキシゲナーゼの触媒反応によってGlcUAに分解される。
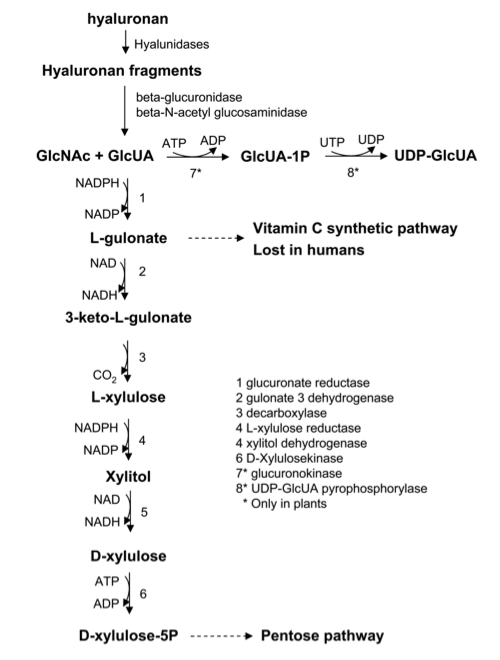
Fig. 2
HA分解の生化学経路。GlcUA-1P 、グルクロン酸-1-リン酸。各生化学反応は、番号付けされた特定酵素により触媒されている。反応7と8は植物といくつかの微生物にのみ存在することを留意されたい。
研究者は、自身の使用するモデルシステムの利点を主張するだろうが、さまざまなシステムを使用したことによる相補的な実験方法が胚発生の全過程の理解に大きな進歩をもたらしたことは認識せねばならない。
長きに渡り、その卵の大きさ、母胎の外で発達する胚の数の多さ、そして顕微鏡手術の後の並外れた胚の治癒能力といった特徴により発生学者にとって両生類は人気のモデルシステムであった。従来の両生類種の欠点は季節性繁殖動物ということであった。つまり、研究者たちは、実験する時期が限定される。Xenopus laevisアフリカツメガエルは、特筆すべき例外である。性腺刺激ホルモンを注射すれば産卵する特性は、1950年代には尿中の絨毛性ゴナドトロピンを検出して排卵を確認する、ヒト用妊娠検査薬の一般的な使用に結びついた。このことが、研究者が実験発生学にXenopus laevisの使用を検討する要因となった。
Xenopus胚が母胎の外で発達することは、マイクロインジェクションによる遺伝子活性の操作に非常に都合がよかった。通常、マイクロインジェクション研究は、対象となる遺伝子の機能を以下の3つの方法で調べる。野生型の過剰発現、遺伝子の変異配列もしくは機能欠失のいずれかの方法である。またカエル胚の極めて繁殖力の高い卵割パターンと、詳細な原基分布図研究が入手可能であることは、発生中の胚の限定された細胞系への注入を容易にする。
遺伝子機能欠失型の相補的なアプローチとして、Xenopus胚にアンチセンスオリゴヌクレオチドをマイクロインジェクトし、発現に遺伝子特異的阻害を与える方法がある。数々の修飾アンチセンスオリゴヌクレオチドが存在する一方で13、モルフォリノオリゴマー(MOs)は無毒で安定しており、効率が高い。それゆえにXenopus研究者に広く使われるようになった。MOsは、標的mRNAの翻訳あるいは標的mRNA前駆体のスプライシングのいずれかを妨害することで、標的遺伝子の発現レベルをノックダウンする。内因性ヌクレアーゼに対するMOsの抵抗は、注入された細胞とその後裔すべてにわたり、標的メッセージの効果的かつ持続的な抑制に結びつく。発生後期には、希釈が原因と考えられる活性の漸次的な低下が起こる14。Xenopus のライフサイクルとマイクロインジェクション技術に関してはFig.3参照。
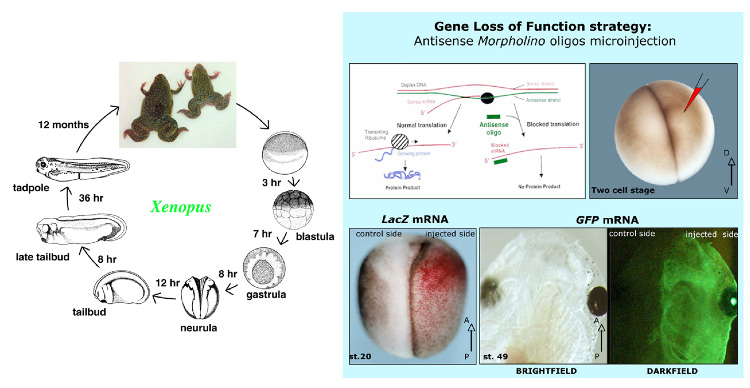
Fig. 3
左はXenopus laevisのライフサイクルである。右は、胚の一側に特定のモルフォリノオリゴマイクロインジェクションにより、対象遺伝子を特異的にブロックする、遺伝子機能欠失戦略である。注入された側の胚は、LacZ あるいはGFPといったレポーター遺伝子を同時注入することで視覚化されている。神
経段階の胚におけるベータガラクトシダーゼの発色反応は赤で表示され、また緑色蛍光は生きた幼虫の胚の注入された側を表示している。
グルクロン酸脱水素酵素(UGDH)は、ケラタン硫酸を除くすべてのGAG合成のための基質である、UDP-GlcUAを細胞に供給する。さらに、UDP-GlcUAは、グルクロン酸化が排出のため必要とする肝臓で使用される。UDP-GlcUAはまた、植物における細胞壁多糖類の主要な構成要素を提供するUDP-キシロースの前駆体となり、ほとんどのPGのコアタンパク質におけるGAG合成にとっての最初の糖を提供する。UDP-GlcUAの中心的な役割を考えれば、UGDH発現の変化が、胚を発達させる上で、明白な表現型を引き起こすことは驚くべきことではない。UGDHは、Drosophila melanogasterではsugarless遺伝子によって符号化され、翅形成を制御するPGにおけるヘパラン硫酸合成に必須である15。Caenorhabditis elegansでは、UGDHは、胚発達と陰門形成に必要不可欠なGAG合成に影響を及ぼす16, 17。ゼブラフィッシュでは、酵素が正常な心臓発生に重要であることがわかった18。マウスでは、UGDH変異体は、中胚葉と内胚葉の細胞遊走に欠陥を引き起こすことで、原腸形成の過程で成長を停止する19。Xenopusでは、UGDHは尾芽期をピークに、発生の全行程で発現する5。
正常な発育には、HAおよびPGのGAGが必要不可欠であることから、UGDHの高発現は特に驚くべきことではない。興味深いことに、UGDH発現のピークは、胚発生時におけるHA合成のピークと相関する(Fig. 4B, 受精後32時間 (hours post fertilization: HPF))。
UDGHは、HASs基質を提供するという、HA代謝に中心的な役割を果たす。加えて、UDP-糖の濃度、中でもUDG-GlcUAとUDP-GlcNAcのそれはHA合成を調節する上で重要な役割を担う5。対照的に、その他のGAG合成は、UDP-GlcUAプールの変化には左右されないため、UDP-糖対向輸送体のメカニズムは、他のGAGが合成されるゴルジ区画内のUDP-糖の定濃度を維持することができる。
Xenopus発生におけるUGDHの役割は、モルフォリノオリゴ注入による機能欠失実験で明らかになった。UGDHに対して、MOを注入された胚は、原腸形成の最後に著しく奇形して原口閉鎖に失敗し、最終的には尾芽期を前に死亡した。原腸形成時には、Xenopus laevisとマウス両方の胚において中胚葉細胞がHAに富んだ細胞外マトリックス環境で移動する20, 21。UGDHサイレンシングによって阻害された、このHAに富んだECM合成は、3つの胚の胚葉:外胚葉、中胚葉そして内胚葉から構成される、正常な原腸胚形成に決定的な細胞運動に異常を及ぼす。
HAは、産み落とされた卵とその被膜(例:卵黄包とゼリー層)には存在しない。これは卵にXHAS1, 2, および 3の転写物が不在であるのと一致している。発生初期における原腸形成、神経胚発生そして器官形成の後期に対応する段階で、HAのレベルは増大する(Fig. 4)。XHAS1 転写体の増加に続けて起こるXHAS2 および 3 の増加は、受精後32時間に最大値に達するHAのピークと(Fig. 4B)、そしてX. laevis胚抽出物から検出されるHA合成の増大とよく相関している22。この後に続く急激な低下は、XEH1 ヒアルロニダーゼの出現とHYAL2の増加に相関する。
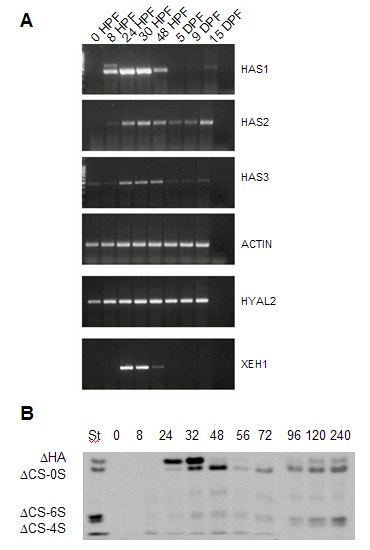
Fig. 4
A. アフリカツメガエル発生期におけるRT-PCRによるHA代謝酵素の発現。
B. アフリカツメガエル早期発生期におけるPAGEFS によるHAの定量化。
これらの画像はVigetti et al. (2003) に含まれ、Elsevier社の許可を得て複製したものである。
HAの時空的分布を見ると、まず卵割腔と原腸、その後は肝臓腔、脳室そして発育中の心臓に存在することがわかった。胞胚期には、HAは中胚葉始原外および中胚葉始原の細胞外マトリックスから検出されるが、原腸形成の過程になると、退縮帯域と赤道中胚葉原基の深層に見られる。原腸形成後、HAは細胞外マトリックス内で蓄積し、胚盤葉層の境界を画定し、その後は間充組織、心臓、前脊軟骨そして肺始原といった、中胚葉由来器官に蓄積する21。
脊椎動物のHA生合成は、細胞膜に存在する3つの触媒酵素であるHas1、Has2そして Has3によって行われている。HAS1遺伝子は、他のXenopus 発生の原腸形成時に特異的に発現する (Differentially expressed in developing Xenopus at Gastrulation)遺伝子と共に 1983年に分離され、頭文字をとってDG42と名づけられた。DG42は、最初に発見された真核性HA合成酵素を表すが、その生化学的活性は、HAとキチン合成酵素の間でしばらく意見が分かれた24。この3つの合成酵素は、マウス発生の過程で、異なった時間的パターンで発現する25。中でも、Has2は初期器官形成時における、HAの主要な供給源と同定された。ホモ接合性欠質のHas2遺伝子を持ったマウスは、死に至る重度の心臓および血管の異常を妊娠中期に呈する(E9.5-10)ことから、Has2が哺乳類胚発生の過程において極めて重要な役割を担っていることが伺える26。Has2遺伝子機能の詳細な分析には、齧歯動物の遺伝子組換え法には技術的な限界があり、より手に入れやすい魚やカエルなどの胚を使っての類似研究へと至った。ゼブラフィッシュにおけるHas2遺伝子の下方制御は、原腸形成の過程で重要な中胚葉細胞の移動と適正な心臓形成を混乱させる27, 28。
in vivoニワトリ肢芽の中胚葉におけるHas2の過剰発現は、骨格要素が1個以上欠ける手足の退縮もしくは重度の奇形を起こす。Has2が過剰発現しながらも、四肢形成に至る骨格要素も、最終的には四肢が短くなるなどの異常形態を示し、正しく配置されないことも実証された。四肢間葉細胞の微小細胞塊培養時における持続的なHA生成は、軟骨凝縮とそれに続く軟骨形成を阻害する。つまり、HAの下方制御が、軟骨分化を引き起こす前軟骨凝縮の形成に確かに必要不可欠であることを示唆した。これらの結果を総合すると四肢の形態形成のさまざまな面にHAが関与している可能性が出てくる29。
我々と他の研究者たちは最近Xenopus laevisの3つのHas遺伝子をクローン化し、成長の初期段階における時空的分布を確立した20, 30, 31。XHas1、XHas2およびXHas3 mRNAは、ゼブラフィッシュで観察されたものとは著しく異なる、明確かつ非重複的な空間点発現パターンを示し(Fig. 5)、Has 遺伝子発現の制御は、四足類と硬骨類との間に進化的分岐があることを示唆した。Xenopus の場合、XHas1とXHas2 の発現が、最初に検出されるのは中期胞胚の動物極である。初期原腸期を皮切りに、XHas1 mRNAは外胚葉全体に局在化する一方、XHas2は退縮中胚葉に発現する。XHas1は早期神経胚の神経管に存在しないにもかかわらず、遊走前頭部神経是細胞のシグナルが現れる。神経胚期では、XHas2は前体節中胚葉内で発現し、尾芽期になると、分葉沿軸中胚葉におけるXHas2の発現がはっきりしてくる。同じ尾芽期に、体幹部神経堤細胞と心臓原基からXHas2 mRNAが検出されるようになる。一方、XHas1の発現は胚全域の背腹配列が起こった後に外胚葉で下方制御される。頭部では、XHas2 mRNAが頭部間充組織と下垂体原基を持った前部に存在する。XHas2はまた眼の水晶体とさい弓に出現する。
XHas2 発現は、前後軸に沿って、沿軸中胚葉の分葉の筋原波に続けて起きる。このXHas2 発現は、実は、分化した前筋節で低下し、後体節と沿軸中胚葉にのみ残存する。XHas1および2は胚に広範に発現するのに対し、XHas3転写体は、内耳とセメント腺を含む、胚の特定区域に限定されている。結果として、この遺伝子発現比較分析からは、発育過程でのヒアルロン酸の様々な役割は、時空的に制御された、3つの異なる合成酵素の転写体によって調節されていると推測できる。
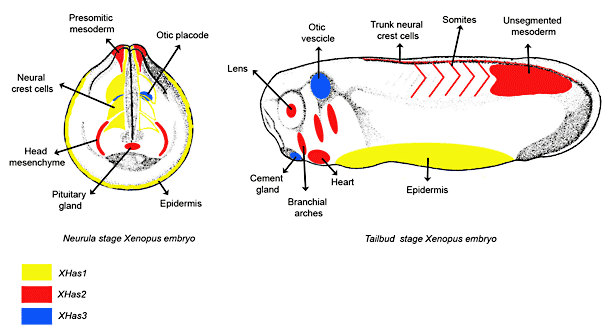
Fig. 5
Xenopus胚発生に伴う3つのHA合成酵素の遺伝子発現パターン。
Has2ノックアウトマウスの胚の早期死により、胚発生時のHAの役割に、一部の謎を残す。この問題に取り組むために、我々は機能欠失型研究を続けた。この方法により、初期発生過程におけるXHas2の役割を明らかにできる32。2細胞分裂期にXHas2モルフォリノを一片側に注射されたXenopus 尾芽胚は、その側腹部の筋肉組織を正しい位置に配置することはできなかった。胚は通常よりも小さい体節で、筋節の分節上組織は破綻した。こうした観察から、XHas2の機能欠失が、体節間および体節内の細胞外マトリックスの構造的完全性に影響を及ぼしている可能性があり、それはやがて筋芽細胞間の正しい細胞間接触の確立を妨害することも考えられる。
XHas2が前体節細胞に発現するので、我々はHas2活性の欠失が、筋細胞分化プログラムの初期段階を実際に妨害するのかどうかを調べた。神経胚期では、アポトーシス性細胞が前体節中胚葉において著しく増加したのを確認したが、筋芽細胞の増殖と早発筋マーカーの発現には影響が見られなかった。これらのデータが強く示唆するのは、XHas2活性は、初期の筋細胞へのコミットメントあるいは筋芽細胞の増殖には不要であるが、初期筋前駆体の生存と分化には必須なのではないかということである。確かに、XHas2がこうした細胞をアポトーシスから守るのは、特定の発生期間に限られていると思われる。それは、前体節中胚葉内の筋細胞分化の初期段階と同時期である。HA存在下での中胚葉ECMの適切な組み立ては、集団化効果の維持、モルフォゲンの正常な拡散/勾配の形成、もしくは発育中の筋芽細胞の分化と生存に関与する、その他の誘導シグナル伝達の円滑な働きに重要であると考えられる。
HAが前体節中胚葉細胞の生存と分化に及ぼす影響は、ECMの構造的支持効果を通じて発揮されると考えられる。さらに興味をかきたてる可能性としては、筋芽細胞の生成したHAは、CD44あるいはRHAMMといった特定の受容体を介して細胞内シグナル伝達を活性化させていることである。この点に関してさらなる調査をするため、XCD44の機能的ノックダウンを実施した。Xenopusにおいてこの受容体は、発育中の筋肉組織に発現するものの、欠失しても体幹筋肉の形成に重大な変化はなかった。その一方で、XHas2 とXCD44のどちらも、軸下の筋芽細胞遊走に関与しており、これはXenopusにとって正常な腹側体壁筋肉組織の形成に必要不可欠である。この前駆細胞群におけるXHas2 とXCD44の発現から、以下の2点が推測できる。軸下細胞が遊走過程でHAと連携できなかったことが、遊走障害の原因の一つである。そしてXCD44の機能が細胞の移動運動に不可欠であることである。
ゼブラフィッシュでは、Has2が一連のRac1シグナル伝達を活性化する上で必要であることがわかった。Rac1シグナル伝達の活性は、原腸形成の過程で背側の細胞遊走、そして体節を形成する上での背側細胞の遊走に影響力を持つ。このことからHAには細胞の遊走を誘発する指示的な役割を持っているという仮説が可能となる27。さらにわれわれは、少なくとも軸下筋細胞では、XCD44の活性化を介してHAが上述の働きをするのではないかと考える32。
XHas2-欠失胚で観察されるもう1つの興味深い表現型は、体幹部NCC(神経堤細胞)の遊走の変化で、提唱されたNCC発生の過程におけるHAの中心的役割を裏付けとなる33。注目すべきは、Xenopusの遊走する体幹部NCCはXCD44を発現せず、体節細胞から受容体を除いてもNCCの動きに影響はない点である。
細胞外環境にHAが存在することが、NCCの正常な遊走に重要であると考えられるが、XHas2-欠失胚で見られた体幹部NCCの運動障害が、これら細胞のHAの合成および分泌されないためのものなのか、NCC遊走経路のECMによって受けた構造的欠損により生じたのかははっきりしない。もう一つの可能性として、NCC遊走の変化は、細胞が移動に利用する体節が正常の構造を持たないことから形態形成が欠落したことが挙げられる。解明にはさらなる研究が必要だが、こうした予備的結果から、体節の正確な構造とECMがHAに富んでいるという2点が、NCC遊走を可能にする特有の環境条件を作るうえで必須であると考えられる32。
我々は現在、発生期におけるHA活性の第二の分子機序の可能性を探っている。そのために、RHAMMなどの代替受容体やプロテオグライカンバーシカンなどのヒアルロン酸結合パートナーと、HAとの機能的相補作用の可能性の研究をしている34。
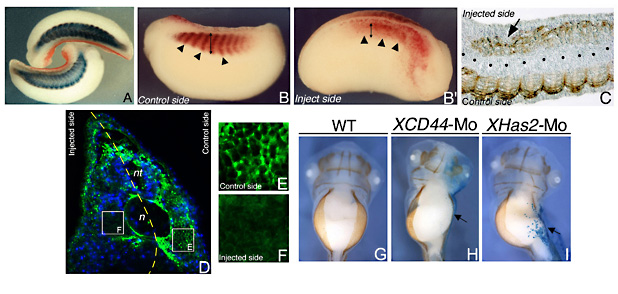
Fig. 6
XHas2-Mo を注入した尾芽胚における筋節の変化。(A) 赤-gal染色で視覚化されているように、胚は注入側に屈曲する。体節は青で示される心臓アクチンmRNAの発現によって可視化された。(B, B’, C) 12/101筋特異抗体免疫活性(茶)。(B) 胎齢26段階の胚のコントロール側、側面図(矢印は体節を指す)。 (B’) 体節分節化の完全な崩壊をみせる(B)の胚の注入側(矢頭)、そして12/101 陽性細胞の大幅な減少(B とB’の矢印を比較)。(C) 長軸方向に切断された、XHas2-Mo を注入された尾芽胚。注入側にある体節内の12/101陽性筋細胞のパターン変化に注目(矢印)。(D) 体幹部におけるXHas2-Mo を注入された胚の冠状断面は、ニューロカン-GFP融合タンパク質により緑に、そして核は青に染色されている。
(E) コントロール側を拡大すると筋細胞の細胞外空間におけるECMの豊富なHAを見ることができる。(F) XHas2-Mo注入側の強拡大。筋細胞を取り囲むECMにHA検出されない。
(G, H, I) 腹側から見た12/101抗体により免疫染色された胎齢43段階の胚。野生型における腹側体壁筋肉組織の最終的な位置がみられる(G)、XCD44-Mo注入胚(H)そしてXHas2-Mo注入胚(I)。注入された側は矢印で示したようにX-gal染色で青く表示されている。 n、脊索、nt、 神経管。
これらの図は参考文献32に掲載され、Company of Biologistsからの転載許可を受けている。
細胞外マトリックスに内在する細胞は、胚発生期と同様に、再生および病理の過程で動的に調節される形態形成のユニットである。われわれは糖質科学の研究に使用される多くのモデルシステムの中にあって、in vivoモデルシステムとしてのXenopus laevisは、細胞外マトリックス分子の増殖、遊走そして分化といった細胞のダイナミックな挙動に果たす役割の謎を解くのに有用であると考える。この研究に用いた遺伝子機能欠失法は、UGDH活性が発生の初期段階に不可欠であること、そして筋形成においてHAが早期筋芽細胞のアポトーシスを阻止することを証明した。そればかりか、CD44が軸下筋細胞の遊走に関与していることも示した。発生機構と遺伝子機能が進化的に保存されてきたことは、”カエル”での新しい発見を高等脊椎動物にあてはめての推定が容易となり、つまりは、細胞生物学のさまざまな疑問解決に貢献することとなる。
謝辞
この研究は、イタリア大学・研究省(MIUR)とFARの支援により実施された。本原稿に意見を寄せてくれたUniversity of InsubriaのGiancarlo De Luca、Manuela Viola、 Evgenia KarousouそしてUniversity of PisaのIrma NardiとPaola Casiniに謝意を表する。また、University of ParmaのRoberto Perrisには特に感謝する。