Jan. 9, 2009
C型肝炎ウイルスの感染と糖鎖修飾(2009 Vol.13, A2)
谷 英樹 / 松浦 善治
氏名:谷 英樹
1996年東京理科大学基礎工学部生物工学科卒業、2001年東京大学大学院医学系研究科国際保健学専攻修了(牛島廣治教授)。この間、国立感染症研究所ウイルス第二部(宮村達男部長、松浦善治室長)にも所属。保健学博士。2001年より大阪大学微生物病研究所(松浦善治教授)にてHCVの細胞侵入機構の解析に関する仕事に携わる。2002-04年米国テネシー大学メンフィス校(Michael A. Whitt教授)に留学、2005-08年日本学術振興会特別研究員。2008年-大阪大学微生物病研究所特任助教。
氏名:松浦 善治
1955年生まれ。大阪大学微生物病研究所分子ウイルス分野教授。宮崎大学農学部獣医学科卒、北海道大学獣医学部大学院修士課程修了。獣医学博士。国立予防衛生研究所研究員、オックスフォード大学ウイルス学研究所研究員、国立感染症研究所室長などを経て現職。
1. はじめに
C型肝炎ウイルス(HCV)は輸血後肝炎の主要な原因ウイルスで、感染すると高率に慢性化し、肝炎、肝硬変、肝癌へと進行する。インターフェロンとリバビリンの併用療法によって治療効果は飛躍的に向上したものの、すでに世界で約2億人、本邦だけでも200万人ものHCV感染者が存在する。
また、HCVには1型から6型までの遺伝子型が存在し、さらに種類によって1型の中でも1a、1b、1cといったタイプに分類されている。特に 本邦ではインターフェロン療法が効きにくい1b型が多いことも治療を困難している要因である。近年、特殊なクローンでHCVの感染や複製をin vitroで評価出来る系が開発されている 41が、臨床材料から病原性を保持したHCVを分離培養する方法は未だ確立されていない。さらに、感染モデル動物としては、チンパンジーとヒト肝細胞を移植した免疫不全マウスに限定されており、HCVの感染・増殖や病原性発現の分子機構の解析は難航している。
これまでに、HCVに近縁なフラビウイルスの感染様式や、HCVの代替ツール(この代替ツールについては2.に詳細記述)を用いた解析によって、HCVの細胞への侵入様式は図3のように推測されている。HCVは2つのエンベロープ蛋白質(E1およびE2)を持ち、はじめに細胞表面の硫酸多糖類に捕捉されて濃縮される。その後、エンベロープ蛋白質を介して親和性の高い蛋白性のレセプターに結合し、エンドサイトーシスによってエンドゾームに取り込まれる。エンドゾーム内の低pH環境下でエンベロープ蛋白質の構造が変化することにより、ウイルス膜とエンドゾーム膜が融合し、ウイルスRNAが細胞内へ放出される。HCVゲノムはプラス鎖のRNAであり、そのままmRNAとして機能して、一本の巨大な前駆体蛋白質が翻訳され、細胞由来のプロテアーゼによって粒子を形成するコア蛋白質とエンベロープ蛋白質が、また、ウイルスがコードするプロテアーゼによってウイルスゲノムの複製に必須な非構造蛋白質が生成される。エンベロープ蛋白質は小胞体の膜上に留まり、そこでヌクレオキャプシドと会合して粒子を形成し、成熟したウイルス粒子は小胞体の内腔へ出芽して、ゴルジ装置を経由して細胞外へ放出される。
HCVとレセプターとの結合には、E2蛋白質が重要な役割を演じており、これまでに硫酸多糖類であるヘパリンやヘパラン硫酸、テトラスパニンファミリーのヒトCD81(hCD81)、リポ蛋白受容体であるヒトスカベンジャー受容体クラスB-I型(hSR-BI)、タイトジャンクション分子のClaudin-1などいくつかのレセプター候補分子が報告されている。本稿ではHCVの感染におけるエンベロープ蛋白質の糖鎖修飾の役割と各種受容体の関与を中心に概説する。
2. HCVのエンベロープ蛋白質の糖鎖構造
HCVの前駆体蛋白質のN末側に存在する粒子形成に必須な構造蛋白質であるCore, E1, およびE2蛋白質は宿主のシグナルペプチダーゼによってポリプロテインから切断される。強力な残留シグナルを持つE1およびE2蛋白質は小胞体内に留まり、そこで何らかの修飾を受けてヘテロダイマーを形成し、エンベロープ蛋白質として成熟する。E1蛋白質とE2蛋白質には、それぞれ6箇所と11箇所のHCV株間でよく保存されたN型糖鎖修飾部位が存在する。エンベロープ蛋白質の小胞体内腔での糖鎖修飾やフォールディングなどの翻訳後修飾が、感染性粒子の産生に重要であると考えられている 15。フラビウイルスのエンベロープ蛋白質の構造やアミノ酸配列などから、HCVのE2蛋白質はレセプターとのに結合に必須な蛋白質であると考えられており、E2蛋白質に結合するレセプター候補分子として、これまでにhCD81やhSR-BIなどが同定されている。一方、E1蛋白質の細胞外領域には膜融合活性配列が存在することから、膜融合蛋白としての活性が示唆されているが、E2蛋白質との相互作用も含めて詳細は未だ明らかにされていない 39。
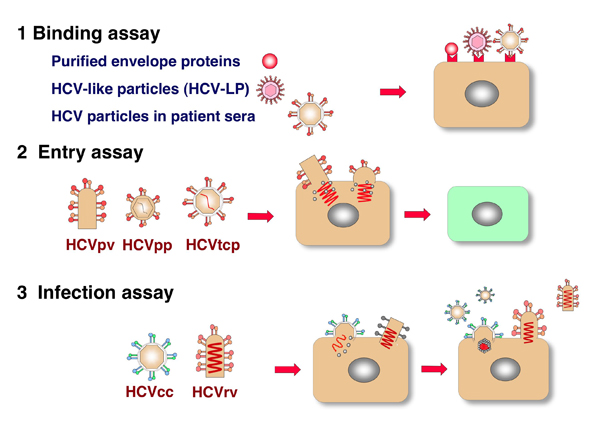
図 1 HCVの感染評価系
3. HCVの感染評価系(図1)
ウイルスの細胞への侵入機構の解析は、ウイルスの生活環を理解する上で重要であるばかりでなく、ウイルスの宿主細胞への侵入を阻止できる抗ウイルス薬の開発にも重要である。ウイルスの感染機構の解析には、感染性と病原性を併せ持った“本物の”ウイルスと、そのウイルスに高い感受性を示す培養細胞が必須であるが、HCVの場合、特殊な遺伝子型のクローンを除いて効率よくウイルスを増殖できる培養細胞系は存在しない。患者血清中のHCV粒子を用いてある程度の解析は可能であるが、ウイルス量も低く、血清中には中和抗体や感染に影響を及ぼす様々な因子が存在している。そこで、これまで以下のような代替法を用いて研究が進められてきた。
a. 可溶性E2蛋白質
HCV粒子はウイルスエンベロープであるE2蛋白質を介して細胞膜レセプターに結合すると考えられている。そこで、E2蛋白質の膜結合領域を取り除き、細胞外領域のみを発現させ、精製した可溶性E2蛋白質に結合活性を示す宿主因子の検索が行われ、hCD81 30やhSR-BI 35などのレセプター候補蛋白が単離された。しかしながら、この方法ではE2蛋白質に結合できる分子は単離できるものの、実際にウイルスが細胞内に侵入するのに必須な分子であるかどうかを見極めることはできない。また、可溶性E2蛋白質では、実際に感染性粒子上に存在している立体構造を保持したエンベロープ蛋白質と相互作用できる受容体を同定することも難しい。
b. HCV様粒子(HCV-like particles;HCV-LP)
ウイルス粒子を構成している蛋白質を大量に細胞内に発現させると、ウイルス様粒子が形成されることが多くのウイルスで報告されている。HCVでも様々な発現系を用いてHCV-LPの作製が試みられており、中でも昆虫ウイルスであるバキュロウイルス発現系で効率よくHCV-LPを産生できる 6。このHCV-LPを用いて、種々の細胞やレセプターとの結合作用の解析が行われてきた。しかしながら、ゲノムを含まない中空粒子であるため、侵入機構の解析には適していない。また、昆虫細胞で作製される場合、哺乳動物細胞との糖鎖修飾の相違が考えられ、本来のHCV粒子の結合作用が反映されているとは限らない。最近、バキュロウイルスベクターをヒト肝臓細胞にHCV構造蛋白質を強発現させることで、量的な問題はあるもののHCV-LPを作製することが可能となっている 22。
c. シュードタイプウイルス (HCVpv, HCVpp)
シュードとは“偽の”という意味であり、自分のエンベロープ蛋白質の代わりに、外来のエンベロープ蛋白質を被ったウイルスのことをシュードタイプウイルスという。水疱性口内炎ウイルス(VSV) 23,38 やレトロウイルス4が、外来のエンベロープ蛋白質を粒子表面に被れる性質を利用して、HCVのウイルスエンベロープ蛋白をプラズミドで細胞に導入しておくことで、HCVのエンベロープ蛋白質を被ったシュードタイプVSV(HCVpv)とシュードタイプレトロウイルス(HCVpp)の作製がそれぞれ可能となり、感染機構の解析に用いられている。HCVのエンベロープ蛋白質は上述の如く小胞体に残留する性質があるため、これらのシュードタイプウイルスが、どのようなプロセスで細胞表面から出芽するのかは、未だ明らかにされていない。可溶性E2蛋白質とHCV-LPがレセプターとの結合までしか解析できないのに対し、シュードタイプウイルスはウイルス膜と細胞膜との融合とゲノムの侵入までの過程を、ルシフェラーゼやGreen Fluorescent Protein等のレポーター遺伝子の発現を指標にして、定量的に評価できる点で優れている(図2)。
d. 組換えVSV (HCVrv)
VSVはリバースジェネティクスの技術によりプラスミドDNAから感染性ウイルスを再構築することが可能で、さらにVSVのエンベロープ遺伝子を外来遺伝子と入れ換えた組換えウイルスは、外来蛋白質に依存した感染を再現できる(図2)。我々はこれまでのシュードタイプウイルスより高い感染価で、しかも自立増殖可能なHCVのエンベロープ遺伝子を組み込んだHCVrvの作製に成功している 38。HCVrvはVSVの複製機構を利用するため、HCVの複製効率の低さを考慮せずに、様々な遺伝子型のHCVの侵入と、ある程度の出芽のステップを解析できると考えられる。また、組換えウイルスはプラスミドを導入して一過性に作製するシュードタイプウイルスと異なり、遺伝子の導入効率に左右されることなく、様々な細胞での組換えウイルスを作製できる長所がある。今後、後述の細胞培養HCVと共にHCVの感染機能の解析に有用なツールになるものと思われる。
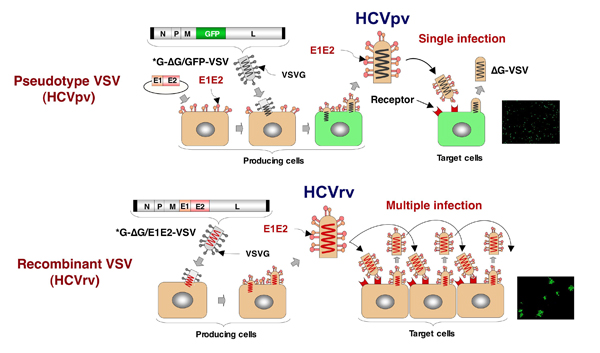
図 2 HCVpvとHCVrv
1) シュードタイプVSV(HCVpv)の作製には、まずHCVのエンベロープを発現できるプラスミドを細胞へ導入し、さらに、エンベロープ遺伝子を欠損させたVSVを導入して一過的にHCVエンベロープ蛋白を被ったウイルスを作製する。HCVpvはレセプターを発現している標的細胞に感染するが、この細胞から出芽するウイルスはエンベロープのない裸のウイルスで、感染性を示さない。この系はプラスミドの導入効率の高い細胞に限定される。
2)組換えVSV(HCVrv)はウイルスゲノムに直接HCVのエンベロープ遺伝子を挿入しており、一過的にVSVG蛋白を被った親ウイルスを用いて産生細胞に導入して作製する。HCVrvは標的細胞で自立増殖が期待できる。
e. 細胞培養で増殖可能なHCV (HCVcc)
劇症肝炎症例の急性期血清から分離された遺伝子型2aのHCV (JFH-1株) が、HCVのゲノムを自立複製しているヒト肝臓細胞(HCVレプリコン)からインターフェロンでウイルスRNAを排除して樹立した細胞(Huh7.5細胞)で、効率良く感染増殖できることが報告された 41。また、遺伝子型2aのJ6株の構造タンパク領域とJFH-1株の非構造蛋白質領域のキメラウイルスが、より効率よく複製することが確認された(cell cultured HCV; HCVcc) 21。HCVccの開発により、蛋白質レベルでウイルスの増殖が観察でき、ウイルスの感染から放出までの一連の過程を培養細胞内で解析することが可能となった。また、ゲノムcDNAにリポーター遺伝子を導入することでウイルス増殖を定量的に評価することもできる。しかしながら、現時点ではHCVccはJFH-1株由来のウイルスしか得られておらず、欧米や日本で最も問題となっている遺伝子型1型のクローンのHCVccの複製効率は極めて低い 19,43。また、JFH-1株をチンパンジーに接種すると、一過性のウイルス血症を示すものの、なんら病原性を示さないことから、JFH-1株は劇症肝炎患者から分離されたクローンではあるが、病原性を欠いた実験室株と考えるのが妥当である。病原性を保持したHCVccの樹立が今後の課題である。
f. トランス供給型HCV粒子 (Trans-complemented HCV particles、HCVtcp)
HCVに近縁なKunjin virusでウイルスゲノムが自立複製しているレプリコン細胞にKunjin virusの構造蛋白質をSemliki Forest virusのレプリコンRNAを用いてトランスに発現させると、一度だけ感染可能なウイルス粒子が作製できることが報告されている 20。この様に、非構造蛋白質領域のサブゲノムが自立複製しているレプリコン細胞に、ウイルスの構造蛋白質をトランスに発現させて、一過性に取れてくるウイルス粒子をトランス供給型粒子もしくはトランスパッケージング粒子という。HCVでも同様の手法で、レプリコン細胞に構造蛋白質をトランスに発現させて、一過性の感染性粒子の作製が報告された18,36。このウイルスはシュードタイプウイルスと同様に一度しか感染できないが、複製ユニットも全てHCV由来のものであるため、より天然のHCVに近い形態や性状を示すと思われる。ただ、感染性粒子の作製はクローンの種類も含めて多くの制限があり、また、感染価も低いためにより高い感染性を示す感染性粒子の作製が望まれる。
4. HCVエンベロープ蛋白質の糖鎖修飾と感染性
E1とE2蛋白質はその強固な小胞体残留シグナルによって小胞体から移動しないと考えられており、発現蛋白質の解析ではハイマンノース型の糖鎖修飾を受けている 8,11。HCV-LPやシュードタイプウイルスに含まれるエンベロープ蛋白質も、やはりハイマンノース型の糖鎖修飾を受けている。しかしながら、E1とE2蛋白質を過剰に発現させると、一部が細胞表面まで移行することが観察されており、細胞表面から出芽するレトロウイルスやVSVのシュードタイプウイルスは、これらの蛋白質を被って出芽する可能性もある 4,9,17。一方、HCVエンベロープ蛋白質は後期エンドゾーム、特にmultivesicular bodies (MVBs) に強く発現しており、HCVppはここで出芽するとの報告もある 33。HCVppの解析では、E1蛋白質はハイマンノース型に、E2蛋白質は複合型もしくは混合型(ハイブリッド型)の糖鎖修飾を受けていた 13,29。さらに、HCVppではE2蛋白質の8番目と10番目の糖鎖がE1とE2蛋白質のヘテロダイマーの形成に重要であることから、エンベロープ蛋白質の糖鎖修飾はHCV粒子の形成に重要であると考えられている 14。患者血清中から単離してきたHCV粒子は、レクチンとの結合様式から複合型の糖鎖修飾を受けているという報告もあるが 34、感染性を保持したHCV粒子のE1とE2蛋白質の糖鎖修飾に関しては、HCVccを含めて不明な点が多い。以上のように、エンベロープ蛋白質の糖鎖構造によりHCVの粒子形成過程が異なる現象が認められているが、糖鎖がHCVの粒子形成過程にどのように作用しているかについては、まだ明らかにされていない。
5. レセプター分子と糖鎖(図3)
a. グリコサミノグリカン(GAG)
グリコサミノグリカンを糖鎖として有する糖蛋白であるプロテオグリカンは、細胞外マトリックスの他に細胞表面にも広く分布している。細胞表面に存在するヘパラン硫酸プロテオグリカンとしては膜貫通型のコアタンパク質を持つシンデカンとGPI(glycosylphosphatidylinositol)アンカー型のグリピカンが良く知られている。プロテオグリカンの糖鎖は負の電荷を持つことから、微生物は感染初期段階で、これらの糖鎖を利用して細胞に吸着しているものと考えられている。特に、ヘパリンやヘパラン硫酸はHCVに近縁なデングウイルス 7,16や日本脳炎ウイルス 37が宿主細胞へ吸着する際に利用することが報告されている。ヘパリンやヘパラン硫酸、あるいはその分解酵素であるヘパリナーゼやヘパリチナーゼで細胞を処理すると、可溶性E2蛋白質、HCV-LPおよびシュードタイプウイルスの結合や感染阻害が認められることから、これらの因子がHCVの感染に関与しているものと考えられている 2。最近E2蛋白質だけでなくE1蛋白質もヘパラン硫酸と結合することが報告され、これらの結合にはヘパラン硫酸のアミノ基側に硫酸基を含み10から14の糖鎖が必要であることが報告された 3。また、HCVccでも同様な成績が報告されている 27。
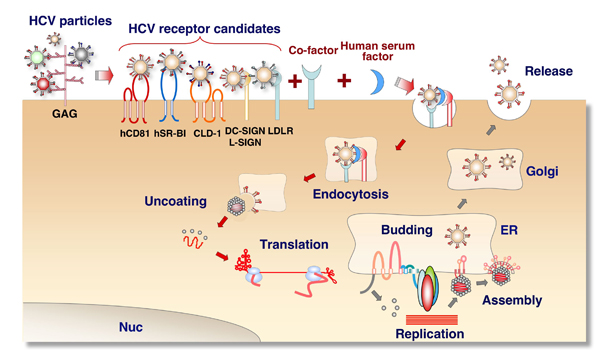
図 3 HCVの生活環
b. human CD81 (hCD81)
hCD81は1998年にHCV受容体候補としてはじめて報告された、4回膜貫通型のテトラスパニンファミリーに属する分子である 30。hCD81は上皮系や血球系の細胞に広く分布しており、第2細胞外領域でE2蛋白質と結合する。HCVpp, HCVpv, HCVrvおよびHCVccの標的細胞への感染は、抗hCD81抗体やhCD81の発現抑制により阻害される。hCD81を発現していないヒト肝癌細胞株のHepG2細胞にhCD81を発現させると、シュードタイプウイルスは感染性を示すようになるが、NIH3T3やCHO細胞にhCD81を発現させても感染は成立しない。hCD81は単独で酵素活性やシグナル活性はなく、通常は補助因子として作用しており、HCVの感染においても肝細胞特異的な他の補助レセプターの発現が必要であると考えられている。
c. 高比重リポ蛋白質(HDL)受容体、Scavenger Receptor Class B type I (hSR-BI)
hCD81を発現していないHepG2細胞に、精製E2蛋白質やHCV-LPが結合することから、HepG2細胞に存在するE2蛋白質結合分子としてhSR-BIが同定された 2。hCD81と同様に、Huh7細胞の抗hSR-BI抗体での処理や、hSR-BIの発現を抑制することにより、HCVppの感染が阻害されるが、CHO細胞にhCD81とhSR-BIを発現させてもHCVppは感染できないことから 9、他の補助因子の関与が示唆されている。
d. Claudin-1
Claudin-1はHCVppの感染を指標に新たなHCVレセプター候補分子として分離された 12。Claudin-1はもともと細胞間接着のタイトジャンクションに深く関与している4回膜貫通型の蛋白質である。HCVppおよびHCVccの感染は抗Claudin-1抗体やClaudin-1の発現抑制によって阻害され、またClaudin-1をほとんど発現していない293T細胞にClaudin-1を発現させると、HCVppやHCVpvの感染効率が飛躍的に向上する。また、E2蛋白質がhCD81に結合した後の後期のステップで作用していると考えられている 12。しかしながら、今のところClaudin-1とHCVのエンベロープ蛋白質との直接的な結合は見られていない。また、hCD81と同様に臓器特異性はなく普遍的に発現しており、マウスのClaudin-1でも感染は成立するため宿主特異性も認められていない。さらに、hCD81, hSR-BIおよびClaudin-1を全て発現しているものの、シュードタイプウイルスが感染できない細胞株もあり、さらなる分子の関与が示唆されている 10。最近、他のClaudinファミリー分子であるClaudin-6とClaudin-9もHCVの感染に関与する報告がなされている 24,44。
e. Dendritic cell-specific intracellular adhesion molecule 3-grabbing nonintegrin (DC-SIGN), Liver/lymph node-SIGN (L-SIGN)
DC-SIGNはC型レクチンとして知られ、樹状細胞に発現しており、多くのウイルスや細菌が受容体として利用している。HCVppもDC-SIGNおよびDC-SIGNRに結合し、マンノースによって結合が抑制されることから、糖鎖を介して結合しているものと考えられている 31。しかしながら細胞内への侵入は観察されていないことからDC-SIGNは細胞表面上の結合分子として補助的に働いているものと思われる。
f. Low-density lipoprotein受容体 (LDLR)
血清中のHCV粒子は多くのリポ蛋白質と結合し、この複合体はLDLRとも結合していることが報告されている 1,26,28。しかしながら、E2蛋白質との結合はみられず 42、しかも、LDLによるHCVppの感染阻害実験では相反する結果が得られている 4。最近、通常のLDLではHCVppやHCVccの感染は阻害されないが、酸化LDLでは感染を阻害できることが報告された 40。HCVppの感染を増強する因子としてはヒト血清成分中のapolipoproteinC1 25やHDL 5が報告されており、これらの因子と受容体との関連も今後詳細な検討が必要と思われる。
g. EWI-2wint
hCD81のパートナー分子であるEWI-2の切断産物、EWI-2wint(EWI-2 without its N-terminus)がE2蛋白質とhCD81の相互作用を阻止することにより、HCV感染を阻害することが報告された 32。この分子は多くの細胞で発現が認められるが、肝細胞には発現していないことから、HCVの細胞指向性がEWI-2wintの発現の有無で説明できる可能性が示唆されているが、詳細は不明である。
6. おわりに
HCVの感染機構は非常に複雑で不明な点が多いものの、各種アッセイ系を用いてその一端を解析できるようになってきた。特に、HCVのシュードタイプウイルスや組換えウイルスの構築により、HCVの侵入機構の解析は大きく進展した。また、HCVccはHCVの感染から出芽までの感染環を検証できる唯一の系であり、特にウイルス粒子のアセンブリーの解析に貢献している。今後、臨床現場で問題となっている、遺伝子型1aおよび1bのHCVccの樹立が期待される。現在、HCVのプロテアーゼやポリメラーゼを標的とした抗ウイルス剤が開発され、臨床試験が進行中である。しかしながら、ウイルスの酵素群を標的とした薬剤に対する耐性ウイルス株の出現が大きな問題となっている。HIVに対するカクテル療法の開発により、エイズの治療法は飛躍的に進歩した。HCVは単一なクローンとしては存在せず、極めてヘテロな集団(quasispecies)が患者の体内でダイナミックに変動しながら持続感染を維持していると考えられており、HCVの感染における糖鎖の役割に関する解析は難航が予想される。しかしながら、HCVの感染における糖鎖修飾の役割を解析し、その成績を基にして開発されたHCVの侵入阻害剤は、複製酵素の阻害剤と併用することで、慢性C型肝炎患者の治療に極めて有望であると考えられる。
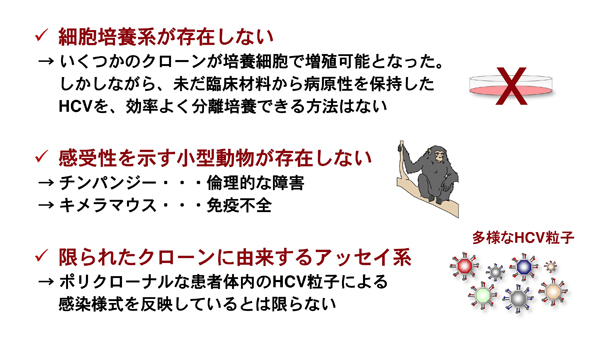
図 4 HCV感染機構解析における問題点
1) 未だ全ての遺伝子型のHCVを増殖できるような細胞培養系は存在しない。最近、IFNで治癒可能なgenotype2aのJFH1株(HCVcc)が構築された。HCVccは特殊な細胞株でのみ増殖するが、チンパンジーには全く病原性を示さない実験室株である。臨床の現場で最も問題となっている1aや1bといった1型のHCVの培養は未だ成功していない。
2) チンパンジー以外にHCVに感受性を示す小動物が存在しない。
3) HCVは多種多様なウイルスが混在しており(多種性)、モノクローンな解析では患者の体内で起こっている感染を再現できない可能性がある。
References
- Agnello, V., Abel, G., Elfahal, M., Knight, G. B., Zhang, Q. X. Hepatitis C virus and other flaviviridae viruses enter cells via low density lipoprotein receptor. Proc Natl Acad Sci USA 96, 12766-12771, 1999.
- Barth, H., Schafer, C., Adah, M. I., Zhang, F., Linhardt, R. J., Toyoda, H., Kinoshita-Toyoda, A., Toida, T., Van Kuppevelt, T. H., Depla, E., Von Weizsacker, F., Blum, H. E., Baumert, T. F. Cellular binding of hepatitis C virus envelope glycoprotein E2 requires cell surface heparan sulfate. J Biol Chem 278, 41003-41012, 2003.3.
- Barth, H., Schnober. E.K., Zhang, F., Linhardt, R.J., Depla, E., Boson, B., Cosset, F.L., Patel, A.H., Blum, H.E., Baumert, T.F. Viral and cellular determinants of the hepatitis C virus envelope-heparan sulfate interaction. J Virol 80, 10579-10590, 2006.
- Bartosch, B., Dubuisson, J., Cosset, F. L. Infectious hepatitis C virus pseudo-particles containing functional E1-E2 envelope protein complexes. J Exp Med 197, 633-642, 2003.
- Bartosch, B., Verney, G., Dreux, M., Donot, P., Morice, Y., Penin, F., Pawlotsky, J.M., Lavillette, D., Cosset, F.L. An Interplay between Hypervariable Region 1 of the Hepatitis C Virus E2 Glycoprotein, the Scavenger Receptor BI, and High-Density Lipoprotein Promotes both Enhancement of Infection and Protection against Neutralizing Antibodies. J Virol 79, 8217-8229, 2005.
- Baumert, T. F., Ito, S., Wong, D. T., Liang, T. J. Hepatitis C virus structural proteins assemble into viruslike particles in insect cells. J Virol 72, 3827-3836, 1998.
- Chen, Y., Maguire, T., Hileman, R.E., Fromm, J.R., Esko, J.D., Linhardt, R.J., Marks, R.M. Dengue virus infectivity depends on envelope protein binding to target cell heparan sulfate. Nat Med 3, 866-871, 1997.
- Deleersnyder, V., Pillez, A., Wychowski, C., Blight, K., Xu, J., Hahn, Y.S., Rice, C.M., Dubuisson, J. Formation of native hepatitis C virus glycoprotein complexes. J Virol 71, 697-704, 1997.
- Drummer, H. E., Maerz, A., Poumbourios, P. Cell surface expression of functional hepatitis C virus E1 and E2 glycoproteins. FEBS Lett 546, 385-390, 2003.
- Dubuisson, J., Helle, F., Cocquerel, L. Early steps of the hepatitis C virus life cycle. Cell Microbiol 10, 821-827, 2008.
- Duvet, S., Cocquerel, L., Pillez, A., Cacan, R., Verbert, A., Moradpour, D., Wychowski, C., Dubuisson, J. Hepatitis C virus glycoprotein complex localization in the endoplasmic reticulum involves a determinant for retention and not retrieval. J Biol Chem 273, 32088-32095, 1998.
- Evans, M. J., von Hahn, T., Tscherne, D.M., Syder, A.J., Panis, M., Wölk, B., Hatziioannou, T., McKeating, J.A., Bieniasz, P.D., Rice, C.M. Claudin-1 is a hepatitis C virus co-receptor required for a late step in entry. Nature 446, 801-805, 2007.
- Flint, M., Logvinoff, C., Rice, C. M., McKeating, J. A. Characterization of infectious retroviral pseudotype particles bearing hepatitis C virus glycoproteins. J Virol 78, 6875-6882, 2004.
- Goffard, A., Callens, N., Bartosch, B., Wychowski, C., Cosset, F.L., Montpellier, C., Dubuisson, J. Role of N-linked glycans in the functions of hepatitis C virus envelope glycoproteins. J Virol 79, 8400-8409, 2005.
- Goffard, A., Dubuisson, J. Glycosylation of hepatitis C virus envelope proteins. Biochimie 85, 295-301, 2003.
- Hilgard, P., Stockert, R. Heparan sulfate proteoglycans initiate dengue virus infection of hepatocytes. Hepatology 32, 1069-1077, 2000.
- Hsu, M., Zhang, J., Flint, M., Logvinoff, C., Cheng-Mayer, C., Rice, C.M., McKeating, J.A. Hepatitis C virus glycoproteins mediate pH-dependent cell entry of pseudotyped retroviral particles. Proc Natl Acad Sci USA 100, 7271-7276, 2003.
- Ishii, K., Murakami, K., Hmwe, S.S., Zhang, B., Li, J., Shirakura, M., Morikawa, K., Suzuki, R., Miyamura, T., Wakita, T., Suzuki, T. Trans-encapsidation of hepatitis C virus subgenomic replicon RNA with viral structure proteins. Biochem Biophys Res Commun 371, 446-450, 2008.
- Kanda, T., Basu, A., Steele, R., Wakita, T., Ryerse, J.S., Ray, R., Ray, R.B. Generation of infectious hepatitis C virus in immortalized human hepatocytes. J Virol 80, 4633-4639, 2006.
- Khromykh, A. A., Varnavski, A. N., Westaway, E. G. Encapsidation of the flavivirus kunjin replicon RNA by using a complementation system providing Kunjin virus structural proteins in trans. J Virol 72, 5967-5977, 1998.
- Lindenbach, B. D., Evans, M.J., Syder, A.J., W
 lk, B., Tellinghuisen, T.L., Liu, C.C., Maruyama, T., Hynes, R.O., Burton, D.R., McKeating, J.A., Rice, C.M. Complete Replication of Hepatitis C Virus in Cell Culture. Science 309, 623-626, 2005.
lk, B., Tellinghuisen, T.L., Liu, C.C., Maruyama, T., Hynes, R.O., Burton, D.R., McKeating, J.A., Rice, C.M. Complete Replication of Hepatitis C Virus in Cell Culture. Science 309, 623-626, 2005.
- Matsuo, E., Tani, H., Lim, C., Komoda, Y., Okamoto, T., Miyamoto, H., Moriishi, K., Yagi, S., Patel, A.H., Miyamura, T., Matsuura, Y. Characterization of HCV-like particles produced in a human hepatoma cell line by a recombinant baculovirus. Biochem Biophys Res Commun 340, 200-208, 2006.
- Matsuura, Y., Tani, H., Suzuki, K., Kimura-Someya, T., Suzuki, R., Aizaki, H., Ishii, K., Moriishi, K., Robison, C.S., Whitt, M.A., Miyamura, T. Characterization of pseudotype VSV possessing HCV envelope proteins. Virology 286, 263-275, 2001.
- Meertens, L., Bertaux, C., Cukierman, L., Cormier, E., Lavillette, D., Cosset, F.L., Dragic, T. The tight junction proteins claudin-1, -6, and -9 are entry cofactors for hepatitis C virus. J Virol 82, 3555-3560, 2008.
- Meunier, J. C., Engle, R.E., Faulk, K., Zhao, M., Bartosch, B., Alter, H., Emerson, S.U., Cosset, F.L., Purcell, R.H., Bukh, J. Evidence for cross-genotype neutralization of hepatitis C virus pseudo-particles and enhancement of infectivity by apolipoprotein C1. Proc Natl Acad Sci USA 102, 4560-4565, 2005.
- Molina, S., Castet, V., Fournier-Wirth, C., Pichard-Garcia, L., Avner, R., Harats, D., Roitelman, J., Barbaras, R., Graber, P., Ghersa, P., Smolarsky, M., Funaro, A., Malavasi, F., Larrey, D., Coste, J., Fabre, J.M., Sa-Cunha, A., Maurel, P. The low-density lipoprotein receptor plays a role in the infection of primary human hepatocytes by hepatitis C virus. J Hepatol 46, 411-419, 2007.
- Morikawa, K., Zhao, Z., Date, T., Miyamoto, M., Murayama, A., Akazawa, D., Tanabe, J., Sone, S., Wakita, T. The roles of CD81 and glycosaminoglycans in the adsorption and uptake of infectious HCV particles. J Med Virol 79, 714-723, 2007.
- Nielsen, S. U., Bassendine, M.F., Burt, A.D., Martin, C., Pumeechockchai, W., Toms, G.L. Association between hepatitis C virus and very-low-density lipoprotein (VLDL)/LDL analyzed in iodixanol density gradients. J Virol 80, 2418-2428, 2006.
- Op De Beeck, A., Voisset, C., Bartosch, B., Ciczora, Y., Cocquerel, L., Keck, Z., Foung, S., Cosset, F.L., Dubuisson, J. Characterization of functional hepatitis C virus envelope glycoproteins. J Virol 78, 2994-3002, 2004.
- Pileri, P., Uematsu, Y., Campagnoli, S., Galli, G., Falugi, F., Petracca, R., Weiner, A.J., Houghton, M., Rosa, D., Grandi, G., Abrignani, S. Binding of hepatitis C virus to CD81. Science 282, 938-941, 1998.
- Pohlmann, S., Zhang, J., Baribaud, F., Chen, Z., Leslie, G.J., Lin, G., Granelli-Piperno, A., Doms, R.W., Rice, C.M., McKeating, J.A. Hepatitis C virus glycoproteins interact with DC-SIGN and DC-SIGNR. J Virol 77, 4070-4080, 2003.
- Rocha-Perugini, V., Montpellier, C., Delgrange, D., Wychowski, C., Helle, F., Pillez, A., Drobecq, H., Le Naour, F., Charrin, S., Levy, S., Rubinstein, E., Dubuisson, J., Cocquerel, L. The CD81 partner EWI-2wint inhibits hepatitis C virus entry. PLoS ONE 3, e1866, 2008.
- Sandrin, V., Boulanger, P., Penin, F., Granier, C., Cosset, F.L., Bartosch, B. Assembly of functional hepatitis C virus glycoproteins on infectious pseudoparticles occurs intracellularly and requires concomitant incorporation of E1 and E2 glycoproteins. J Gen Virol 86, 3189-3199, 2005.
- Sato, K., Okamoto, H., Aihara, S., Hoshi, Y., Tanaka, T., Mishiro, S. Demonstration of sugar moiety on the surface of hepatitis C virions recovered from the circulation of infected humans. Virology 196, 354-357, 1993.
- Scarselli, E., Ansuini, H., Cerino, R., Roccasecca, R.M., Acali, S., Filocamo, G., Traboni, C., Nicosia, A., Cortese, R., Vitelli, A. The human scavenger receptor class B type I is a novel candidate receptor for the hepatitis C virus. Embo J 21, 5017-5025, 2002.
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient Trans-Encapsidation of Hepatitis C Virus RNAs into Infectious Virus-like Particles. J Virol 82, 7034-7046, 2008.
- Su, C. M., Liao, C.L., Lee, Y.L., Lin, Y.L. Highly sulfated forms of heparin sulfate are involved in japanese encephalitis virus infection. Virology 286, 206-215, 2001.
- Tani, H., Komoda, Y., Matsuo, E., Suzuki, K., Hamamoto, I., Yamashita, T., Moriishi, K., Fujiyama, K., Kanto, T., Hayashi, N., Owsianka, A., Patel, A.H., Whitt, M.A., Matsuura, Y. Replication-competent recombinant vesicular stomatitis virus encoding hepatitis C virus envelope proteins. J Virol 81, 8601-8612, 2007.
- Voisset, C., Dubuisson, J. Functional hepatitis C virus envelope glycoproteins. Biol Cell 96, 413-420, 2004.
- von Hahn, T., Lindenbach, B.D., Boullier, A., Quehenberger, O., Paulson, M., Rice, C.M., McKeating, J.A. Oxidized low-density lipoprotein inhibits hepatitis C virus cell entry in human hepatoma cells. Hepatology 43, 932-942, 2006.
- Wakita, T., Pietschmann, T., Kato, T., Date, T., Miyamoto, M., Zhao, Z., Murthy, K., Habermann, A., Kr?usslich, H.G., Mizokami, M., Bartenschlager, R., Liang, T.J. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat Med 11, 791-796, 2005.
- Wunschmann, S., Medh, J.D., Klinzmann, D., Schmidt, W.N., Stapleton, J.T. Characterization of hepatitis C virus (HCV) and HCV E2 interactions with CD81 and the low-density lipoprotein receptor. J Virol 74, 10055-10062, 2000.
- Yi, M., Villanueva, R.A., Thomas, D.L., Wakita, T., Lemon, S.M. Production of infectious genotype 1a hepatitis C virus (Hutchinson strain) in cultured human hepatoma cells. Proc Natl Acad Sci USA 103, 2310-2315, 2006.
- Zheng, A., Yuan, F., Li, Y., Zhu, F., Hou, P., Li, J., Song, X., Ding, M., Deng, H. Claudin-6 and claudin-9 function as additional coreceptors for hepatitis C virus. J Virol 81, 12465-12471, 2007.





