Mar. 19, 2007
コンドロイチン硫酸合成に関与する糖転移酵素(2007 Vol.11, A1)
後藤 雅式 / 佐藤 隆 / 成松 久
氏名:後藤 雅式
1985年東京理科大学理学部卒業、1987年同大学院修士課程修了、1987年から(株)東芝、1993年からファルマシアバイオテク(株)(現GEヘルスケア)を経て、2001年から産業技術総合研究所にて「糖鎖合成関連遺伝子のライブラリー構築」プロジェクトに参加、2003年に筑波大学にて博士(医学)取得、2005年12月に(株)グライコジーンを設立し取締役を兼務。
氏名:佐藤 隆
福島県出身。1994年宇都宮大学農学部を卒業後、1999年に筑波大学生物科学研究科にて学位を取得。2001年、産業技術総合研究所にてNEDOの糖鎖遺伝子(GG)プロジェクト、2003年からは糖鎖構造解析(SG)プロジェクトに参加。成松プロジェクトリーダーの強力なリーダーシップの元で糖鎖遺伝子及び糖鎖機能の研究を精力的に進めている。
氏名:成松 久
鳴門市出身、慶應義塾大学医学部1974年卒。同大学院医学研究科微生物学専攻1979年修了。医学博士。1985年にNIH,NCIのDr.Pradman Qasbaの研究室にて、最初の糖転移酵素β4Gal-T1遺伝子クローニングに成功する。1986年に帰国後、慶應義塾大学微生物学教室助教授を経て、1991年より新設の創価大学生命科学研究所教授。2000年に工業技術院(現・産業技術総合研究所)の生命工学工業技術研究所に移る。2002年6月に産業技術総合研究所に糖鎖工学研究センターを設立し副センター長。2006年に、同センターを継承した糖鎖医工学研究センターを設立し、センター長および糖鎖遺伝子機能解析チームリーダーとして現在に至る。筑波大学大学院人間総合科学研究科(医学系)の連携大学院教授を兼任。
1. はじめに
2001年、北川らによってコンドロイチン合成酵素(ChSy/CSS1)遺伝子がクローニングされて以来1、コンドロイチン硫酸の糖鎖部分を合成する6種類の酵素が見つかってきた。これらの酵素はアミノ酸配列から相同性が高く、少なくともGalNAcあるいはGlcAを転移する活性を有していると考えられている。本項では、これら6種類の糖転移酵素に関するこれまでの知見を記す。
2. 糖転移酵素ドメインと遺伝子クローニング
コンドロイチン硫酸を合成する糖転移酵素群は、極めて相同性の高いアミノ酸配列を有している。図1にGENETYXによる系統樹とドメイン構造の概略を示す。最初に発見されたChSyにはN-末端付近に膜貫通ドメインが存在し、その後にβ3GTドメイン(β1,3結合で糖を転移する酵素に共通するドメインでβ3GTモチーフを有する)、β4GTドメイン(β1,4結合糖転移酵素に共通するドメインでβ4GTモチーフを有する)と続く。
6種類の酵素は、2つずつ3つのグループに分けられる(図1の系統樹参照)。ChSyと最も相同性の高い糖転移酵素はコンドロイチン硫酸合成酵素III(CSS3)2である。アミノ酸レベルで62%が一致している。
第2のグループは、コンドロイチン硫酸グルクロン酸転移酵素(CSGlcA-T)3とコンドロイチン硫酸合成酵素II (ChPF/CSS2)4,5である。ChSy同様、2つの糖転移酵素が繋がった長い糖転移酵素でβ3GTドメインは保存されているが、β4GTドメインは比較的相同性が低い。β4Gal-T1を参考にした立体構造予測では、両酵素とも2ヶ所のループの存在が示唆されている5。両酵素は相同性が57%と高い値を示す。また、エクソン/イントロン構造も極めて似ている。
最後のグループにはコンドロイチン硫酸GalNAc転移酵素I(ChGalNAc-T1/CSGalNAc-T1)6,7及びII(CSGalNAc-T2/ChGalNAc-T2)8,9が属している。これらの酵素にはβ3GTドメインが存在しておらず、膜貫通ドメインとβ4GTからなる糖転移酵素である。両者もアミノ酸レベルで高い相同性(60%)を示す。
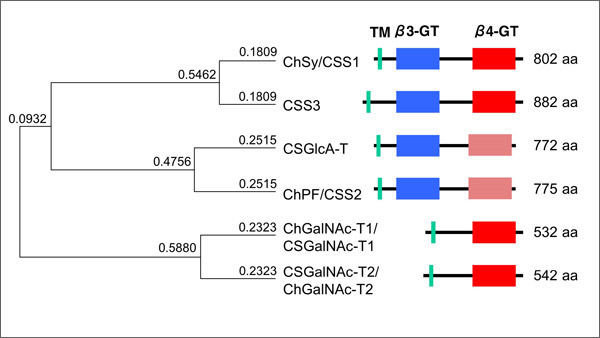
図 1
3. 糖転移酵素の基質特異性
各糖転移酵素に含まれるドメインは、その活性を表している。2つのドメインからなるChSy並びにCSS3は、GalNAcに対するGlcA転移活性とGlcAに対するGalNAc転移活性を示した。即ち、β3GTドメインはβ1,3GlcA転移活性を、β4GTドメインはβ1,4GalNAc転移活性を有すると考えられる。両酵素を比較すると、GlcA-T活性もGalNAc-T活性もChSyのほうがCSS3より1桁程度活性が高かった(CSS3の論文)。しかし、単独でのコンドロイチン伸長活性は認められなかった 1。
第2のグループであるCSGlcA-Tはβ1,3GlcA-T活性だけしか検出できなかったのに対し、ChPFは弱いながらもβ1,4GalNAc-T活性も検出できた。興味深いのは、単独では伸長活性が検出できなかったChSyも、ChPFと共発現させることにより、コンドロイチン鎖を伸長することが明らかになった4。
最後のグループのChGalNAc-T1とCSGalNAc-T2は、ともにβ1,4GalNAc-T活性を有している。詳細な基質特異性に関しては不明な点も多いが、少なくともある種のタンパク質に対しては、コンドロイチン硫酸の合成開始活性(GalNAcT-I活性)が強いのがChGalNAc-T1であり、伸長活性(GalNAcT-II活性)が強いのがCSGalNAc-T2であった8。
一方、これらの遺伝子は、程度の差こそあれ調べた限り全ての組織で発現が見られた2,5,8。これは、コンドロイチン硫酸が細胞外マトリックスとしてあらゆる組織に存在することと矛盾しない。これら全部の酵素が揃ってはじめて、コンドロイチン硫酸の合成が可能になると考えてもよさそうである。
4. おわりに
以上の結果をまとめたのが図2である。ヘパラン硫酸合成と同じように、2種類の単糖を転移する酵素と一種類の単糖のみを転移する酵素が存在する。今後は、これらの酵素がどのように関わり合ってコンドロイチン硫酸が合成されるのかを詳細に解明する必要がある。
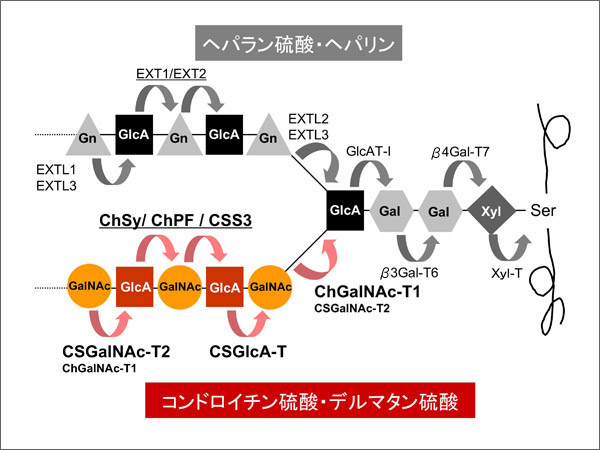
図 2
References
- Kitagawa H, Uyama T, Sugahara K: Molecular cloning and expression of a human chondroitin synthase, J Biol Chem, 276, 38721-38726, 2001
- Yada T, Sato T, Kaseyama H, Gotoh M, Iwasaki H, Kikuchi N, Kwon YD, Togayachi A, Kudo T, Watanabe H, Narimatsu H, Kimata K:Chondroitin sulfate synthase-3. Molecular cloning and characterization, J Biol Chem, 278, 39711-39725, 2003
- Gotoh M, Yada T, Sato T, Akashima T, Iwasaki H, Mochizuki H, Inaba N, Togayachi A, Kudo T, Watanabe H, Kimata K, Narimatsu H:Molecular cloning and characterization of a novel chondroitin sulfate glucuronyltransferase that transfers glucuronic acid to N-acetylgalactosamine, J Biol Chem, 277, 38179-38188, 2002
- Kitagawa H, Izumikawa T, Uyama T, Sugahara K:Molecular cloning of a chondroitin polymerizing factor that cooperates with chondroitin synthase for chondroitin polymerization, J Biol Chem, 278, 23666-23671, 2003
- Yada T, Gotoh M, Sato T, Shionyu M, Go M, Kaseyama H, Iwasaki H, Kikuchi N, Kwon YD, Togayachi A, Kudo T, Watanabe H, Narimatsu H, Kimata K: Chondroitin sulfate synthase-2. Molecular cloning and characterization of a novel human glycosyltransferase homologous to chondroitin sulfate glucuronyltransferase, which has dual enzymatic activities, J Biol Chem, 278, 30235-30247, 2003
- Uyama T, Kitagawa H, Tamura Ji J, Sugahara K: Molecular cloning and expression of human chondroitin N-acetylgalactosaminyltransferase: the key enzyme for chain initiation and elongation of chondroitin/dermatan sulfate on the protein linkage region tetrasaccharide shared by heparin/heparan sulfate, J Biol Chem, 277, 8841-8846, 2002
- Gotoh M, Sato T, Akashima T, Iwasaki H, Kameyama A, Mochizuki H, Yada T, Inaba N, Zhang Y, Kikuchi N, Kwon YD, Togayachi A, Kudo T, Nishihara S, Watanabe H, Kimata K, Narimatsu H:Enzymatic synthesis of chondroitin with a novel chondroitin sulfate N-acetylgalactosaminyltransferase that transfers N-acetylgalactosamine to glucuronic acid in initiation and elongation of chondroitin sulfate synthesis, J Biol Chem, 277, 38189-38196, 2002
- Sato T, Gotoh M, Kiyohara K, Akashima T, Iwasaki H, Kameyama A, Mochizuki H, Yada T, Inaba N, Togayachi A, Kudo T, Asada M, Watanabe H, Imamura T, Kimata K, Narimatsu H:Differential roles of two N-acetylgalactosaminyltransferases, CSGalNAcT-1, and a novel enzyme, CSGalNAcT-2. Initiation and elongation in synthesis of chondroitin sulfate, J Biol Chem, 278, 3063-3071, 2003
- Uyama T, Kitagawa H, Tanaka J, Tamura J, Ogawa T, Sugahara K:Molecular cloning and expression of a second chondroitin N-acetylgalactosaminyltransferase involved in the initiation and elongation of chondroitin/dermatan sulfate, J Biol Chem, 278, 3072-3078, 2003




