氏名:James W. Dennis1,2,3
1 Samuel Lunenfeld Research Institute, Mount Sinai Hospital
2 Department of Medical Genetics & Microbiology, University of Toronto
3 Department of Laboratory Medicine and Pathology, University of Toronto
後生動物において、ゴルジ装置でのN型糖鎖の生成経路によって、糖鎖付加された成熟な糖タンパク質ができ、様々な数のN-アセチルラクトサミンによって複雑な構造になる。これらのN-アセチルラクトサミンに結合するガレクチンは、1つまたは2つの糖鎖認識部位(CRD)を持つ可溶型N-アセチルラクトサミン結合タンパクのファミリーである。ガレクチンのN型糖鎖に対する親和性は、 GlcNAc鎖とN-アセチルラクトサミンの数に比例する1。その最も強い親和性をもつリガンドが、N-アセチルグルコサミン転移酵素V(Mgat5)の産物である3本鎖糖鎖にポリN-アセチルラクトサミンが伸長したものである。
癌遺伝子Ras-Erk-Ets経路は、Mgat5の転写を促進し、癌ではβ1,6GlcNAc鎖とポリN-アセチルラクトサミンの増加することが多い。ガレクチン3は、Mgat5が糖鎖修飾した細胞表面のEGF受容体またはTGF-β受容体のN型糖鎖に交叉結合し、格子を形成して恒常的なエンドサイトーシスによる受容体の除去を遅延させる2。ガレクチン3は1つのCRDを持ち、N端の非レクチンドメインは多価リガンドの存在下で5量体形成に関与し、それゆえリガンド濃度に比例して糖タンパク質のクロスリンクに関与する3。受容体型チロシンキナーゼの下流にある癌遺伝子のシグナルは、小胞の細胞内輸送やエンドサイトーシスを促進させる。しかし同時に受容体のN型糖鎖のGlcNAc分岐が増加するとガレクチンの交叉を促進させ、エンドサイトーシスによる受容体の消失を阻害する。それゆえ、ガレクチンの格子は、細胞表面のサイトカイン受容体の増加を促し、増殖因子に対する感受性を増加させる。そして膜の流動性が増加して、細胞骨格が改変された結果、細胞の運動性と浸潤性を高める。Mgat5欠損の乳癌細胞は、EGF、 IGF-1、PDGF、FGFそしてTGFβなどのサイトカインに対する感受性の全体的な低下が見られる。この結果、in vivoで転移が抑制され4、乳癌細胞が上皮と間質系細胞の中間体のような細胞 (EMT)になれない2。EMTは、浸潤性の高い表現型が特徴で、RasとTGFβ/Smadのシグナル経路に左右される。腹腔内のマクロファージは、ガレクチン格子を必要とし、運動性が高くてエンドサイトーシスがよく起こる細胞のもう一つの実例と言える。Mgat5欠損マクロファージでは、サイトカインを介するシグナル、貪食能、in vivoにおける血管内から腹腔内への滲出能などが欠損する。ガレクチン3欠損マクロファージでもよく似た機能欠損が見られる。ガレクチンの機能の冗長性とN型糖鎖のリガンドの多様性、そして受容体あたりの複雑なN型糖鎖が、格子モデルの制御を難解なものにしている。
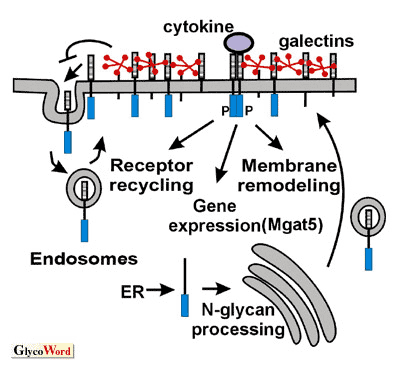
図 1 ガレクチン格子によるサイトカイン受容体停滞のモデル
Ras/ErkそしてSmad2/3の活性化はMgat5遺伝子の発現を促進させ、β1-6GlcNAc鎖をもつ細胞表面の糖タンパク質を糖鎖修飾する。これらのサイトカイン受容体のN型糖鎖は、ガレクチンとの親和性を高める。即ち、受容体との格子結合を強め、連続的なエンドサイトーシスを弱め、受容体を細胞表面に留めることを促進させる。
ガレクチンによるサイトカイン受容体の制御が胎生期に必要か否かは、まだわかっていない。しかし、N-アセチルラクトサミンを含む複合型N型糖鎖が発生に必須であることは明らかである。何故なら、それらの完全欠損であるMgat1欠損マウスは胎生致死であるからだ5。Mgat2欠損マウスは、N-アセチルラクトサミンを含むN型糖鎖の減少を引き起こし、出産後致死である。そして多くの組織において、ヒトII型CDG (Congenital Disorders of Glycosylation) に類似した形態的異常を認めた。出産後の致死は、同じ酵素活性をもつ6つのβ1-4GalT遺伝子の中で最もメジャーなβ1-4GalT Iの欠損マウスでも見られる。Mgat5は胎生期のマウスには必要ないが、成熟したMgat5欠損マウスでは、自己免疫性疾患に罹患しやすかったり、癌の進展抑制が見られたりした。いずれもガレクチン格子に依存する表現型のように思える4,6。