Jun. 1, 2005
O-GlcNAc入門(2005 Vol.09, A2)
Kaoru Sakabe / Gerald W. Hart
氏名:Kaoru Sakabe
ノースカロライナ大学チャペルヒル校(生化学)卒業後、NIHの特別研究員を経て、現在、ジョンス・ホプキンス大学医学部大学院において、生化学、細胞生物学および分子生物学を専攻中。
氏名:Gerald W. Hart
ジョンス・ホプキンス大学医学部の生物化学教室教授。1977年にカンザス州立大学から発生生物学の学位を授与され、ジョンス・ホプキンス大学のWilliam J. Lennarz博士のもとでのポスドクを経て、1979年に生物化学の教官となり、現在に至る。 Glycobiology創刊時の編集長を務めた。
1. 要旨
O結合型β-N-アセチルグルコサミン (O-GlcNAc) による核細胞質タンパク質修飾について最初に報告されてから20年がたった。しかし、この普遍的な翻訳後修飾の機能については、まだほとんどわかっていない。糖による修飾はもっぱら細胞の細胞外表面または小胞体、ゴルジ体および他の細胞小器官内においてのみおこるという当時の考え方に挑戦する形で、O-GlcNAcが核および細胞質において発見された。それ以来、すべての多細胞生物体に存在するO-GlcNAcとその制御ミスは、がん、2型糖尿病およびアルツハイマー病のような疾患に密接に関係することが示されてきた。
2. はじめに
O-GlcNAc化は、セリンおよびスレオニン残基の水酸基へのβ-N-アセチルグルコサミンという単糖のO-グリコシド結合による酵素的付加である。この構造は通常、他のタイプの糖鎖形成とは異なり、これ以上伸長されることはない。O-GlcNAcの半減期は、コアとなるタンパク質と比べて極端に短いことが明らかとなっており、このことはO-GlcNAcが細胞におけるシグナル伝達、とりわけリン酸化のような役割を果たしていることを示している。実際、多くの研究者が、分裂促進因子活性化、細胞周期およびストレスのような刺激に応じてO-GlcNAc量がダイナミックに変化することを観察してきた1,2,3。
これまでに多くのO-GlcNAc化タンパク質について報告されてきた。しかしながら、同定されていない他のものが無数に残されている。報告されたものの中には、RNAポリメラーゼIIと転写因子、腫瘍抑制因子とがん遺伝子産物、クロマチンおよび核膜孔タンパク質、RNAプロセシングタンパク質、タンパク質翻訳制御タンパク質、ウイルスタンパク質、細胞骨格タンパク質および細胞質ゾル酵素がある (図1)4。現在までに同定されたO-GlcNAc化タンパク質はすべてリン酸化による修飾も受けている。このことは、O-GlcNAcの1つの役割がリン酸化を補完するかあるいは、調節することにあるかもしれない。更に、リン酸基によって修飾される部位はO-GlcNAc化部位と多くの場合同じか、あるいは近傍のアミノ酸内にあり、このことはこれら2つの修飾が、多くの場合、相補的に行われていることを示している5,6,7。
O-GlcNAcの付加および除去に関係する酵素について同定、精製、性状の研究、およびクローニングがなされてきた (広範囲な概説として参考文献の8を参照)。UDP-GlcNAc:ポリペプチド転移酵素あるいはO-GlcNAc転移酵素 (OGT) は、活性化された糖供与体ウリジン2リン酸-N-アセチルグルコサミン (UDP-GlcNAc) からのN-アセチルグルコサミンの転移を触媒し、一方、β-D-N-アセチルグルコサミニダーゼあるいはO-GlcNAcaseは、タンパク質から糖部分を加水分解的に除去する。
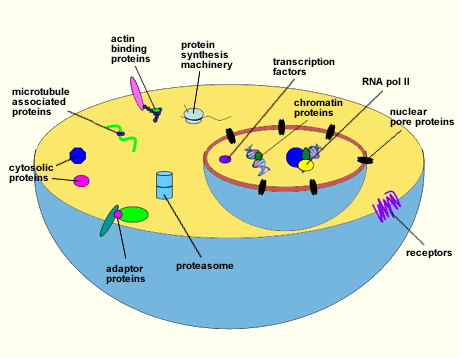
図 1 O-GlcN化されたタンパク質の例。
種々のタンパク質がO-GlcNAcで修正されることが示されている。ここにはRNAポリメラーゼIIと転写因子、腫瘍抑制因子とがん遺伝子産物、クロマチンおよび核膜孔タンパク質、RNA処理タンパク質、タンパク質翻訳制御タンパク質、細胞骨格タンパク質および細胞質ゾル酵素があげられている。
3. 糖供与体の生合成
活性化された糖基質UDP-GlcNAcはヘキソサミン生合成経路 (HBP) で合成される(図2)。細胞に取り込まれるグルコースのおよそ2-5%(細胞のタイプによる)がこの経路に組み込まれ9、アミノ糖および活性化アミノ糖(その最終生成物がUDP-GlcNAcである)が生成する。細胞内のUDP-GlcNAcのプールは細胞の栄養状態によって絶妙に制御される。その前駆体はそれ自体が、ヌクレオチド、グルコース、アミノ酸および脂肪酸によって制御されるからである。また、タンパク質へのO-GlcNAcの付加は、広範囲の濃度のUDP-GlcNAcに高い反応性を示す。更に、OGTのペプチド特異性は、部分的にはUDP-GlcNAcの濃度に依存的であり10、HBPを経由する代謝の流れがOGT活性を制御するだけではなく、その標的分子をも制御することが可能であることを示唆している。
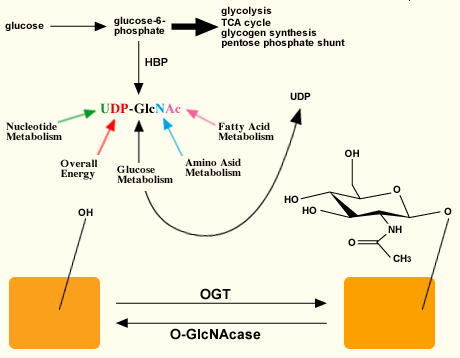
図 2 O-GlcNAc 転移酵素 (OGT) とO-GlcNAcaseの関係。
OGTによる作用を受ける活性化された糖基質は、ヘキソサミン生合成経路 (HBP) で合成される。基質は異なる代謝経路に対して反応性を持つ。OGTは、セリンとスレオニンの水酸基へのN-アセチルグルコサミン付加を触媒し、O-GlcNAcaseは糖を加水分解除去する。これらの修飾がなされる部位は、リン化される部位と同じか近傍にある。
4. 酵素について(図2)
リン酸基の付加および除去に関与する多数のキナーゼおよびホスファターゼがある一方、OGTの触媒サブユニットおよびO-GlcNAcaseについてはそれぞれ1つだけが見つかっている。OGTのアミノ酸一次配列は、線虫から人間までほとんど変化していない11。OGTの一次配列レベルに関連するポリペプチドは、酵母または大腸菌では見つかっていない。しかしながら、これらの生物体が異なる一次配列を持つOGTを持っているか、または、そのかわりに、この種の細胞内のグリコシレーションがないのか、あるいは同じ機能を果たすためにGlcNAc以外の異なる糖を使っている可能性もある。
多くの組織において、110kDaのサブユニットからなる同一分子の三量体としてその酵素は見つかっている。しかしながら、肝臓のようないくつかの組織では、OGTは主に110kDaのサブユニットと78kDaのサブユニットからなる二量体を形成している12。78kDaサブユニットは、タンパク分解または選択的スプライシングによって生じるようである。加えて、選択的スプライシング異性体として生じるミトコンドリア標的分子としてのOGT13も存在するようである14。OGTは二つの機能のことなる構造、すなわち、11.5から13のテトラトリコペプチド反復配列 (TPR) からなるタンパク質N-末端部位および触媒部位を含むC-末端部分を持っている。TPRは様々なタンパク質で見つかっており、タンパク質-タンパク質相互作用において重要であることが示されてきた10。OGTにおけるTPRは、基質認識にとってだけでなく、酵素の多量体形成にとっても重要であると推測される。OGTの触媒部位はグリコーゲンホスホリラーゼ/グルコシルトランスフェラーゼスーパーファミリーに弱い相同性を示す15。
OGTの遺伝子座はマウスおよびヒトにおいてはX染色体に存在している。特記すべきことは、OGTはヒトではXq13.1に遺伝子座があり16、そこにはパーキンソン病の遺伝子座もあるということである。マウスのO-GlcNAc遺伝子破壊研究によって、O-GlcNAcはES細胞の生存に必要不可欠であることが示されている17。
正確な基質配列モチーフは見つかっていないが、修飾部位の近くにはプロリンがしばしば存在するようである10。興味深いことに、この結果は、プロリン支配的なリン酸化とO-GlcNAc化の相関関係を示唆している。更に、OGTはO-GlcNAc化およびチロシンリン酸化の両方によって修飾される18。
タンパク質からO-GlcNAcを除去する加水分解酵素であるO-GlcNAcaseは、O-GlcNAc化ペプチドに対する特異性とpH中性で活性を持つことに基づいて精製された。これは他のグリコシダーゼの至適pHが酸性であり、リソソームに存在することが示唆されるのと対照的である19。O-GlcNAcaseは普遍的に発現しており、分子サイズは130 kDaである。興味深いことに、75 kDaのスプライシングバリアントが存在している。これは選択的停止コドンの結果である。このスプライシングバリアントは、酵素のC-末端部分を欠き、触媒活性を欠いている20。単量体は触媒活性を持っているが、組織からの酵素の精製により、それは大きな340kDa複合体を形成していることが明らかになっており21、in vivoにおいて多くのタンパク質と会合していることを示している。
O-GlcNAcaseもまた2つの異なる機能をもつ構造領域のある酵素である。N-末端部位は細菌のヒアルロニダーゼに対して弱い相同性を持ち21、一方、C-末端部分はアセチル基転移酵素のGCN5関連ファミリーに弱い相同性を持っている22 。N-末端とC-末端は結合領域によってつながっている。その遺伝子座は10q24にあり、そこは遅発性アルツハイマー病にも関連している。
O-GlcNAcaseは、アポトーシスに関与する実質的なカスパーゼであるカスパーゼ-3による切断にとってよい基質である23。切断部位は明らかにされていないが、in vitroでは、カスパーゼ-3による切断はO-GlcNAcase活性を阻害しない。
5. O-GlcNAcの機能
タンパク質-タンパク質相互作用
リン酸基がタンパク質-タンパク質相互作用において重要な構造決定基であることは、今では広く受け入れられている24。例えば、SH2ドメインおよび14-3-3ドメインはリン酸化チロシンおよびリン酸化セリン/スレオニン残基にそれぞれ結合する。O-GlcNAcの役割の1つは、GlcNAc化された多くのタンパク質が多量体を形成していることから、タンパク質-タンパク質相互作用を仲介することであると推測される。例えば、YY1はO-GlcNAcによって修飾され得るジンクフィンガーDNA結合転写因子である。O-GlcNAc化は、網膜芽細胞腫タンパク質 (pRB) からDNA結合に関与するYY1の解離を引き起こす25。MHCクラスIによって提示されるペプチドのおよそ0.1%がO-GlcNAc化されていると推測されていることから、O-GlcNAcは結合も引き起こすかもしれない。この結果は、この翻訳後修飾がある種のT細胞受容体による認識にとって重要であることを示している26。更に、RNAポリメラーゼIIおよびほとんどの転写因子におけるO-GlcNAc修飾が、転写周期での転写開始前複合体の会合において重要な役割を果たしていることも明らかにされている。 (以下参照)。
分解
O-GlcNAについて考えられる別の役割としては、タンパク質分解の制御をあげることができる。プロリン、グルタミン酸、セリンおよびスレオニンに富む配列すなわちPEST配列は、標的タンパク質の迅速な分解をもたらす27 。興味深いことに、いくつかのO-GlcNAc部位はPEST配列に位置し、タンパク質を分解から保護するものと推測される。エストロゲン受容体βはSer16において、リン酸化またはO-GlcNAc化によって修飾される。この部位がリン酸化されている場合は、標的タンパク質として迅速に分解されるが、O-GlcNAc化されている場合は、たいへんゆっくりしか分解されない28。注目すべきことは、プロテアソームを含む定常的な触媒サブユニットの多くがO-GlcNAcによって修飾されていることである。プロテアソームのO-GlcNAc化の阻害によってあるタンパク質の分解が可能となる29。タンパク質の半減期を制御することによって、O-GlcNAc化は多くの細胞活動プロセスに対して一過性の影響を及ぼすことができる。
転写
現在までに研究された事実上すべてのRNAポリメラーゼII転写因子がO-GlcNAcによって修飾されている。転写におけるこの修飾の特定の役割は明らかにされていない。Stat5の場合には、O-GlcNAc化されたものが転写補助因子CBPと結合し、Stat5を介した転写を活性化する 30。しかしながら、ハウスキーピング遺伝子の制御に関係する、普遍的に存在する転写因子であるSp1がO-GlcNAcで修飾されると、ある種のプロモーターにおいては転写機構との相互作用が阻害される31。ただしSp1のO-GlcNAc化は、他のプロモーターにおいてはその活性を高める32。
更に、転写機構との相互作用にとって重要で、生体内機能のために不可欠であるRNAポリメラーゼIIのC-末端ドメイン (CTD) もまた高度にO-GlcNAc化されている33。CTDはO-GlcNAcによって多くの修飾がなされ得る7分子の繰り返しからなる。CTDはリン酸化されており、このリン酸化はプロモーターのクリアランスと伸長に不可欠であることが知られている。これらの2つの修飾は、RNAポリメラーゼII のCTDにおいては相互に排他的である34。O-GlcNAcの正確な役割は報告されていないが、活性化プロモーターへのRNAポリメラーゼIIのリクルートメントまたは転写開始前複合体の形成にとって重要かもしれない。O-GlcNAc化はまた、RNAポリメラーゼ IIを、容易に活性化し得る貯蔵型にしておく役割を果たしているかもしれない31。
シグナル伝達
細胞外表面から細胞内へのシグナルの伝達およびこれらのシグナルに応じた細胞応答は、細胞の生存と分化の両方を規定する。しばしば、これらのシグナルは、リン酸化やタンパク質分解のような動的な翻訳後修飾によって伝達される。リンパ球および小脳神経細胞の分裂促進活性化がO-GlcNAc レベルの迅速で一時的な変化を引き起こすことが示された1,5。これらの結果は、O-GlcNAcの一時的な変化が、標的タンパク質または遺伝子転写の活性化において付随する修飾もたらすために必要であることを示している。O-GlcNAcがインスリンのシグナル伝達経路を制御することも明らかにされている(以下参照)。これらの研究は、O-GlcNAc化がシグナル伝達に関係する動的な翻訳後修飾であることを確かなものにしている。
6. 疾患との関連
がん
細胞のがん化に関与する多くのタンパク質がO-GlcNAcによって修飾されたタンパク質として同定された。それらの中には、β-カテニン、p53、pRbファミリーおよびc-Mycがある4。特に、c-Mycにおける主なO-GlcNAc修飾部位である Thr58は、バーキットリンパ腫における変異のホットスポットとして知られており、主なGSK3βリン酸化部位である35。更に、O-GlcNAcase活性は、ある種のがん組織で増加している。種類の異なる乳がんを正常組織と比較した最近の研究では、腫瘍におけるO-GlcNAcaseレベルの増加とそれに対応するO-GlcNAcレベルの減少が示された36。これらの結果は、細胞増殖の制御において鍵となるリン酸化という現象の制御において、O-GlcNAcが重要な役割を果たしているという考え方をもたらした。
神経変性疾患
OGTおよびO-GlcNAcaseの遺伝子座はともに神経変性疾患と関連のある位置に存在する。すなわち、OGT遺伝子座はパーキンソン病と関連し、O-GlcNAcase遺伝子座は遅発性アルツハイマー病と関連している。これらの結果は、O-GlcNAcが神経変性疾患において重要な役割を果たしているかもしれないということを示唆している。実際、アルツハイマー病の病理において注目されている微小管結合タンパク質であるタウタンパク質は、リン酸化およびO-GlcNAc化されている。正常脳におけるタウタンパク質は、高度にO-GlcNAc修飾されている。アルツハイマー病に関係する神経原繊維変化において、過剰にリン酸化されたタウタンパク質が発見されている。そこで、脳の中のO-GlcNAcレベルの低下がタウタンパク質の異常なリン化をもたらす37 、すなわち、O-GlcNAcには保護効果があるという仮説が生まれた。β-アミロイド前駆体タンパク質 (APP)、ニューロフィラメントおよび多くのシナプス小胞タンパク質もまた、高度にO-GlcNAcによる修飾を受けている 38,39,40。こうした最近の研究は、ヒトの神経変性疾患におけるO-GlcNAcの変化に関する証拠を提示している。
糖尿病
世界中でおよそ1億7700万人が糖尿病を患っていると推測されている41。これらのうちのおよそ5-10%は1型糖尿病、すなわちインスリン依存性の糖尿病で、インスリンを合成する生体能力が破壊される自己免疫疾患である。2型糖尿病は、糖尿病患者の90-95%を占めており、末梢の細胞におけるインスリン作用の減弱によって特徴づけられる。これまでの研究は、HBPにおける変異の増加が、直接インスリン抵抗性に関係していることを示唆している42。この増加した変異はインスリン抵抗性の誘導に対応してUDP-GlcNAcレベル、すなわちO-GlcNAc化、おそらくはO-GlcNAc結合を増加させるであろう。培養脂肪細胞およびトランスジェニックマウスを用いた研究により、O-GlcNAcレベルの増加が直接インスリン抵抗性を引き起こすことが示された。これらのモデル系においては、化学的あるいは遺伝学的にO-GlcNAcレベルを増加させることが、インスリン刺激下でのグルコースの取り込みに関する2型糖尿病の症状を悪化させた43,44。あるPKB/Aktレベルでは高血糖がインスリン抵抗性を引き起こすことを可能にするメカニズムが提供されるが、脂肪細胞培養系において化学的にO-GlcNAcレベルを増加させることにより、そのPKB/Aktレベルにおいてインスリンシグナリング経路が阻害された。加えて、代謝およびグルコース輸送に関与するグリコーゲン合成酵素およびGLUT4のようなタンパク質におけるO-GlcNAc化の増加を示す他の研究45,46は、インスリンシグナリング阻害とグルコース毒性に関しての両方の点から2型糖尿病の病因にO-GlcNAcが密接に関与することを示唆しているかもしれない。
7. おわりに
O-GlcNAcに関する最近の研究成果は、それが極めて重要な翻訳後修飾であることを示している。O-GlcNAc修飾は、多くの細胞活動において重要であると同時に、がん、神経変性疾患および糖尿病といった疾患とも強く関連している。
References
- Kearse KP, Hart GW: Lymphocyte activation induces rapid changes in nuclear and cytoplasmic glycoproteins. Proc. Natl. Acad. Sci. U.S.A. 88, 1701-1705, 1991
- Fang B, Miller MW: Use of galactosyltransferase to assess the biological function of O-linked N-acetyl-d-glucosamine: a potential role for O-GlcNAc during cell division. Exp. Cell Res. 263, 243-253, 2001
- Zachara NE, O’Donnell N, Cheung WD, Mercer JJ, Marth JD, Hart GW: Dynamic O-GlcNAc modification of nucleocytoplasmic poteins in response to stress. A survival response of mammalian cells. J. Biol. Chem. 279, 30133-30142, 2004
- Zachara NE, Cheung WD, Hart GW: Curr. Org. Chem. 8, 369-383, 2004
- Griffith LS, Schmitz B: O-linked N-acetylglucosamine levels in cerebellar neurons respond reciprocally to pertubations of phosphorylation. Eur. J. Biochem. 262, 824-831, 1999
- Chou TY, Hart GW, Dang CV: c-Myc is glycosylated at threonine 58, a known phosphorylation site and a mutational hot spot in lymphomas. J. Biol. Chem. 270, 18961-18965,1995
- Hart GW, Greis KD, Dong LYD, Blomberg MA, Chou TY, Jiang MS, Roquemore EP, Snow DM, Kreppel LK, Cole RN, Comer FI, Arnold CS, Hayes BK:"O-linked N-acetylglucosamine: The 'yin-yang' of Ser/Thr phosphorylation?"Glycoimmunology. Alavi, A., Axford, J.S., eds 1, 115-123, 1995
- Iyer SP, Hart GW: Dynamic nuclear and cytoplasmic: enzymes of O-GlcNAc cycling. Biochemistry, 42, 2493-2499, 2003
- McClain DA, Crook ED: Hexosamines and insulin resistance. Diabetes, 45, 1003-1009, 1996
- Kreppel LK, Hart GW: Regulation of a cytosolic and nuclear O-GlcNAc transferase. Role of the tetratricopeptide repeats. J. Biol. Chem. 274, 32015-32022, 1999
- Lubas WA, Frank DW, Krause M, Hanover JA: O-linked GlcNAc transferase is a conserved nucleocytoplasmic protein containing tetratricopeptide repeats. J. Biol. Chem. 272, 9316-9324, 1997
- Haltiwanger RS, Blomberg MA, Hart GW: Glycosylation of nuclear and cytoplasmic proteins. Purification and characterization of a uridine diphospho-N- acetylglucosamine:polypeptide beta-N-acetylglucosaminyltransferase. J. Biol. Chem. 267, 9005-9013, 1992
- Hanover JA, Yu S, Lubas WB, Shin SH, Ragano-Caracciola M, Kochran J, Love DC: Mitochondrial and nucleocytoplasmic isoforms of O-linked GlcNAc transferase encoded by a single mammalian gene. Arch. Biochem. Biophys. 409, 287-297, 2003
- Love DC, Kochan J, Cathey RL, Shin SH Hanover JA, Kochran J: Mitochondrial and nucleocytoplasmic targeting of O-linked GlcNAc transferase. J. Cell Sci. 116, 647-654, 2003
- Wrabl JO, Grishin NV: Homology between O-linked GlcNAc transferases and proteins of the glycogen phosphorylase superfamily. J. Mol. Biol. 314, 365-374, 2001
- Nolte D, Müler U: Human O-GlcNAc transferase (OGT): genomic structure, analysis of splice variants, fine mapping in Xq13.1. Mamm. Genome. 13, 62-64, 2002
- Shafi R, Iyer SP, Ellies LG, O'Donnell N, Marek KW, Chui D, Hart GW, Marth JD: The O-GlcNAc transferase gene resides on the X chromosome and is essential for embryonic stem cell viability and mouse ontogeny. Proc. Natl. Acad. Sci. U.S.A. 97, 5735-5739 2000
- Kreppel LK, Blomberg MA, Hart GW: Dynamic Glycosylation of nuclear and cytosolic proteins. Cloning and characterization of a unique O-GlcNAc transferase with multiple tetratricopeptide repeats. J. Biol. Chem. 272, 9308-9315, 1997
- Dong DL, Hart GW: Purification and characterization of an O-GlcNAc selective N-acetyl-beta-D-glucosaminidase from rat spleen cytosol. J. Biol. Chem. 269, 19321-19330, 1994
- Comtesse N, Maldener E, Meese E: Identification of a nuclear variant of MGEA5, a cytoplasmic hyaluronidase and a beta-N-acetylglucosaminidase. Biochem. Biophys. Res. Commun. 283, 634-640, 2001
- Gao Y, Wells L, Comer FI, Parker GJ, Hart GW: Dynamic O-glycosylation of nuclear and cytosolic proteins: cloning and characterization of a neutral, cytosolic beta-N-acetylglucosaminidase from human brain. J. Biol. Chem. 276, 9838-9845, 2001
- Schultz J, Pils B: Prediction of structure and functional residues for O-GlcNAcase, a divergent homologue of acetyltransferases. FEBS Lett. 529, 179-182, 2002
- Wells L, Gao Y, Mahoney JA, Vosseller K, Chen C, Rosen A, Hart GW: Dynamic O-glycosylation of nuclear and cytosolic proteins: further characterization of the nucleocytoplasmic beta-N-acetylglucosaminidase, O-GlcNacase. J. Biol. Chem. 277, 1755-1761, 2002
- Pawson T, Nash P: Assembly of cell regulatory systems through protein interaction domains. Science. 300, 445-452, 2003
- Hiromura M, Choi CH, Sabourin NA, Jones H, Bachvarov D, Usheva A: YY1 is regulated by O-linked N-acetylglucosaminylation (O-glcNAcylation). J. Biol. Chem. 278, 14046-14052, 2003
- Glithero A, Tormo J, Haurum JS, Arsequell G, Valencia G, Edwards J, Springer S, Townsend A, Pao YL, Wormald M, Dwek RA, Jones EY, Elliott T: Crystal structures of two H-2Db/glycopeptide complexes suggest a molecular basis for CTL cross-reactivity. Immunity, 10, 63-74, 1999
- Rechsteiner M, Rogers SW: PEST sequences and regulation by proteolysis. Trends Biochem. Sci. 21, 267-271, 1996
- Cheng X, Hart GW: Alternative O-glycosylation/O-phosphorylation of serine-16 in murine estrogen receptor beta: post-translational regulation of turnover and transactivation activity. J. Biol. Chem. 276, 10570-10575, 2001
- Zhang F, Su K, Yang X, Bowe DB, Paterson AJ, Kudlow JE: O-GlcNAc modification is an endogenous inhibitor of the proteosome. Cell. 115, 715-725, 2003
- Gewinner C, Hart GW, Zachara NE, Cole R, Beisenherz-Huss C, Groner B:The coactivator of transcription CREB-binding protein interacts preferentially with the glycosylated form of Stat5. J. Biol. Chem. 279, 3563-3572, 2004
- Roos MD, Su K, Baker JR, Kudlow JE: O glycosylation of an Sp1-derived peptide blocks known Sp1 protein interactions. Mol. Cell Biol. 17, 6472-6480, 1997
- Majumdar G, Harmon A, Candelaria R, Martinez-Hernandez A, Raghow R, Solomon SS: O-glycosylation of Sp1 and transcriptional regulation of the calmodulin gene by insulin and glucagon. Am. J. Physiol. Endocrinol. Metab. 285, E584-E591, 2003
- Kelly WG, Dahmus ME, Hart GW: RNA polymerase II is a glycoprotein. Modification of the COOH-terminal domain by O-GlcNAc. J. Biol. Chem. 268, 10416-10424, 1993
- Kelly WG, Dahmus ME, Hart GW: RNA polymerase II is a glycoprotein. Modification of the COOH-terminal domain by O-GlcNAc. J. Biol. Chem. 268, 10416-10424, 1993
- Kamemura K, Hayes BK, Comer FI, Hart GW: Dynamic interplay between O-glycosylation and O-phosphorylation of nucleocytoplasmic proteins: alternative glycosylation/phosphorylation of THR-58, a known mutational hot spot of c-Myc in lymphomas, is regulated by mitogens. J. Biol. Chem. 277, 19229-19235, 2002
- Slawson C, Pidala J, Potter R: Increased N-acetyl-beta-glucosaminidase activity in primary breast carcinomas corresponds to a decrease in N-acetylglucosaminine containing proteins. Bichim. Biophys. Acta. 1537, 147-157, 2001
- Lefebvre T, Ferreira S, Dupont-Wallois L, Bussiere T, Dupire MJ, Delacourte A, Michalski JC, Caillet-Boudin ML: Evidence of a balance between phosphorylation and O-GlcNAc glycosylation of Tau proteinsムa role in nuclear localization. Bichim. Biophys. Acta. 1619, 167-176, 2003
- Griffith LS, Mathes M, Schmitz B: Beta-amyloid precursor protein is modified with O-linked N-acetylglucosamine. J. Neurosci. Res. 41, 270-278, 1995
- Cole RN, Hart GW: Cytosolic O-glycosylation is abundant in nerve terminals. J. Neurochem. 79, 1080-1089, 2001
- Yao PJ, Coleman PD: Reduction of O-linked N-acetylglucosamine-modified assembly protein-3 in Alzheimer
 s disease. J. Neurosci. 18, 2399-2411, 1998
s disease. J. Neurosci. 18, 2399-2411, 1998
- Retrieved from http://www.who.int/mediacentre/factsheets/fs236/en/
- Marshall S, Bacote V, Traxinger RR: Discovery of a metabolic pathway mediating glucose-induced desensitization of the glucose transport systems. Role of hexosamine biosynthesis in the induction of insulin resistance. J. Biol. Chem. 266, 4706-4712, 1991
- Vosseller K, Wells L, Lane MD, Hart GW: Elevated nucleocytoplasmic glycosylation by O-GlcNAc results on insulin resistance associated with defects in Akt activation in 3T3-L1 adipocytes. Proc. Natl. Acad. Sci. U.S.A. 99, 5313-5318, 2002
- McClain DA, Lubas WA, Cooksey RC, Hazel M, Parker GJ, Love DC, Hanover JA: Altered glycan-dependent signaling induces insulin resistance and hyperleptinemia. Proc. Natl. Acad. Sci. U.S.A. 99, 10695-10699, 2002
- Parker GJ, Lund KC, Taylor RP, McClain DA: Insulin resistance of glycogen synthase mediated by O-linked N-acetylglucosamine. J. Biol. Chem. 278, 10022-10027, 2003
- Buse MG, Robinson KA, Marshall BA, Hresko RC, Mueckler MM: Enhanced O-GlcNAc protein modification is associated with insulin resistance in GLUT1-overexpressing muscles. Am. J. Physiol. Endocrinol. Metab. 283, E241-E250, 2002



