
氏名:浅利 晃
生化学工業株式会社ヒアルロン酸オリゴ糖研究プロジェクトマネージャー。1984年に筑波大学医科学研究科修士課程を修了後、野村生物科学研究所にて超微形態などの研究に従事した。1988年に生化学工業株式会社に入社し、グリコサミノグリカンおよびプロテオグリカンの研究に携わるようなった。1994年に、関節軟骨におけるヒアルロン酸(HA)の局在性をテーマとする論文により、筑波大学より医学博士号を授与された。現在は、HAオリゴ糖の細胞生物学的・生化学的解析に従事しており、HA4糖がストレス状態においてheat shock protein 72発現を増強し細胞死を抑制することを見いだしている。
今日、ヒアルロン酸科学に携わる多くの研究者が、生物学的・生化学的研究においてHAオリゴ糖(分子量 約200〜10,000)を使用している。この分野における最初の研究は、1974 年にHascallおよびHeinegård1によって報告されている。彼らは、生化学的手法を用いて、アグリカンに結合する最小のHAは10糖、すなわち(GlcUA-GlcNAc)5であることを示した。多くのHA結合蛋白や受容体が見つかっているが2、これらに結合する最小のHAオリゴ糖のサイズを明らかにすることは重要である。また、HAオリゴ糖は、内因性HAのHA結合蛋白への結合を阻止する3,4,(de la Motte, 私信)ことからも、研究上重要なツールとなる。
Nobleらのグループは、HA断片(低分子HAとも呼ばれている)が、炎症および細胞外基質破壊に関与するサイトカインやケモカインなどを誘導することを報告した5,6,7。 また、低分子HAに血管新生作用があることは、周知のところである8。 一方、高分子HAは、血管新生、炎症性サイトカインおよびMMPの産生、ならびにNF-kappa B の活性化を抑制することが報告されている9-13。したがって、HAは、分子量依存的にその生理活性を変えている、と言うことができる (Figure 1)。
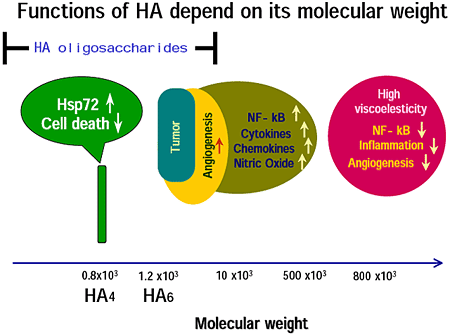
Fig.1
この総説では、10kDa から500kDa のHAを低分子HAと呼ぶことにする。HAオリゴ糖研究は、その低分子HA研究にひきつづいて登場した。HAオリゴ糖が示す、いくつかの生理活性は、低分子HAにおいても認められる。しかしながら、HAオリゴ糖には、低分子HAにも高分子HAにも認められない新規の生理活性がある。したがって、この点からも、HAは、GlcA-GlcNAc という2糖を単位とした、枝分かれのない単純な繰り返し構造であるにもかかわらず、分子量によって自らの生理活性を変化させている、と言えよう。さらにこのことは、HAとその受容体との関係を説明するモデルを想起させる。すなわち高分子HAはHA受容体を細胞表面に集めてcappingという現象を起こすが、低分子HAではcapping が生じないか、小さなレベルにとどまる。HAオリゴ糖の場合は、一分子のHAオリゴ糖は、1〜2個のHA受容体にしか結合できない(たとえば4糖か6糖のHA分子は一分子のHA受容体としか結合することができない)。ひとつのリガンドがひとつの受容体に結合した場合、どのようにして細胞内にシグナル伝達が生じるのか、という質問に対する答えは、多くの研究者が知りたいところである。HAオリゴ糖の新規機能(生理活性)については、前述したHA受容体のcappingモデルではない、新たなモデルが必要かもしれない。もし、HA受容体が、小さなくぼみの底のような構造をしているとすれば、そこに高分子HAは結合できないけれども、HAオリゴ糖は結合することができる(Day AJ, 私信)。そのような受容体は、おそらく、ある特定の分子サイズのHAオリゴ糖に特異的であると考えられる。
1.ヒアルロン酸分析
酵素による2糖への分解は、high performance liquid chromatography (HPLC) やFluorophore-assisted carbohydrate electrophoresis (FACE)によるHA分析には必須である。私たちは、ヒトおよびウサギの関節軟骨組織において、ビオチン化HA結合蛋白を用いた組織化学的手法により、詳細なHAの局在性を報告した14,15。 この研究において、HPLCによるHA2糖の測定は、HA濃度に層(表層・中間層・深層)による違いがあることを示し、組織化学的局在性との一致を見た。また、この2糖分析は、関節症患者の関節液におけるHA量の分析に有用である。外傷性関節症患者における関節液貯留は、HPLC分析(HA2糖測定)で測定したHA量と相関性を示した16。
Calabroらによってあみ出されたFACE(前述)という測定手法17,18は、HPLCのような高価な装置を必要としない簡便な分析法である。FACE法は、HAの定量および定性の両方を一度におこなうことができる画期的手法であることから、将来、通常のHA分析法として発達・定着する可能性がある。私たちも、HAオリゴ糖ライブラリーをFACE法によって分析している19.20。
2.HA受容体とHA結合蛋白 (Table 1)
HAオリゴ糖ライブラリーは、HA受容体あるいはHA結合蛋白に結合するHAの最小サイズを決定すること(Table 1)、 および、種々分子サイズのHAオリゴ糖が誘導する多様なシグナル伝達の解明に有用である。
Table 1

HA4糖は、ストレス状態下においてHeat shock protein 72 発現を増強し細胞死を抑制するが、他の分子サイズのHAには、そのような活性は認められていない21。HA4糖は、K562細胞に添加すると、細胞質に取り込まれるが(Asari A, 未発表)、そのメカニズムについては、不明である。おそらくは、細胞表面にHA4糖に対する受容体があるものと思われる。K562細胞は、CD44陰性細胞として知られているが、RHAMMのmRNAは発現している。しかしながら、HA2糖、6糖、8糖は、Hsp72発現を増強しないし、細胞死抑制もしないことから、他の分子サイズのHAを認識しないHA4糖特異的な受容体の存在を想定しなければならない。
スタンダードタイプのCD44 (CD44s)、たとえば軟骨細胞のCD44は、HA6糖に結合するが、表皮細胞のCD44、すなわち上皮型CD44(CD44E)が結合する最小のHAオリゴ糖は10糖である。CD44は、免疫系における多くの種類の白血球に発現している。CD44発現にしたがって、リンパ球はサブクラスに分類される。de la Motte は、HA6糖が、U937(単球)のHAケーブル(HA、インターαトリプシンインヒビター[ITI]の重鎖[HC;Serum-derived Hyaluronan-Associated Proteins: SHAPとも呼ばれる]、およびTSG-6からなる複合体。ケーブル状を呈している)への結合を阻害することを見いだしている(de la Motte, 私信)。この結合阻害は、HA4糖には認められない(de la Motte, 私信)。また、今のところ、他の種類の白血球に結合する最小のHAの分子サイズについては、まだ、知られていない。
Mukhopadhyayらは、ITIから重鎖が離脱して、8糖以上の大きさのHAオリゴ糖に乗りかえることを見いだしている22。また、彼らは、同様のサイズのHAオリゴ糖が、cumulus cell-oocyte complex (COC)の形成を阻害することも見いだしている22。 Yonedaらも、8糖以上の大きさのHAオリゴ糖が、SHAPのHAとの結合を競合的に阻害することを見いだしている23。
Mukhopadhyayらは、tumor necrosis factor-induced protein 6 (TSG-6)は、ITIのHCからHAへの乗りかえを媒介することを示した22。一方、Zhuoらの報告24によると、bikunin (ITIの構成要素)はHCのHAへの乗りかえに必要であるが、bikuninが「SHAP提示分子」であるということまでは言及できないという。HAのN-acetylglucosamineは、HCのアスパラギン酸のカルボキシル基とエステル結合によって結びつけられている25。ところが、ITI以外のHA結合蛋白は、非共有結合によってHAと結合することが知られている。ITI、TSG-6、versicanおよび 白血球のCD44 がHA複合体の形成に関与している。HAオリゴ糖は、近い将来、この複合体の構造をさらに解明する有用な道具となるにちがいない。
以下のHA結合蛋白(HABP)が結合するHAの最小分子サイズはまだ、不明である: 1) 細胞外HABP: neurocan, brevican, いくつかの link proteins, spacrcan および SPACR; 2) HA 受容体: RHAMM, Lyve-1, LEC/HARE (liver sinusoidal endothelial cell, hyaluronic acid receptor for endocytosis), layilin; 3) 細胞内HABP: cdc37, P-32, RHAMM, IHABP4; 4) 血清 HABP: PHABP (plasma hyaluronan binding protein).
3.HAの重合
HAオリゴ糖は、HA合成酵素(HASs)によるHA重合において、出発材料あるいはacceptor(最初に基質が結合する足場となる)として使用される。リコンビナントの大腸菌由来のpmHASに精巣ヒアルロニダーゼの分解産物であるHA4糖を添加すると、HA4糖を加えない場合に比べ20〜60倍の効率でUDP-[14C]GlcUAのラベルが高分子HAに取り込まれる26。
4. 新たに見いだされた生理活性 (Table 2)
生体内の内因性HAが炎症あるいは癌の組織において分解されると、低分子HAあるいはある分子サイズのHAオリゴ糖は、サイトカイン、ケモカインおよびMMPなどの誘導を介して、炎症、細胞の浸潤・移動および細胞外基質分解を亢進させる。したがって、分解されたHAについては、その分子サイズが重要な意味を持つ。また、HAオリゴ糖は、炎症および癌の進行においては、血管新生誘導物質としてはたらくことが報告されている。HAオリゴ糖は、炎症および癌においてはその悪循環の一要因となっている。
上記のような現象は、少なくとも、HAは、「オリゴ糖に低分子化されると、新たな機能・活性を獲得する」ということを示している。そのようなHAオリゴ糖は、高分子HAが認識できない特異的な蛋白を認識する可能性が推察される。
Table 2

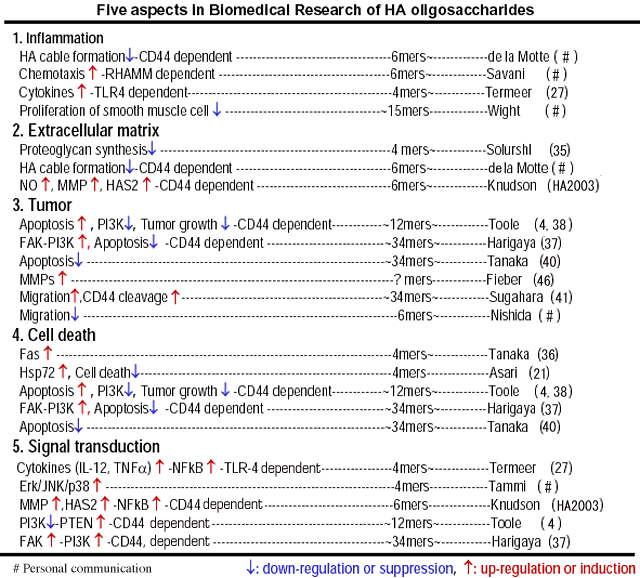
HAオリゴ糖に関する報告は、Table3に示したように5つの観点によって分類することができる。
Table 3
1. 炎症
Termeerらは、HA 4糖および6糖の混合物がヒト単球由来樹状細胞の成熟を誘導することを見いだしている19。この作用は、中間的分子量(MW 80, 000-200,000や高分子 (MW 1,000,000-600,000) のHAには認められないという19。また、彼らは、HAオリゴ糖がtoll-like receptor 4を介して樹状細胞を活性化することも示しており27、炎症において、樹状細胞にHAオリゴ糖が作用することにより、樹状細胞が成熟すると考察している。この現象は、炎症という観点において、低分子HAによって引き起こされる現象とオーバーラップする5,28,29。Termeerらの研究において使用されているHAオリゴ糖の濃度は、20μg/mlである。そのような高濃度のHAオリゴ糖が、炎症の場において産生され、存在するのか、議論のあるところである。
de la Motteは、poly I:C(擬似ウイルスとして使用している)によって誘導されるHAケーブルへのU937(単球/マクロファージ)の接着を、HAオリゴ糖が抑制することを示した (de la Motte, 私信)。そのpoly I:C 誘導HAケーブルは炎症性疾患、たとえば、炎症性腸炎におけるHAを含む細胞外基質とよく似ている30,31。 そのU937のHAケーブルへの接着を阻害する最小のHAオリゴ糖はHA6糖であった (de la Motte, 私信)。これは、HA6糖が軟骨細胞に結合する最小のHAであるというKnudsonらの報告と一致する32。
未刺激のU937は、CD44を細胞表面に発現しているものの、何らかの分子によって修飾されていないナイーブなHAには結合せず (Asari A, 未発表)、HAケーブルには結合する。言い換えると、U937は、HAケーブルをより好むということになる (de la Motte, 私信)。 SHAPすなわちITIの重鎖(HC)の存在下では、CD44のHAへの結合が増強される(Zhuo L, 私信)。一方、de la Motteは、versican のG3ドメインを認識する抗体がU937のHAケーブルへの結合を阻害することを見いだしている(私信)。以上のことは、versican あるいは SHAPは、U937のCD44を介したHAへの結合を惹起していることを示唆している。また、GlcUAbeta1/IdoUAalpHA1-3GalNAc(4,6-O-disulfate)を含む過剰に硫酸化されたコンドロイチン/デルマタン硫酸(おそらくversicanに含まれる)は、U937の細胞表面に発現しているL-セレクチン およびP-セレクチンに結合する33、との報告は、上記の現象に関連があると考えられる。
Savaniは、6糖から900 kDaまでのどのサイズのHAにも走化性があることを見いだしている (私信)。 その走化性は、モノクローナル抗RHAMM抗体によって抑制されたことから、RHAMM依存性であることが示されている。
癌あるいは炎症組織においては、HAはフリーラジカルあるいはヒアルロニダーゼによって分解を受ける。そのようにしてできた低分子HAには血管新生作用8、サイトカイン、ケモカインおよびMMPを誘導する作用28,34がある。癌や炎症組織において生じたHAオリゴ糖は、さらに、その走化性によって炎症性細胞を組織内に呼び込むものと考えられる。すなわち、HAオリゴ糖の走化性は、さらに炎症を増悪させることになる。HAオリゴ糖において発見されている多くの新規生理活性は、炎症および細胞外基質分解に関与している。したがって、その場合、毒素、蛋白、核酸などの汚染・混入については、厳密にチェックし、論文にもその結果が記載されなければならない。HAオリゴ糖の調製においてもクオリティーコントロールがなされる必要がある。In vivoのみならずin vitro細胞生物学的実験においても、HAオリゴ糖を使用する場合には、試料へのいかなる汚染・混入も避けなければならない。
2. 細胞外基質
de la Motteは、poly I:Cによって平滑筋細胞に誘導されるHAケーブルの形成が、HAオリゴ糖処理により分子サイズ依存的に抑制されることを見出している (私信)。 この場合、HA4糖は全く作用せず、HA6糖は軽度にのみ抑制作用を示している。HAケーブルは、ITIの重鎖(HC)とversicanからなる。HCおよびversicanに結合する最小のHAは、それぞれ8糖および10糖である(Day AJ, 私信)ことから、なぜHA6糖がHAケーブル形成を抑制するのか、解明される必要がある。
Knudsonらは、250μg/mlという高濃度ではあるが、HA6糖が軟骨からのプロテオグリカン消失を誘導することを見いだした (*)。彼らは、また、HA6糖が、軟骨細胞において、レチノイン酸受容体(RXR)の活性化を介してMMP13およびMMP3のmRNA発現を増強すること、およびSp1を活性化させることによって2型コラーゲンとcartilage oligomeric matrix protein (COMP) のmRNA発現を増強することも見いだしている (*)。 このことは、HA6糖が、軟骨基質の分解と合成の両方の活性を有していることを示している。近い将来には、最大でどのくらいの分子サイズのHAがこの活性を示すのか、そして250μg/ml以上の濃度のHA6糖は、はたして関節症患者の軟骨に存在するものなのか、明らかにされると思われる。
Knusdonらによると HA4糖は軟骨からのプロテオグリカン消失を誘導しない (*)。一方、Solurshらは、4糖以上のサイズのHAあるいは高分子HAがニワトリ胚の軟骨細胞におけるプロテオグリカン合成を抑制することを示している35これは、HA4糖に細胞生物学的活性があることを示した最初の報告である。私たちは、HA4糖がheat shock protein 72発現を増強することを見いだしている21。Tanakaらは、4糖以上の大きさのHAオリゴ糖がリウマチ患者の滑膜細胞においてFas発現を増強することを示している36。また、Dattaらは、HABP1が4糖以上の大きさのHAに結合することを見いだしている (*)。しかし、HA2糖の活性に関する報告はまだ存在しない。
3. 癌 (Table 4)
HArigayaらは、32 kDaのHAがある種の癌細胞のCD44に結合すると、チロシンリン酸化およびfocal adhesion kinase (FAK) (これらの分子はphospHAtidylinositol 3-kinase (PI3K)との関係がある)の活性化を引き起こすことを報告した37。また、彼らは、32 kDaのHAによるチロシンリン酸化作用は、3,220 kDa あるいは 950 kDa のHAよりも強いこと、ならびにPI3K阻害剤であるLY294002が、etoposide存在下で癌細胞にアポトーシスを誘導することを示した。こられのことは、HAが薬剤が誘導するアポトーシスに対し耐性をもたらすことを示唆している。
Table 4

以上のこととは反対に、Tooleらは、HA オリゴ糖 (12糖を中心とした混合物)が、内因性HAと癌細胞CD44との結合を解離させることによって、乳癌の成長を抑制すること(in vivo)38 、およびにPI3K発現を抑制しアポトーシスを引き起こすこと(in vitro)4を示した。
また、Tooleらは、HAオリゴ糖が、薬剤耐性をもつ癌細胞においてMAP kinase と phosphoinositide 3-kinaseの両方のシグナルを抑制し、種々化学療法剤に対する感受性を上げることを示した39。さらに彼らは、HA産生が増加すると、薬剤感受性のある癌細胞に耐性が誘導されることをも示している。これは、Harigayaらの観察37とは異なっている現象である。両者の研究の間には、培養条件、細胞のタイプ、用いているHAの分子サイズに違いがある (Table 4)。
Tanakaらは、HAオリゴ糖が癌細胞においてFas発現を低下させることを示している40。これは、HAオリゴ糖がFas発現低下を介して癌の生存に関与していること示唆する。
Sugaharaらは、細胞表面からのCD44の蛋白分解による切断が癌細胞の移動において重要な役割を持っていることを示した41。その研究においては、HAオリゴ糖(6糖〜36糖)がCD44と結合し、CD44の切断をもたらすが、高分子HAにはそのような作用はないことが示されている。また、HA 36糖は、CD44を切断するばかりでなく、癌細胞の移動を促進させることも示されている。彼らは、HAオリゴ糖(いくつかの種類の癌組織において生じていることが知らている)は、CD44切断により癌細胞移動を増強し癌浸潤を促進させる、と考察している。
癌組織においては、HAおよびヒアルロニダーゼ産生、ならびにCD44発現が活発である42,43。HAオリゴ糖あるいは低分子HA(これらは、ヒアルロニダーゼによるHAの分解によって生じていると考えられる)は、癌組織に存在していることが知られている44。また、他の報告では、HAオリゴ糖あるいは低分子HAには血管新生作用があること45、およびサイトカインやケモカイン27ならびにMMP(癌転移増強作用がある)46の誘導能があることが示されている。これらのことは、Sugahara らの観察と一致すると思われる。HAオリゴ糖によってもたらされる血管新生は、癌の成長を強める可能性がある。しかし、一方、サイトカインやケモカインは、癌免疫を強める要因として機能するかもしれない。したがって、in vivoにおけるHAオリゴ糖の癌進行に対する影響を推測することはたいへん難しい。HAオリゴ糖の癌の成長および浸潤に対する作用は、培養条件が足場依存的か否かということ、および癌細胞のタイプに依存しているようである。上記のような、一見、相対する結果をとりまとめるには、さらなる研究を必要とする。
4. 細胞死
田中らは、リウマチ患者由来の滑膜細胞において、抗体でCD44を架橋するとFas発現およびそれにつづくアポトーシス誘導が増強することを示している37。 HA断片も同様にFasによる初期のアポトーシス誘導を強めた、という。彼らは、その研究において、HA断片として、34糖および4糖のHAを使用している。一方、リウマチ患者の関節液のHAの分子量は減少しており、HA断片がその中に含まれていることが報告されている47。また、リウマチ患者の滑膜細胞ではアポトーシスが起きていることも知られている48。 これらのことから、リウマチ患者においては、関節液に生じるHA断片は滑膜細胞のFas発現を増強することによってアポトーシスを誘導している可能性が考えられる。
以上のこととは反対に、田中ら(前出)は、同じHA断片が、癌細胞ではFas発現を低下させることを示した40。 これは、癌細胞に対する細胞障害性T細胞のFasリガンドの作用が低下することを示唆している。この場合は、HA断片が、血管新生作用とならんで、Fas発現低下作用によっても、癌の生存を促している、ということになる45。
私たちのグループは、HA4糖が、ストレス状態下において、Hsp72の発現を増強し、細胞死を抑制することを見いだした21。 その研究では、HA4糖でK562を処理すると、熱によるHsp72発現が増強することを観察している。一方、他の分子サイズのHA(2, 6, 10, 12 mers, 840 kDa)やケラタン硫酸およびコンドロイチンの4糖ではHsp72発現に影響は見られなかった。熱を与えた上で、HA4糖で処理すると、HA4糖を添加しない場合に比べ、Hsp72は、蛋白およびmRNAレベルで発現増強があり、その転写因子であるHSF1の活性化にも増強が認められた。K562細胞を37度で培養し、ストレスを与えない場合は、HA4糖で処理しても、Hsp72蛋白発現に影響は認められなかった。このことは、HA4糖がストレスを与える因子ではないことを示している。また、HA4糖は、熱によるK562の細胞死および血清飢餓によるPC12の細胞死を抑制した。以上のことは、ある特定のサイズのオリゴ糖、すなわちHA4糖が、ストレス状態下においてHSF1活性化を増強することによりHsp72発現を亢進させ、細胞死を抑制する作用を有していることを示している。
5. シグナル伝達および蛋白発現誘導
Termeerらは、HA4および6糖が、ヒト単球由来の樹状細胞の成熟を促進し19、それが、toll-like receptor 4を介していることを示した27。彼らが使用したHAオリゴ糖のサイズは4-16糖である。Knudsonらは、HA6糖に軟骨細胞におけるNF- kappa Bの活性化を誘導することを見いだしている(私信)。その活性はHA4糖には認められないという。 Termeerらも、HAオリゴ糖がNF-kappa Bを活性化することをみいだしている27。TLR-4に結合し樹状細胞を活性化するHAの最小サイズが、近い将来、明らかになると思われる。
Tammiらは、HA4糖が 表皮細胞においてErk/JNK/p38 の蛋白発現を活性化することを見いだしている(私信)。
Tooleらは、癌細胞をHAオリゴ糖で処理すると、PTEN (phosphatase and tensin homologue deleted on chromosome 10)が誘導され、細胞死抑制にはたらくPI3Kの発現が低下することを見いだした4。 結果として、HAオリゴ糖は、癌細胞に細胞死(アポトーシス)をもたらす。乳癌細胞はHAを産生するが、そのHAは、細胞表面上のCD44に結合しPI3K誘導を介してアポトーシスを抑制する。HAオリゴ糖は、内因性HAとCD44の間の結合を解離させることにより内因性HAからのシグナルを阻止するものと思われる。また、その解離自体がPTENを誘導するか、そうでなければHAオリゴ糖がPTENを誘導するのかもしれない。このことは、内因性HAにコートされていないCD44陽性癌細胞を使えば証明できると思われる。その解離モデルでは、細胞表面の内因性HAが外因性のHAオリゴ糖に置き換わる、ということになっている。HAオリゴ糖は、内因性HAを剥がしてCD44に結合するのではなく、新たに細胞表面に発現したCD44に結合することも考えられる。この可能性を検証するには、蛍光標識したHAオリゴ糖が有用である。また、もしHAオリゴ糖が内因性HAを剥がすとすれば、高分子HAが培地内に放出されるはずである。したがって、その剥がれた内因性HAを検出・測定することは、詳細な機序を明らかにする一助となる。
HA結合蛋白には細胞外に認められるものと細胞内に存在するものがある。HAは細胞内にも存在するので、細胞内HA結合蛋白、たとえば、HABP149 は、細胞質においてHAと結合しているかもしれない。そのような細胞内HAは、なんらかの細胞内シグナル伝達50、細胞分裂・増殖51,52などに関与していると考えられている。EvankoおよびWightは、 外因性HAオリゴ糖が細胞質に入り網状を呈することを見いだしている52。外因性の高分子HAは、エンドゾームあるいはファゴゾーム様の空胞構造に取り込まれる。すなわち、HAオリゴ糖と高分子HAでは、細胞内の局在性がことなる。このことは、HAオリゴ糖が分解経路にとりこまれず、細胞内HA結合蛋白に結合する可能性を示している。Datta は、HABP1が4糖以上のHAに結合することを見いだしている (*)。
細胞内HAの機能も、また、分子サイズに依存しているかもしれない。細胞内HAとHA結合蛋白の役割を明らかにすることが、次世代のHA研究の目的のひとつとなるであろう。