
氏名:浅利 晃
生化学工業株式会社東京研究所探索グループマネージャー。1984年に筑波大学医科学研究科修士課程を修了後、野村生物科学研究所にて超微形態などの研究に従事した。1988年に生化学工業株式会社に入社し、グリコサミノグリカンおよびプロテオグリカンの研究に携わるようなった。 1994年に、関節軟骨におけるヒアルロン酸の局在性をテーマとする論文により、筑波大学より医学博士号を授与された。その後は、滑膜や角膜におけるヒアルロン酸およびCD44の局在および動態に関する研究を行ってきたが、最近は、ヒアルロン酸の示す細胞内シグナルを介した細胞生物学的な作用について興味を抱いている。

氏名:宮内 聡
生化学工業株式会社東京研究所生物科学研究室、室長。1981年に新潟大学農学研究科を修了後、生化学工業株式会社に入社した。入社以来、主に眼科手術に適応されるヒアルロン酸ナトリウムの研究、開発に従事し、1987年に学位を取得した。最近は各種のグリコサミノグリカン(GAG)の医薬品応用に関する生物試験をマネージしている。
ヒアルロン酸は、生体成分としては極めて高い保水能力や粘弾性を示すことで知られている。生体内におけるヒアルロン酸の役割を示唆するこの性質は、また、ヒアルロン酸を様々な応用へと導いてきた。その応用例は、実は、すでに生活の中で身近なところに認められる。すなわち、ヒアルロン酸は、その水分を豊富に湛える性質から、皮膚の乾燥を防ぎ、みずみずしい肌を保つ目的で化粧品などのスキンケア商品に配合されている。元来、皮膚はヒアルロン酸の豊富な組織であるa が、ヒアルロン酸は加齢とともに低分子化し、保水能力が減弱していくことが知られている。皮膚においてヒアルロン酸を豊潤に保つことは皮膚の老化防止を意味するかもしれない。
ヒアルロン酸の応用は、化粧品だけでなく様々な分野において試みられている。ヒアルロン酸に関する特許は、全世界でこれまでに約1300件にのぼる。しかし、その中で、実際に医療に応用した例はそれほど多くはない。本稿ではヒアルロン酸の医療への応用・事業化に成功した事例である変形性関節症適用および眼科領域における眼科手術補助剤としての応用例等を取り上げ、その作用本態に迫ってみたい。
a このシリーズのTammiの総説を参照
変形性関節症適用のヒアルロン酸ナトリウム(NaHA)は、ヒアルロン酸の医療への応用として、最も成功した例のひとつである。Balazs1の発案によるこの応用は、日本、イタリア、カナダなどで実施に移され、多くの患者を治療してきた。1987年日本では最初のNaHAが上市され、現在までに約25品目の変形性関節症適用のNaHAが販売されている。1998年には、日本国内だけで約1400万本のNaHAが使用され、およそ200万人の患者に投与された。変形性関節症に対するNaHAの作用としては、軟骨変性抑制、プロテオグリカンの軟骨基質外遊出抑制、軟骨表層被覆保護2,3、関節液正常化4、関節可動域の改善および疼痛抑制5,6などが知られている。しかし、その作用機序は、未だ十分に解き明かされていない。また、ヒアルロン酸は広範な分子量分布を有するが、その平均分子量は医薬品メーカーごとに異なっている状況にある(表1)。 これらNaHAにおいてどの分子量が適切なのかということについては、諸々の説がある。未だこれについては統一見解が得られていないが、我々の研究結果を含めて、これまでの動物実験等でのヒアルロン酸の分子量に関する結果を示しながら、作用機序について考察してみたい。
表1a 変形性関節症に適用されているヒアルロン酸ナトリウム
| 商品名 | 分子量* | 供給元 |
| アルツ |
600,000-1,200,000 | 生化学工業(株) (日本) |
| Hyalgan |
500,000-730,000 | Fidia (イタリア) |
| Synvisc |
mildly cross-linked HA | Biomatrix (米国) |
表1b 眼科手術に使用されているヒアルロン酸ナトリウム
| 商品名 | 分子量* | 供給元 |
| オペガン |
600,000-1,200,000 | 生化学工業(株) (日本) |
| オペガン-ハイ |
1,900,000-3,900,000 | 生化学工業(株) (日本) |
| Healon |
1,900,000-3,900,000 | Pharmacia, Upjohn (スゥエーデン) |
| オペリード |
1,530,000-2,130,000 | 資生堂 (日本) |
a. NaHAの物性と軟骨保護作用
ヒアルロン酸はグルクロン酸とN-アセチルグルコサミンの2糖を最小単位とする糖質である。多糖としてのヒアルロン酸は、一本鎖構造を呈し、でんぷんやグリコーゲンのように枝分かれ構造をとらない。しかし、ヒアルロン酸にはところどころに疎水結合があって、電子顕微鏡で観察すると蜂の巣様の構造を呈していることが報告されているb。ヒアルロン酸が分子量に依存して粘弾性を増すのは、このような分子構造のためと考えられている。長い間、生体内におけるヒアルロン酸の役割とは、間質に粘弾性あるいは粘ちょう性といった物性を与えることであると考えられてきた。このようなことから、ヒアルロン酸を変形性関節症に適用させる場合にあっても、より高分子のヒアルロン酸の方が優れた効果を示すのではないかと考えられていた。すなわち、関節内組織に対する物理的保護(衝撃緩和)効果は、ヒアルロン酸の分子サイズが大きいほど、優れているというものである。正常の関節液中のヒアルロン酸の平均分子量は、報告によりばらつきがあり、200万〜700万7,8と言われている。市販製剤にはこの分子量の範囲内に入るものと、これ以下のものがある(表1)。変形性関節症の実験モデルであるウサギ前十字靱帯切除モデルに平均分子量90万あるいは200万のNaHAを投与し、その軟骨損傷に対する作用を評価したところ、平均分子量200万のNaHAの方が平均分子量90万に比べ軟骨損傷面積が少なかったことが報告されている9。ところが、Ghoshらは、ヒツジ半月板切除モデルで、同様の2種類の分子サイズのNaHAを用いてこれとは全く逆の結果を示しており10、ヒアルロン酸の軟骨における効果の分子量依存性は、報告により異なっている。この問題については、後のセクション(c.NaHAの細胞生理活性)でも考察を加える。
b このシリーズのScottの総説を参照
b. NaHAの分子量と滑膜炎抑制作用
我々は、イヌ前十字靱帯切除モデル(滑膜炎モデル;軟骨損傷は認められない初期変形性関節症あるいは外傷性関節炎のモデル)を用いて、平均分子量230万(HA230)と84万(HA84)のNaHAの作用を比較した4。このモデルでは関節液貯留および滑膜細胞増殖・変性等が認められたが、HA84がHA230に比べ顕著な抑制効果を示した(図1)。
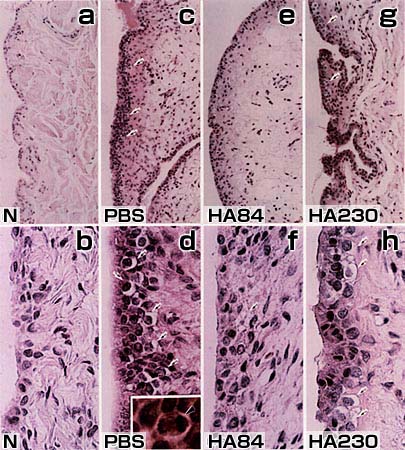
図 1 HA84とHA230のACLTモデル滑膜炎に対する作用の違い(ヘマトキシリン・エオジン染色)
HA84、HA230およびPBSは、前十字靱帯切除術から4週間経過後より投与した(1回/週、5回)。滑膜組織は最終投与から1週間後に採取した。PBS投与群では有糸分裂像(矢頭)が認められた(d,inset)。
a. b:無処置対照群、c,d:PBS投与群、e,f::HA84投与群、g,h:HA230投与群
矢印:空胞変性
倍率: a, c, e, g: x150; b, d, f, h: x580; d inset: x1,500
この実験では、最終投与時に蛍光標識NaHAを投与し、最終投与から1週間後の滑膜における、それらの局在性を共焦点レーザー顕微鏡にて観察した。その結果、 HA84投与群では、顆粒状の蛍光像が滑膜組織中に散在していたが、HA230投与群ではほとんど検出できなかった(図2)。
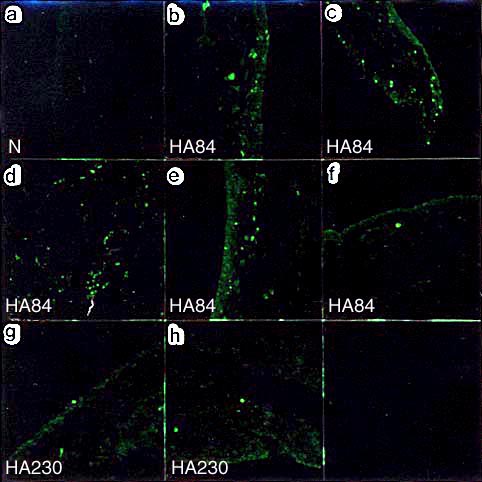
図 2 滑膜組織における蛍光標識したヒアルロン酸の分布
無処置対照群では蛍光は検出されない(a)。HA84投与群では、6例中5例に滑膜組織内に散在する蛍光が検出された(b-f)。HA230投与群では、6例中2例において2-3個の蛍光を呈する顆粒が検出されるのみであった(g,h)。
このことは、HA84の方がHA230に比べ組織保持性が高いことを推測させる。またHA230は単にその大きなサイズのため、あるいは分子どうしの絡み合いによりさらに巨大化しているため11、HA84に比べ組織に浸透しにくいことから、HA84の方がHA230に比べて滑膜細胞へのaccessibilityが高いことも考えられる (図3)。
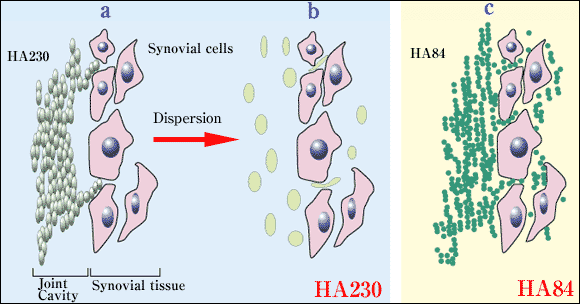
図 3 (仮説2)分子量の異なる2つのヒアルロン製剤の滑膜組織内への浸透
a,b: HA230の滑膜組織への浸透。投与直後は、HA230は塊(分子の絡み合いによって形成される)となっているので細胞間隙に進入していくことができない(a)。1分子(緑色の楕円)だけでも大きすぎることから、進入できないことも考えられる (a)。拡散後は、柔軟性が生じ、細胞間隙に進入していくことができるようになることが推測される(b)。
c: HA84の滑膜組織への浸透。投与後、HA84は分子サイズが小さいため容易に細胞間隙を通過し、高濃度のまま、滑膜組織内に早く浸透し、多くの分子が細胞にaccessできる。
変形性関節症、慢性関節リウマチおよび外傷性関節炎では滑膜細胞においてプロスタグランディンE2産生が亢進していることおよび滑膜細胞が増殖していることが知られている。滑膜細胞培養系の培地にNaHAを添加すると、そのプロスタグランディンE2(PGE2)産生および細胞増殖が分子量依存的に抑制されることが報告されている。ところが、前述のイヌ前十字靱帯切除モデルにおいては、HA230に比べHA84のNaHAの方がPGE2産生および滑膜細胞増殖をより顕著に抑制していた4。また、清水らの報告においても、変形性関節症モデルであるウサギ前十字靱帯切除モデルにおいては、平均分子量360万のNaHA(HA360)は90万のNaHA(HA90)に対して優位な効果を示していない12。滑膜細胞増殖がHA90投与群では抑制されていたが、 HA360投与群ではほとんど抑制がされなかったという。これらのことは、in vitro実験において認められているNaHAの作用の分子量依存性が、in vivoでは逆転していることを示している。そして、このことも、滑膜組織におけるHAのaccessibilityが分子量とは逆相関であることにより説明が可能である。in vitro系では、同じ濃度であっても分子量の大きいNaHAの方がより強いPGE2産生抑制あるいは増殖抑制作用を示す(前述)。ところが、in vivo組織レベルでは、より低い分子量のNaHAの方が、細胞へのaccessibilityが高いため、その細胞に対する作用もより強くなることが推察さる(図3)。ブラジキニンによるラット膝関節疼痛モデルにおいて、関節内投与した平均分子量90万のNaHAが、230万のそれに比べ疼痛反応を顕著に抑制したとの報告13 も、in vivoでは分子量の小さいNaHAの方が組織への浸透性が高いことを示しているものと考えられる。
c. NaHAの細胞生物学的活性
Fukudaらは、 IL-1β誘導によるウシ関節軟骨細胞における活性酸素産生およびプロテオグリカン合成低下がNaHAにより抑制されることを報告している2。また、Homandbergらは、fibronectin fragmentsが媒介するプロテオグリカン合成抑制および軟骨破壊が、HA90により阻止されること、ならびにその軟骨破壊後の回復をHA90が促進することを示した14。
一方、滑膜に対するNaHAの薬理作用については、上記(b)で示したPGE2産生抑制以外には以下の報告がある。Takeshitaらは、NaHAが滑膜細胞におけるIL-1βの産生を抑制することを示した15。また、Takahashiらの報告によると、ウサギ前十字靱帯切除モデルにおいて滑膜および軟骨組織のMMP-3およびIL-1β発現に対するHA90の作用を検討したところ、滑膜組織でのみ、それらの発現抑制作用が見られたという16。しかしながら、この実験では軟骨組織損傷抑制も認められていることから、この実験におけるHA90の軟骨に対する作用は、滑膜組織における上記パラメーターの抑制を介していることが推察される。
以下に、PGE2産生抑制にもとづくNaHAの関節症への効果について、考察を展開してみる。まず、PGE2が関与していることが知られている血管透過性亢進は、NaHAのPGE2産生抑制作用を介して抑制される。そして、血管透過性が正常に復すると、血漿成分の関節腔への流入が沈静化し、低下していた関節液のヒアルロン酸濃度が上昇・回復する(投与したNaHAも関節液のヒアルロン酸濃度上昇に寄与する)。結果として、関節液のviscoelasticityが回復し、軟骨への力学的負荷が軽減されるものと考えられる (図4)。
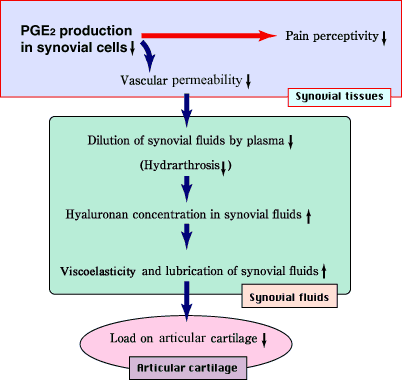
図 4 滑膜細胞におけるPGE2産生抑制作用を基にして説明されるヒアルロン酸の変形性関節症への作用メカニズム(仮説)
PGE2は痛みの閾値を低下させる作用も有することから、NaHAの投与による疼痛緩和5も、そのPGE2産生抑制作用によって説明することができる (図4)。外傷性関節炎においては、ヒアルロン酸産生亢進(滑膜細胞活性化によると考えられる)と血管透過性亢進があいまって起きる水(血漿)の呼び込み(HAは産生されては希釈を受ける)、すなわち関節液貯留、関節液ヒアルロン酸濃度の低下=関節液粘弾性の低下および軟骨損傷からなる悪循環が生じている17。このような悪循環のうち滑膜の関与する経路を断ち切ることにより、軟骨損傷が抑制される可能性も考えられる。
前述のイヌ前十字靱帯切除モデルにおいては、滑膜細胞に空胞変性が認められたが、この変化がHA84の投与により抑制されていた4。滑膜組織において熱ショック蛋白の一種であるHsp72を免疫組織化学的に検討したところ、HA84投与群でHsp72発現が亢進していることが判明した4。熱ショック蛋白は、ストレス状態の細胞に発現し、その細胞にストレス抵抗性をもたらすことが知られている。この関節炎モデルでは前十字靱帯切除による主としてメカニカルなストレスが滑膜細胞に負荷され空胞変性に至ったことが考えられるが、 HA84投与群では滑膜細胞におけるHsp72発現亢進がその空胞変性の抑制に関与していることが推定される。また、このHsp72発現増強も、HA230に比べHA84を投与した関節滑膜において顕著であった。以上のことは、NaHAにはHsp72発現増強作用があることを示唆しているが、現在、我々は、NaHAの示すこの作用についてさらに詳細な検討を加えているところである。
大部分のNaHAの作用メカニズムはその物性をキーワードとして説明されてきており、Biomechanicalな作用として捉えられている。しかし、上記のようなNaHAの滑膜細胞に対する作用は、Biomechanicalな作用というよりも、何らかの細胞シグナル伝達を介した細胞生物学的な作用と考えられる。未だそのメカニズムについては不明な点は多いが、ヒアルロン酸の受容体、すなわちCD44cおよびRHAMMdが発見されるに至り、多くの研究者がそれら受容体を介したシグナル伝達について興味を抱いている。ヒアルロン酸は、その特異的な物性に加えて細胞生物学的作用を通じて生体に作用を及ぼすことが解明されはじめている。NaHAがmedical deviceだけでなくDrugとして多くの認知を得るのは、そう遠い日ではなさそうである。
c このシリーズのTooleおよびKnudson の総説を参照
d このシリーズのTurleyの総説を参照
a. 手術補助剤
ヒアルロン酸のもう一つの医療応用の代表として眼科適用がある。NaHAは日本国内では、変形性関節症適応薬剤としての事業的規模が大であるが、世界的にみると、眼科用手術補助剤としてより広く使用されている。眼科手術補助剤のNaHAにも分子量の異なる商品がある(表1)。
1) 白内障手術とNaHA
白内障は水晶体が混濁してしまう疾患で、失明原因のトップである。混濁が進行してしまった水晶体を薬物により治療することは非常に困難であるため、混濁した水晶体を外科的に除去する治療が選択される。視機能における屈折率の大部分を担っている水晶体が除去されると、強度の遠視になってしまうため、混濁水晶体除去後に、一連の手術手技として、水晶体と同程度の屈折率(lens power)を有する眼内レンズ(intraocular lens)が挿入される。
このような一連の白内障手術において、大きな問題となる点が、デリケートな眼内組織、特に角膜内皮の傷害である。角膜は上皮細胞層、ボーマン膜、実質層、デスメ膜、内皮細胞層の5層から構築されている。最内層の内皮細胞層は1層で、細胞分裂能力が極めて低く、脱落した部位は周辺の内皮細胞が肥大して修復する。このような乏しい内皮細胞の修復能力を超えた傷害が加えられると、傷害部位から水分が侵入し、角膜浮腫を引き起こす。
Balazは前述の白内障手術における問題点を、ヒアルロン酸のような粘弾性物質を用いて回避する方法を提案した18。Viscosurgery と命名されたこの方法は、白内障手術のみならず、粘弾性物質を手術時に適用し、手術時の問題点を解決しようとする広い概念である。白内障手術時では、手術スペース(前房深度と呼ばれる)の維持や角膜内皮などを物理的侵襲から保護するために粘弾性物質を利用することを意味する。使用方法の一例を図5に模式的に示す。このような考えに基づき、世界で最初にスエーデンで眼科手術補助剤としてHealon![]() が開発された。以後、幾つかの商品が上市され、白内障手術の安全な実施や角膜内皮傷害の軽減に用いられている(表1)。
が開発された。以後、幾つかの商品が上市され、白内障手術の安全な実施や角膜内皮傷害の軽減に用いられている(表1)。
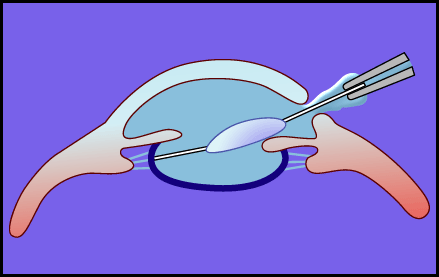
図 5 眼内レンズ挿入術におけるヒアルロン酸ナトリウムの適用例
混濁した水晶体核を除去したのち,ヒアルロン酸ナトリウムを注入することにより,前房深度を十分に維持して,眼内レンズが挿入される.ヒアルロン酸ナトリウムを手術に使用することにより,角膜内皮層の傷害は大幅に軽減される。
ヒアルロン酸は生体内において、物理的な緩衝剤や潤滑剤としての機能を果たしており、その特性を生かして上記のような目的のために医療応用することは理にかなった、優れた発想であると思われる。現在、白内障手術において、粘弾性物質は有力な補助剤となっている19。
2) 超音波乳化吸引術とNaHA
手術スペース(前房深度)を維持し、角膜内皮を保護するためには、ヒアルロン酸の粘弾性は十分に高いことが要求される20。ところが最近の白内障手術の新技術により、粘弾性は高いほど良いと一概には言えなくなってきている。前述のように、白内障手術では混濁した水晶体が除去されるが、その除去の方法の主流が超音波を用いる方法、超音波白内障乳化吸引術(PEA)、になってきたからである。
水晶体は水晶体嚢(lens capsule)という薄く透明な膜に包まれている。水晶体嚢の主要成分は4型コラーゲンである。PEAでは、水晶体嚢の前方側(前嚢)を切除したのち、混濁した水晶体の核を超音波で乳化しながら、潅流液で吸引除去する。混濁した水晶体をそのまま摘出する場合は、水晶体が通過できる切開創幅が必要であるが、PEAでは、超音波、潅流、吸引用のチップが入る幅(約3 mm)の切開創で済む利点がある。しかし、PEA中の眼内組織は、超音波、破砕された水晶体核の小片、超音波により生成する気泡(cavitation)やラジカルにより傷害されるという欠点もあった。
このような傷害に対して、非常に高い粘弾性を有するNaHAは、潅流、吸引開始後、一塊となって、すぐに前房内から消失してしまい易く、保護効果に問題があると指摘されている21。分子量200万以上のNaHAは分子の絡み合い(entanglement)が強く、潅流に対して固まりのように挙動するからである11,21。
一方、分子量110万程度の1% NaHA溶液は絡み合いが弱いため、潅流液と混合しながら徐々に前房内から消失する21。その結果、超音波、潅流、吸引処理による傷害から角膜内皮を効果的に保護するとされている21。
最近の眼科用粘弾性物質に関する研究報告では、粘弾性物質を凝集型(cohesive type)と分散型(dispersive type)の2種に分類し、白内障手術の各段階に応じて使い分けることが提唱されている21,22。すなわち、眼内レンズ挿入時など、できるだけ十分に手術スペース(前房深度)を維持したい時は凝集型を20,21、PEA時の傷害から眼内組織を保護したい時は分散型を使用するという使い分けである21,22。
b. 角膜創傷治癒における組織中ヒアルロン酸(内因性)およびCD44の発現
ヒアルロン酸およびその受容体は、形態形成において重要な役割を演じることが知られているe。角膜創傷治癒過程にも、この形態形成の機転が認められることから、我々は、ヘプタノールによって作製したウサギ角膜創傷治癒モデルにおいて、ヒアルロン酸およびCD44発現の動態を検討した 23。
角膜組織中のヒアルロン酸濃度を生化学的に測定したところ、創傷後14日にはピークに達した後、減少し、56日目には正常レベルに戻った。ヒアルロン酸の動態とは反対に、同じグリコサミノグリカンの仲間であるケラタン硫酸は、創傷後一旦は減少するが治癒に従って増加・回復することが知られている24。正常生理状態の角膜では、ヒアルロン酸よりも、むしろケラタン硫酸の方が、その透明性の維持などに寄与しているようである。事実、ケラタン硫酸プロテオグリカンの糖鎖を欠損している遺伝病患者の角膜では、コラーゲン繊維の太さや走行に乱れが生じており、失明に至ることが知られている24。
ヒアルロン酸およびCD44の動態を組織化学的に検討すると(図6)、ヒアルロン酸の染色態度は、ほぼ前述の生化学的データと一致を示し、CD44も、一部を除いて概ねヒアルロン酸と同様な染色動態を示した。この過程の中では、ヒアルロン酸およびCD44とも角膜上皮および角膜実質において局在性が認められた。それらの発現増加は、上皮細胞が増殖・移動して創傷部位を覆う過程(3日目まで)において認められ、その後の上皮細胞の分化の過程では、染色性は減少して正常レベルに復した。すなわち、ヒアルロン酸およびCD44発現増強は、上皮細胞では主に移動・増殖に必要であったことがうかがえる。創傷部位が完全に覆われ、上皮細胞が増殖・分化する過程に位置する創傷後14日目では、上皮においては、すでに、CD44発現は正常レベルに復していた。この時期の上皮のヒアルロン酸は、CD44にanchoringされておらず、細胞間に浮遊していることが推測される。上皮のヒアルロン酸染色のレベルは、28日目に正常レベルに復するが、これに先立つCD44発現の減弱によってヒアルロン酸産生の抑制が導かれたのかもしれない。
以上のことは、ヒアルロン酸およびCD44が角膜創傷治癒に深く関与していることを示している。Miyauchiらは、角膜創傷モデルにヒアルロン酸を添加すると、その治癒が加速されることを報告している25。また、Miyazakiらは、in vitroにおける角膜上皮細胞増殖が、ヒアルロン酸添加により亢進されることを示した26。今後、角膜創傷治癒剤としてのNaHAが開発されることが期待される。
e このシリーズのToole の総説を参照
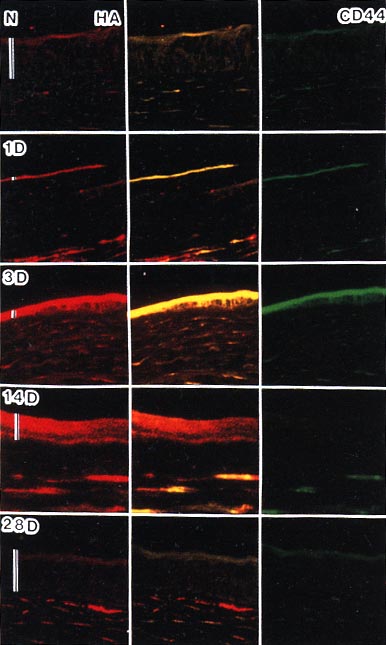
図 6 角膜創傷治癒モデルの角膜組織におけるヒアルロン酸(赤,左)とCD44(緑,右)の2重染色
N,正常組織;1D,3D,14Dおよび28Dの数字はそれぞれ創傷後の日数を示す。縦の白線は上皮の厚さを示す。ヒアルロン酸(赤)とCD44(緑)がともに染色されている部位は、黄色で示されている(中央のカラム)。倍率: x110
1985年、Westら27,28が低分子ヒアルロン酸(分子量1,600-10,000)が血管新生作用を示すという報告をして以来、現在にいたるまで、同様の報告がいくつかある(表228-36)。最近では、Deedら34がc-fosなどの関与を示唆する報告をしているが、まだ、詳細な解明には至っていない。Lokeshwarら35の報告によれば、膀胱がんにおいては、尿中および組織中に大量の低分子ヒアルロン酸が検出されるという。このがんの悪性度と組織中ヒアルロン酸の分子量の相関性を調べると、悪性度の高いがんでは高分子(約200万)と低分子(約1万)が混在していることが示された。悪性度の高い腫瘍組織では、高分子ヒアルロン酸が転移を誘導し、低分子ヒアルロン酸が腫瘍組織への栄養血管の新生を誘導していることが推測される。
表2 低分子ヒアルロン酸の血管新生作用に関する報告
| 著者 | 分子量 | 方法、用量、所見など |
| West et al.28(1985) | *1.6-10x103 | CAM |
| West and kumar29(1989) | 1.35-4.5x103 | PEC (0.5-10mg/ml) PEC (50-100mg/ml) |
| Rooney et al.30(1993) | 1.35-4.5x103 | CAM |
| Sattar et al.31(1994) | 1.35-4.5x103 | 局所投与 ラット皮膚血管 |
| Lee et al.32(1995) | ** 0.4-2x103 | 移植片における血管数/面積及び血流量 |
| Montesano et al.33 (1996) | 1.35-4.5x103 | PEC (1mg/ml) uPA, uPA 受容体, PA阻害因子(10ng/ml) |
| Deed et al.34(1997) | 1.35-4.5x103 | PEC(1-1000mg/ml) krox-20 |
| Lokeshwar et al.35 (1997) | 4-6x103 | PEC(2-10mg/ml) |
| Rahmanian et al.36 (1997) | 2.4x103 | 脳血管内皮細胞の脈管形成 (100mg/ml) |
*: 分子量10 x103以上のヒアルロン酸は血管新生作用を示さないことが確認されている。
**: 分子量16 x103のヒアルロン酸は血管新生作用を示さないことが確認されている。
CAM: 尿しょう膜による検出
uPA: ウロキナーゼ型プラスミノーゲンアクチベーター, PA:プラスミノーゲンアクチベーター
PEC:血管内皮細胞の増殖 , EC: 血管内皮細胞
![]() :亢進あるいは誘導,
:亢進あるいは誘導, ![]() : 抑制
: 抑制
Nobleらのグループ42は、低分子ヒアルロン酸(約50万以下)が炎症に関わる種々因子を誘導することおよび高分子ヒアルロン酸(600万以上)にはそのような活性がないことを報告してきている(表337-45)。1988年頃、免疫系の細胞においてヒアルロン酸受容体CD44が発見されと、CD44に関する研究は、どちらかと言うとヒアルロン酸の分野よりも免疫の分野において活発に行われるようになった。抗CD44抗体で免疫細胞を処理すると、サイトカイン産生が認められることをきっかけに、ヒアルロン酸とサイトカインの関係が着目されたものと考えられる。低分子ヒアルロン酸の処理によりサイトカインやケモカイン、NO産生がマクロファージ等において誘導されること、およびNF-κBなどの転写因子がこの誘導に関与していることが示されている(表3)。
表3 低分子ヒアルロン酸の炎症性因子誘導に関する報告
| 著者 | 分子量 | 方法、用量、所見など |
| Noble et al.37 (1993) | 80x103 | Mf (100-1000mg/ml) TNF-a |
| Noble et al.38 (1996) | 267-513x103 | Mf(1-100mg/ml) NF-kB/I-kB |
| Hodge-Dufour et al.39 (1997) | 280x103 | Mf(100mg/ml) IL-12 RANTES |
| Mckee et al.40 (1997) | 200x103 | Mf(50, 100mg/ml) iNOS NF-kB 活性化が必要 |
| Maradny et al.41 (1997) | 400x103 | 子宮筋組織(ヒト) (0.5,1mg/ml)IL-8 |
| Noble et al.42 (1998) | 20x103 | Mf(100mg/ml) MIP-1a |
| Horton et al.43 (1998) | 200x103 | Mf(25-100mg/ml) MIP-1a RANTES |
| Rockey et al.44 (1998) | 12x103-210x103 | 肝 クッパー細胞, EC (10-200mg/ml) , iNOS |
| Oertli et al.45 (1998) | 80-600x103 | 腎尿細管上皮細胞, (1-1000 mg/ml) ICAM-1 |
Mf : マクロファージを使用した培養実験、EC: 血管内皮細胞
![]() :発現の亢進あるいは誘導
:発現の亢進あるいは誘導
以上の低分子ヒアルロン酸の活性に関する報告をまとめてみると(表2,3)、炎症性因子誘導活性を示すヒアルロン酸は、概ね血管新生活性を示すヒアルロン酸より分子サイズが大きいことがわかる。また、これらの活性は、いずれも抗CD44抗体で阻止できることから、CD44依存的な現象と考えられている。一方、これらの活性は、高分子ヒアルロン酸の示す血管新生抑制46あるいは、炎症抑制すなわちIL-114,15,16およびPGE24,7産生抑制とは、正反対の現象である。以上のことは、上記活性を介在するCD44のシグナル伝達は、ヒアルロン酸の分子サイズにより異なることを示唆している。ヒアルロン酸は2糖を最小単位とする繰り返し構造呈しているので、低分子化されても、そのサイズが6糖あるいは10糖(ヒアルロン酸受容体と結合できる最小のサイズは細胞の種類によって異なる)以上であれば、どのようなサイズのヒアルロン酸もその受容体と結合できるはずである。細胞膜において受容体がある程度自由に動き回ることができるとすれば、大きいサイズのヒアルロン酸ほど、散在していた多くの受容体を寄せ集めることができる。そして、ヒアルロン酸受容体からの細胞内シグナル伝達が、その寄せ集め、すなわちクラスターの状態により異なるとすれば、分子サイズの違いによりシグナル伝達が異なる可能性がある。さらなる検討が必要であるが、ヒアルロン酸の繰り返し構造がこのことを説明する鍵を握っているものと推測される。
本稿では、NaHAの変形性関節症および眼科適用についての論述を展開した。しかしながら、変形性関節症においては、長い間、臨床応用がされてきたにもかかわらず、体系的にその作用メカニズムを説明することには未だ困難を伴う。ヒアルロン酸については、まだ、我々がはかり知ることのできない機能が潜在しているにちがいない。
最近のヒアルロン酸研究において、最も注目すべきトピックスは、ヒアルロン酸合成酵素のクローニングと、そのノックアウトマウスの作製であろうf。今後、ヒアルロン酸合成酵素のノックアウトマウスやトランスジェニックマウスなどの研究から、ヒアルロン酸の生体内における生理的機能や疾患における役割が、飛躍的に解明されていくことが期待される。このような遺伝子工学的手法を背景に、ヒアルロン酸研究は、新たな世代に突入した。今後は、新たに発見されるヒアルロン酸の機能をもとにした医薬品への応用が次世代の主流になっていくものと考えられる。
f このシリーズのSpicerの総説を参照