氏名:北田 学利
大阪大学大学院医学系研究科・分子制御内科学
癌転移の最初のステップを考える場合、癌細胞どうしの離脱、細胞間の接着の低下が考えられる。E-カドヘリンは、Ca依存性の接着分子で細胞間のホモフィリックな結合を制御し、癌化および癌の悪性形質転換(転移能の獲得)に伴い、その機能が低下することが知られている。すなわち、プロモーター領域のDNAメチル化に伴い、E-カドヘリンの発現低下が起こることは、いくつかの癌で見られる。E-カドヘリンには4-5ケ所のアスパラギン結合型糖鎖が結合し、近年その糖鎖変化がE-カドヘリンの機能を制御することで注目されてきた。N-アセチルグルコサミン転移酵素III (GnT-III)でマウスのメラノーマ細胞の糖鎖を改変させると、元来転移性の高かった細胞の実験的肺転移を著しく抑制した1。その機序としては、糖鎖改変に伴い細胞表面でのE-カドヘリンのturn-overが遅延し、結果的に発現量が増えることによる2。ところが、この機構はヒト癌細胞では見られない。そこが糖鎖の多様性という難しい問題である。ただ全く別の機序により、E-カドヘリンの機能は変化する。E-カドへリンは、細胞内に存在するα、β、γ-カテニンと複合体を形成する。癌細胞におけるE-カドへリンの機能障害として、[1]E-カドへリンの変異/発現低下、[2]E-カドへリンの裏打ち蛋白であるβカテニンの変異/発現低下、[3]βカテニンのチロシンリン酸化に伴うE-カドへリンの相互作用の消失、が考えられる。
βカテニンはEGFやsrc、wnt-1などのシグナル伝達経路の共通のターゲット分子である。最近では、βカテニンのチロシンリン酸化が癌化や癌転移に寄与していることが報告されている3。下図に示すように、個々の細胞はE-カドへリンという接着分子を介して互いに結合し、E-カドへリンの裏打ちタンパクであるβカテニンと複合体を作り、接着が強化されている。癌細胞の場合、EGFあるいはSrcからのシグナルなどにより、βカテニンのリン酸化が起こると細胞間接着が減弱する。一方、GnT-lll遺伝子を導入し、E-カドへリンの糖鎖を変えた細胞では、βカテニンのリン酸化が抑制され、細胞間の接着は維持された4。E-カドヘリンのbisecting GlcNAc付加は、βカテニンのチロシンリン酸化を抑え、細胞内のシグナルを制御する。結果として、E-カドヘリンの低分岐化は癌転移抑制、浸潤の抑制に関与している可能性がある。
このように、細胞表面に存在するE-カドヘリンの糖鎖改変は、様々な形で細胞の生物学的特徴を変える。今後、4箇所存在するどの糖鎖が重要か、何故E-カドヘリンの機能をたった1つの糖鎖が変えるのかなどの命題に対する解答が待たれる。
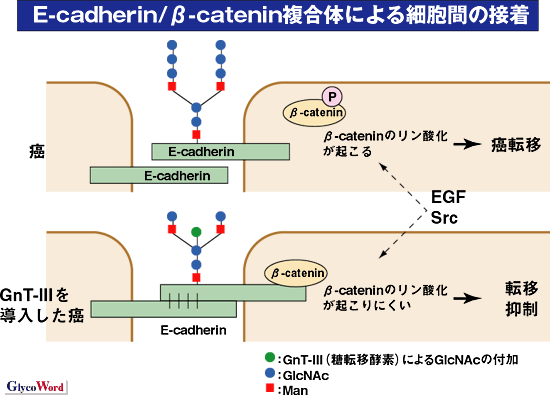
図 1