氏名:宮城 妙子
宮城県立がんセンター研究所・生化学部門
シアリダーゼは糖脂質や糖蛋白糖鎖からシアル酸を脱離する糖分解酵素で、糖鎖分解の初発反応を触媒する。ヒトシアリダーゼNEU3は、膜画分に局在して、シアル酸を持つ糖脂質であるガングリオシドに特異的に働くユニークなシアリダーゼである1,2。本酵素の機能を明らかにする目的で、その遺伝子導入マウス(TG)を作成したところ、6系統のうち、18−22週後に4系統の雄マウスにおいて、耐糖能の低下およびインスリン産生過多が認められ、インスリン抵抗性糖尿病を発症していることが明らかとなった3。糖負荷試験による血糖値はTGマウスにおいて対照群に比べて有意に高値を示し、その際の血中インスリン値は、対照群と比較して著しく高いことが観察された。また、インスリン負荷後も血糖の低下を認めず、対照に比べて有意な高値を示した。膵ラ氏島について観察すると、TGマウスの膵ラ氏島は著明な肥大を示し、インスリン産生が活発に行われていることがわかった。
糖尿病の発症機序を探るために、インスリンレセプターおよびIRS-1のリン酸化の程度をウェスタンブロッティングにより比較した。TGマウス筋において両者のリン酸化の減少が認められた。このシグナルの下流にあるPI-3キナーゼやグリコーゲン合成の律速酵素であるグリコーゲン合成酵素の活性を調べると、TGマウスの筋肉では対照に比較し、有意な活性低下を認めた。本酵素の高発現によってもたらされる各種組織のガングリオシドパタンの変化を薄層クロマトグラフィによって調べた。各組織にGM1あるいはGM2の蓄積がみられた。ガングリオシドがインスリンレセプターのリン酸化を修飾しているようであった。また、インスリン刺激により、NEU3発現酵素がチロシンリン酸化を受けて活性化されており、そのSH-2ドメインを介して、シグナル分子Grb-2と会合することが示唆された。チロシンリン酸化部位に変異を施したNEU3では、IRS-1のリン酸化やその下流のシグナリングの障害が正常化する傾向を示した。
以上の結果を図に模式的にまとめ、考察すると、正常ではインスリン刺激により、IRがリン酸化され、糖の取り込みやグリコーゲン合成が活性化される。その時、NEU3も活性化を受け、ガングリオシドパタンが変化し、IRのリン酸化をフィードバック制御すると推察される。しかし、NEU3の過剰発現状態では、その反応産物であるGM1やGM2が蓄積し、IRのリン酸化を恒常的に抑制することになり、耐糖能異常が惹起されるようである。一方、インスリン刺激により活性化されたNEU3蛋白はGrb-2分子との相互作用を介して、その下流のシグナリングを低下させている可能性がある。NEU3高発現系では、NEU3の反応産物である糖脂質を介した経路とNEU3蛋白のシグナル分子との相互作用を介した経路の両方がインスリンシグナリングを修飾している可能性がある。シアリダーゼ高発現がインスリンシグナリング異常をもたらしている機構のひとつが推察された。今後、NEU3導入TGが糖尿病モデル動物として病態解明や治療法の開発に役立つことが期待される。
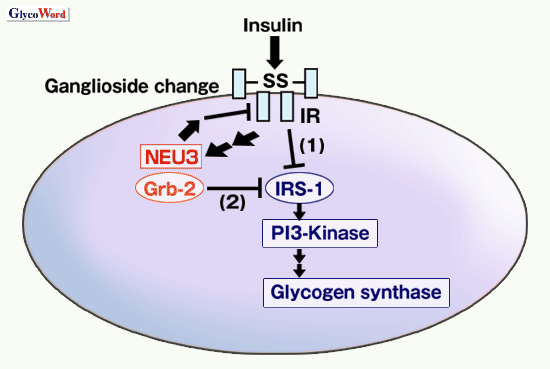
図 1 インスリンシグナリングにおいて想定されるNEU3の機能の概念図
上流において(1)、NEU3はガングリオシドパタンの変化を介してIRのリン酸化をフィードバック制御する。下流において(2)、NEU3はGrb-2との相互作用を介してシグナリングを低下させる。