
氏名:Robert Haltiwanger
Haltiwanger博士はデューク大学から 1980年に生物学の学位を、1886年に生化学の博士号を授与された。Robert L. Hill博士の研究室での博士研究として、 彼はほ乳類のレクチン、特にマンノース受容体の精製とその特性解析を行った。その後、ジョンスホプキンス大学医学部のGerald W. Hart博士の元でポスドク研究を続けた。Dr. Hartの研究室では、彼はO-結合型N-アセチルグルコサミン (O-GlcNAc) の修飾について研究し、O-GlcNAcをタンパク質へ付加する酵素、UDP-GlcNAcと ポリペプタイドの結合を触媒する O- N-アセチルグルコサミン転移酵素を精製し、その性質を明らかにすることで貢献した。1992年、ストニブルークのニューヨーク 州立大学の生化学および細胞生物学教室の助教授となり独立した研究活動を開始した。ここではO-フコースおよびO-グルコース の付加を含めたO-型糖鎖で修飾された通常とは異なる形のタンパク質についての研究を続けている。1998年Haltiwanger博士は 準教授に昇進した。
細胞表面の糖鎖が細胞−細胞間のコミュニケーションやシグナル伝達で役割を担っていることが予想されたのは30年以上も前のことである。これは生体中の全ての細胞が必ず、信じがたいほど複雑な糖鎖構造からなる糖衣(グリコカリックス)をまとっているとの観察に基づいたものであった。細胞表面、細胞−細胞間のコミュニケーションやシグナル伝達の場にこのような複雑な構造があることから、糖鎖複合体が同様に、細胞と外界とのコミュニケーションに係わる複雑な仕事も支えていると言う提案になった。にもかかわらず、その後細胞−細胞間のコミュニケーションやシグナル伝達における糖鎖の役割を示した報告はほんの数例にすぎなかった。仮説を支持するデータがなかなか出てこない理由の一つには、オリゴ糖の構造を決める技術が難しいことが関係している。しかしながら最近のオリゴ糖分析技術の進歩により、ずっと昔に予測されたものの多くが確認されるようになってきた。ここでは一つの特異的なシグナル伝達現象における糖鎖付加の役割、すなわちノッチ受容体の機能と制御におけるO-フコースの修飾の役割について述べる。
ノッチに対する遺伝子座は、ショウジョウバエで行われた初期の遺伝学的スクリーニングの一つとして20世紀初期に同定された。ノッチ突然変異体はX−連鎖致死表現型を呈し、メスがその羽根に小さな切れ目を持っていることから遺伝子座にその名が付けられた。ノッチ遺伝子は1985年に同定され、300 kDa以上の大きな細胞表面受容体をコードしていることが分かった(ノッチに関する優れた総説は文献1を参照)。ノッチは発生過程の種々の場面に関与しているが、特に細胞の運命を決定するものとして知られている。ノッチ機能に関する最も詳細な研究はショウジョウバエを用いて行われ、神経系、血管系、眼、脚そして羽根を含む多くの器官形成に必須であることが示された。ノッチの相同性については全ての後生動物門と、ほ乳類中の4つ(ノッチ1-4)について同定された。ノッチは脊椎動物の発生過程で多くの役割を演じ、ノッチシグナルが欠けると幾つかのタイプのがんやAlagille症候群(慢性胆汁うっ滞、心血管奇形、椎弓奇形、特徴的な顔貌、後部胎生環の5徴を特徴とする常染色体優性遺伝の疾患)、脊椎肋骨異形成症、CADASIL (cerebral autosomal dominant arteriopathy with subcortical infarcts and Leukoencephalopathy;大脳皮質下の小梗塞像と白質病変を伴う脳内小動脈形態異常を特徴とする常染色体優先遺伝の疾患で、頑固な片頭痛やめまい,嘔吐などを伴う)のような発生過程での障害を含む、種々のヒトの病気になる。最近の研究で多発性硬化症の発症とノッチの活性化と間の連鎖が示された。ノッチ受容体のシグナル伝達が発生に係わっている程度の大きさには驚くばかりである。
ノッチ受容体はデルタと/あるいはセラートのリガンドに結合することで活性化される。幾つかの相同性のあるリガンドがほ乳類には存在する(デルタ様1、3および 4と呼ばれる3つのデルター様ホモログと、ジャグド1および2と呼ばれるセラート様ホモログ)。リガンド自身が膜貫通タンパク質であり、従ってノッチの活性化は隣接細胞の細胞表面上に発現したリガンドを介して生じる(図1、ノッチ活性化に関する優れた総説は文献2を参照)。ノッチの活性化は一連のタンパク質分解過程を経て進む。リガンド結合は細胞表面メタロプロテアーゼTACE (TNFα-converting enzyme)による分解が受け易くなる様な方法で、ノッチの細胞外ドメインの立体構造が変わることと信じられている。この分解は形質膜のすぐ外側で起こり、ノッチの細胞外ドメイン全体が外れるとリガンド発現細胞によってエンドサイトーシスされる。細胞外ドメインが除去されると形質膜内ではγセクレターゼで触媒されるもう一つのタンパク質分解が活性化される。この分解で可溶性タンパク質となったノッチの細胞内ドメインは細胞質内へ放出される。細胞内ドメインは核の局在シグナルを含んでおり、核へ輸送されて転写調節因子のCSL (CBF-1/Suppressor of hairless/Lag-1)ファミリーのメンバーへ結合する。その結果、下流の遺伝子産物の幾つかが活性化される。アルツハイマー病に関係したβアミロイド前駆体を含む幾つかの他の細胞表面受容体は、最近RIP(Regulated Intramembrane Proteolysis、膜領域における制御タンパク質の切断)と呼ばれている同様の一連のタンパク質分解過程を経る。
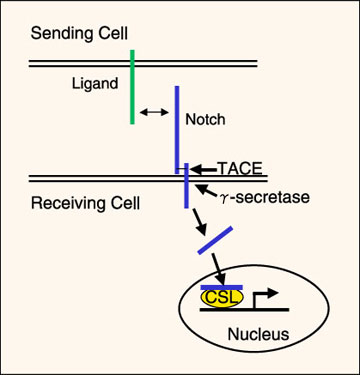
図 1 ノッチシグナル伝達経路
ノッチはそのリガンド(デルタ、セラート/ジャグドファミリーメンバー)に結合することで 活性化される。リガンド自身が膜貫通タンパク質でもあるので、細胞は活性化されるためにはノッチに隣接しなければ ならない。リガンドとの結合によりTACE (TNFα-converting enzyme )によってノッチの細胞外ドメインは切断され、 次いでγセクレターゼによって膜から細胞内ドメインが切断される。ノッチの細胞内ドメインは核に移行し、そこで転写調節因子の CSL (CBF-1/Suppressor of hairless/Lag-1)ファミリーのメンバーと相互作用し、下流の遺伝子産物の幾つかを活性化する。文献9から改変。
ノッチの活性化は色々なレベルで調節される3,4。例えば同じ細胞内でノッチとしてリガンドが 発現すると隣接細胞からのシグナルに対し抑制効果が働き、これはリガンドによる細胞−自律制御と呼ばれる。ノッチ活性 の調節因子はWingless、 Scabrous、 Numb、 Deltex と Disheveledを含めて幾つかが同定された。新しい調節因子フリンジは最初ショウジョウバエ の羽根が発生する際、背側と腹側の境界形成に関与する遺伝子として突然変異体のスクリーニング中に見つかった。その後の 研究でノッチ経路を調節することでそれが機能し、デルタからのシグナルは増強する一方で、セラートからのシグナルを抑制 していることが分かった。興味深いことに、フリンジの効果はノッチに関しては細胞自律制御的であり(例えば、フリンジは ノッチが作用する細胞と、ノッチが発現する細胞は同じでなければならない)、フリンジは分泌タンパク質である。これらの 観察結果からフリンジは結合するか、あるいは翻訳後ノッチの細胞外ドメインを改変することでその効果を仲介しているらし い。フリンジが数種の微生物糖転移酵素と若干相同性のある遺伝子配列を持っている事実から、ノッチ上の糖鎖構造を改変する ことでフリンジが機能している可能性が高まってきた。
ノッチの細胞外ドメインはO-フコースやO-グルコースを含む幾つかの糖鎖が付加される形で改変される 5。これらのO-結合型糖鎖で修飾された普通と異なる形状が表皮細胞増殖因子(EGF) 様反復配列内の共通配列のセリンあるいはスレオニンの水酸基上で作られる6。EGF様反復配 列は3つのジスルフィド結合を形成する6つの保存されたシステイン残基が存在することで定義されたタンパク質モチーフであり、O-フコースやO-グルコースに対する共通配列はこれらのシステインがある領域に見つかった。例えばO-グルコースが付加された場 所は配列C1XSXPC2があるEGF様反復配列の一番目と二番目の保存されたシステインの間である。一方O-フコースの付加は 配列C2X4-5S/TC3がある二番目と三番目の保存されたシステインの間で見られる(図2)。ノッチの細胞外ドメインは36個のタンデムEGF様反復配列から構成されており(例:ほ乳類ノッチ1、ノッチ2、ショウジョウバエノッチ)、それらの多くはO-フコースやO-グルコース糖鎖に対する共通配列を有している(図3)。糖付加部位の多くの 領域は進化的には保存されていることから、糖鎖がノッチの生物学において重要な役割を果たしていることが示唆される。
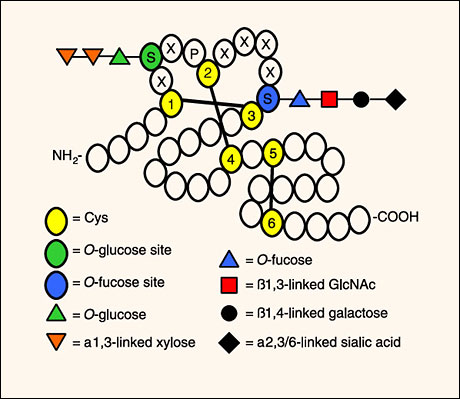
図 2 幾つかのEGF様反復配列はO-フコースと/あるいはO-グルコース糖鎖で修飾されている
EGF様反復配列の概念図を示した。内部ジスルフィド結合(黒線)およびO-フコースとO-グルコース付加のための推定される 共通配列が関与するシステインが強調されている(黄色)。異なるEGF様反復配列上では構造の多様性が見られるが、O-フコースと O-グルコース構造の結合部位の代表例を示した。例えばヒト因子VIIからのEGF様反復配列はただのO-フコースで修飾されて いるが、ヒト因子IXからのEGF様反復配列は完成した4糖がついている6。
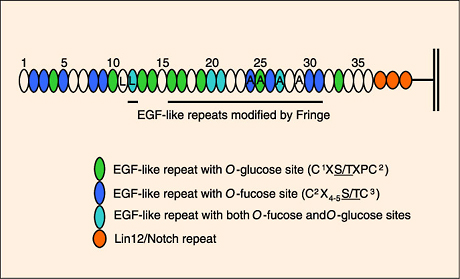
図 3 ノッチの細胞外ドメインにあるEGF様反復配列の多くはO-フコースと/あるいはO-グルコース糖鎖で修飾されている
ノッチ1、ノッチ2(ヒトおよびマウス)とショウジョウバエノッチに保存されている部位だけを示す。またフリンジタンパク質の1つで修飾されていることが分かっている分子領域で生じているO-フコースが付いたEGF様反復配列には下線を引いた。 "L"はリガンドのと結合に関与したEGF様反復配列で、"A" はAbruptex 変異体マップのEGF様反復配列を示している。文献12から引用。
O-グルコース修飾についてはほとんど分かっていないが、多くの研究からO-フコース修飾はノッチ機能上必須であるこ とが言われている。ショウジョウバエのRNA干渉により、O-フコース転移酵素I (O-FucT-1) すなわちEGF様反復配列へフコースを付加する酵素の、タンパク質発現レベルを下げると結果的にノッチ様表現型の 変化に帰着する7。詳細な研究からO-FucT-1レベルの低下は多くの様々な発生に係わるノッチ機能に影響を及ぼすことが示され、O-フコース修飾がノッチシグナルの全ての面で必須であることが示唆された。マウスのO-FucT-1遺伝子を欠損させると ノッチの一つをノックアウトした場合のいずれよりもより重度な表現型変化が生じ、O-フコースの付加が全てのノッチアイソ フォームに必須であることが示唆される8。GDP-フコース合成酵素(全てのフコース転移酵素へのフコース供与体)を欠損させた細胞で はノッチシグナル伝達を維持できなかった9,10。これらの結果から、ノッチが機能するためにはO-フコースでの修飾が必須である ことが強く示唆される。
更に機能化に必須であるばかりでなく、O-フコースはノッチ活性の調節にも役割を果たしている。最近の研究からフリンジファミ リータンパク質はO-フコース特異的β1,3-アセチルグルコサミン転移酵素 (β1,3GlcNAcT) であることが示された9,11。フリンジがない場合、ノッチはO-フコース単糖で修飾される。フリンジが ある場合、EGF様反復配列上の何カ所か(全部ではない)でO-フコースはβ1,3-結合GlcNAcで修飾される12。この2糖に は更にガラクトースとシアル酸が伸長されるので完成した4糖(Sia-α2,3/6-Gal-β1,4-GlcNAc-β1,3-Fuc-α1-O-Ser/Thr, 図2)が作られる。フリンジによってノッチ上のO-フコースの構造が変わると、リガンドに対応する様にノッチが変化する: すなわちセラート/ジャッグドからのシグナルを抑制し、一方でデルタからのシグナルは増強する。シアル酸の付加はJagged1からの シグナル抑制には必須ではなかったことから、Gal-β1,4-GlcNAc-β1,3-Fuc 3糖が、ノッチ活性変更に必要とされる最低構造であることが示唆される10。フリンジは、シグナル伝達の受容体の活性がいかに糖鎖の 修飾状態が変わることで調整されるかを示す特別な例として上げた(最近の総説としては文献13,14を参照)。
ノッチ上のO-フコース修飾がその機能に必須であり、またフリンジがその活性を調整するのにも必須であることは 明らかになったが、これらの糖鎖がどのようにノッチに作用するかの分子的なメカニズムについては分かっていない13,14。なぜO-フコースがノッチ機能に必要なのか分かっていない。予備的研究から、O-フコース化がなくとも、ノッチは細胞表面に発現することからO-フコースは細胞表面に適切に発現することに関しては、必要ではない7。従って糖鎖は直接的にリガンド結合に関与しているの かも知れない。あるいは糖鎖はノッチがリガンド結合や/あるいはタンパク質分解に必要なある構造を呈することに役目があるのかも知れない。更にO-フコース構造中のフリンジ−仲介による改変がノッチシグナル伝達を調節するメカニズムは不明である。可能な全てのモデルに 対して、一つやっかいな点はフリンジがリガンドの2つのクラスからのシグナル伝達に対し反対の効果;デルタリガンドからはシグナルを増強し、 一方でセラート/ジャグドリガンドからはシグナルを抑制する効果を持つことである。このことから最低2つのメカニズムが働いているらしい ことが示唆される。O-フコース構造の変化はリガンド結合に直接的な効果を持ち得るだろうし、あるいはノッチが間接的にリガンド 結合やTACEへの感受性を変えることで高次構造の変化を引き起こすのかも知れない。別の考えとしてはもう一つのタンパク質が関与している かも知れず、O-フコース構造の改変されることでノッチがこのタンパク質へ相互作用する能力に影響を及ぼしているかも知れない。 幾つかのタンパク質はノッチのFGF様反復配列と相互作用しシグナル伝達に影響を及ぼすことが知られている (例Scabrous, Wingless)。更にリガンドはノッチが抑制作用を及ぼすのと同じ細胞内で発現した。これらのタンパク質のいずれかとノッチが 相互作用することで生じる変化は、O-フコース構造の変化によって仲介されるが、このことからフリンジの作用機構が明らかになる。 興味深いことに、O-フコースはリガンド結合およびAbruptex領域に関与しているFGF様反復配列を修飾している (図3)。Abruptex変異体はノッチの高活性型となることから、変異が起きたAbruptex領域は抑制型と 考えられている。これらの部位におけるO-フコース糖鎖の存在はこれらの糖鎖機能に対して手がかりを与えるかも知れない。 これらのメカニズムのどれが個々のリガンドと係わるのか決めるにはこれまで以上の研究が必要である。
更にO-フコース糖鎖がノッチ機能に働く分子的メカニズムが不明であることに加え、ノッチにあるO-グルコース糖鎖の機能に ついてはほとんど分かっていない。ノッチは単糖と3糖の両方の形のO-グルコースで修飾されている(提案されている構造: Xyl-α1,3-Xyl-α1,3-Glc-β1-O-Ser/Thr)5 。ノッチ上のO-グルコースの部位はまだマッピングされていないが、我々の研究室 からの予備的データでは予想された部位が事実修飾されている。ノッチ上のO-グルコース部位は、O-フコースと同様進化を経ても 非常に良く保存されており(図3)、これらの修飾はノッチの生物学においても同様に重要な役割を果たして いることが示唆された。酵素活性からO-グルコースをFGF様反復配列に結合させる責任のある タンパク質であるO-グルコース転移酵素と15、2つの予想されたキシロース転移酵素が同定されたが15,16、これらの酵素とそれらの 生物学的機能の同定に関しては多くのやるべきことが残されている。
細胞表面糖鎖が細胞間コミュニケーションに係わっていると言う提案は明らかにされている。過去10年細胞表面の複合糖質によって制御、調節されている非常に多くの特別な生物学的現象の例が見られた。炎症局所への白血球の遊走に対するシアリルルイスX構造の関与、Wntにおけるヘパラン硫酸プロテオグリカンの役割、ヘッジホッグとTGFβシグナル経路、α-ジストログリカンの細胞外マトリックスへの結合におけるO-マンノースの役割、そしてポリシアル酸中の変化によるNCAM相互作用の調節、これら全てが、特別な生物学的現象の調節に細胞表面の糖鎖が役割を担っている明らかな例である。ノッチ上のO-フコースの役割が新たにこの増え続けているリストに加わった。フリンジが糖転移酵素であると言う発見は、様々な種からのゲノムを比較出来るようになり直接的に得られた。次の10年は、より多くの推定上の糖転移酵素が多様な生物機能に必須とされる糖鎖構造を合成することが示される、そんな心躍る時代になるだろう。