Jul. 26, 2002
セレクチンを介した細胞接着とその構造特異性(2002 Vol.06, A6)
神奈木 玲児
氏名:神奈木 玲児
1974年京都大学医学部卒業、医学博士。1980年-1982年、米国Washington大学Fred Hutchinson癌研究所にて箱守仙一郎教授のもとで研究に従事。帰国後、京都大学医学部助手(1982年-1985年)、同講師(1985年-1991年)を経て1991年より愛知がんセンター研究所分子病態学部の部長となり現在に至る。1985年に日本生化学会奨励賞、1986年に日本癌学会奨励賞を受ける。細胞間の識別、接着機構、糖生化学、腫瘍学を専攻。
1. はじめに
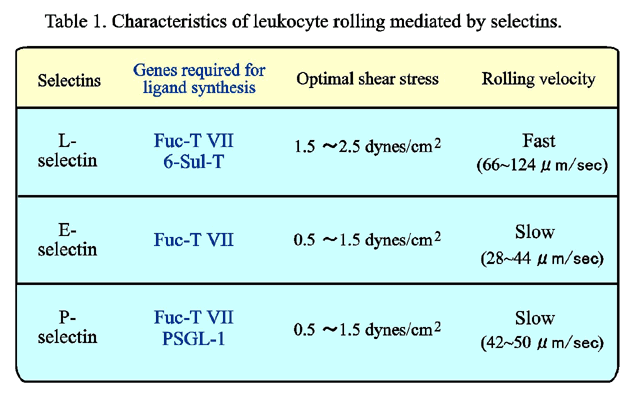
セレクチンファミリーの細胞接着分子は、特異的なリガンドと結合してタンパク質-糖相互作用を引き起こし、血中を高速で流れる白血球をとらえて血管内皮細胞の上でローリングさせる。セレクチンを介した細胞接着は、炎症における病変局所への白血球の動員、平常時の白血球系細胞の組織特異的ホーミング、またがん細胞や白血病細胞などの悪性細胞の組織浸潤や血行性転移に深く関与している。セレクチンファミリーのメンバーにはE-、L-、P-セレクチンの三種が知られている (Fig. 1)。セレクチンはいずれも、N末端から順に、カルシウム依存性に糖鎖と結合するCタイプレクチン様ドメイン、EGF様ドメイン、数回繰り返す補体結合タンパク様ドメイン、膜貫通ドメイン、および短い細胞質ドメインを有する。セレクチンを介した細胞接着は、もちろん細胞表層でのセレクチン分子の発現レベルによって調節されている。しかし最近、セレクチンを介した細胞接着が、Cタイプレクチン様ドメインの結合相手側である糖鎖リガンドの発現の変動によってさらに活発に調節されていることが、だんだん明らかになってきた。セレクチン・ファミリーのレクチン様ドメインは互いに相同性が高いので、三種のセレクチンとも類似の糖鎖と反応するものと従来から考えられてきた。しかし、実際にはそれぞれのセレクチンはそれぞれ異なる独特のリガンド特異性を持っており、白血球のさまざまなサブセットの組織特異的ホーミングや、炎症における活性化白血球の動員などの複雑な過程を精妙に調節している。
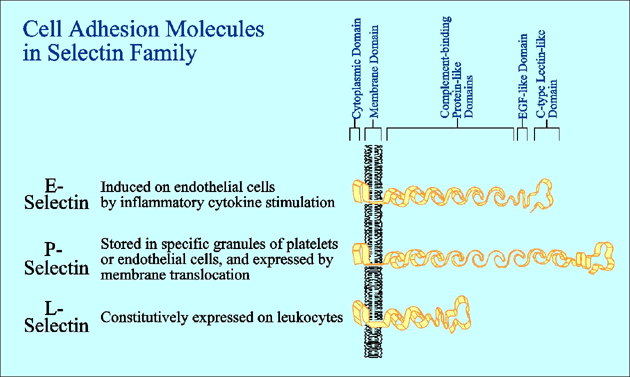
Fig. 1 セレクチンの三つのファミリーメンバーの模式図
2. E-セレクチンの糖鎖リガンド, シアリルLewisx とシアリルLewisa
E-セレクチンは別名をELAM-1(endothelial cell leukocyte adhesion molecule-1)、CD62Eなどともいい、IL-1やTNFαなどの炎症性サイトカインの刺激によって炎症局所の血管内皮細胞に発現が誘導され、白血球の炎症局所への遊走をひきおこす。培養血管内皮細胞をこれらの炎症性サイトカインで刺激すると、5'-調節領域に存在するNF-κB様因子の結合部位のはたらきによってE-セレクチン遺伝子の転写が誘導される。刺激4時間後あたりが細胞表層でのE-セレクチンの発現のピークであり、12〜24 時間後にはその発現はかなり低下する。1990年台のはじめ頃に、E-セレクチンの白血球側の糖鎖リガンドがシアリルLewisx であることが明らかにされた2-4。E-セレクチンを介した細胞接着は、E-セレクチンのCタイプレクチン様ドメインと、それが特異的に認識するシアリルLewisx 糖鎖との相互作用によって引き起こされる。典型的なE-セレクチン依存性の白血球系細胞のローリングの様子をVideo 1に示した。
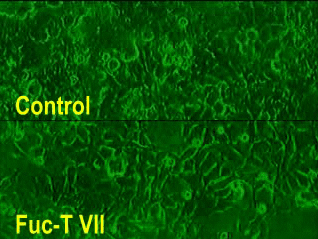
Video 1(図をクリック)
セレクチンを介した細胞ローリング実験の一例。
E-セレクチンを発現する細胞とフコース転移酵素VIIを遺伝子導入した細胞との間に見られるローリングを示す。下パネルにフコース転移酵素VIIを遺伝子導入した細胞の結果を示し、上パネルに遺伝子導入しない陰性対照細胞での結果を示す。下パネルにのみ有意のローリングが観察される。上下とも1.13 dyne/cm2のshear force下で記録した。
シアリルLewisxはがん細胞にもしばしば発現し、がん関連性の糖鎖抗原の一つと考えられている。ほかに良く知られたがん関連性の糖鎖抗原としてはシアリルLewisaがあるが、これもE-セレクチンのリガンドである(Fig. 2)5,6。シアリルLewisxやシアリルLewisaを強く発現するがん細胞は単層細胞接着実験において活性化血管内皮細胞にきわめて良く接着する。がんの血行性転移にはこの細胞接着が深く関与すると考えられている7。
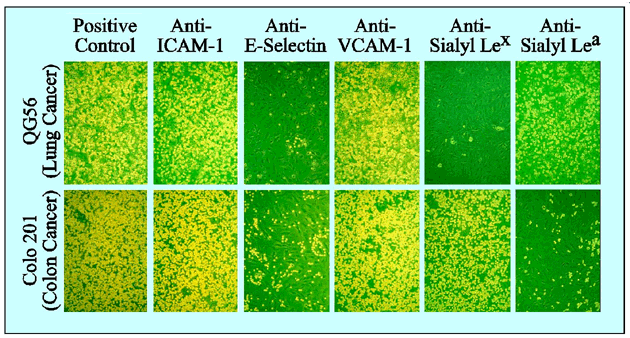
Fig. 2 ヒト培養がん細胞のE-セレクチンを介した血管内皮への接着を示す単層細胞接着実験の一例。
IL-1βで刺激したヒト臍帯静脈血管内皮細胞を用いた。肺がん細胞QG56の接着は抗シアリルLewisx抗体で阻害されるが、大腸がん細胞COLO201の接着は抗シアリルLewisa抗体で阻害される。両細胞の接着とも抗E-セレクチン抗体でほぼ完全に阻害される。
E-セレクチンのリガンドはシアリルLewisxやシアリルLewisaに限られない。糖鎖末端がシアリルLewisxやシアリルLewisaの構造でなくても、もっと内側にフコースが付加した糖鎖がE-セレクチンのリガンドとして十分にはたらくことが知られている8-10。実際の細胞表面のE-セレクチンリガンドは、シアリルLewisxやシアリルLewisaの系統のいろいろな糖鎖からなっていると考えられる。
白血球のシアリルLewisx糖鎖はさまざまなコアタンパク質に担われている。L-セレクチンそのものがE-セレクチンに糖鎖リガンドを提示するコアタンパク質であるとする報告もある11。もともとP-セレクチンリガンドの特異的コアタンパク質であるとされたPSGL-1は、E-セレクチンに対しても糖鎖リガンドを提示する。マウスの白血球系細胞では、E-セレクチンリガンドのコアタンパク質としてESL-1 (E-selectin ligand-1)というN-グリカンを持つユニークな150 kDaの糖タンパク質が報告されている12。がん細胞ではシアリルLewisx やシアリルLewisa 系統の糖鎖はMUC1などの高分子量のムチン様タンパク質や糖脂質に担われている。現在のところ、E-セレクチンは主としてリガンド分子の糖鎖部分を認識しており、特定のコアタンパク質を特異的に要求するわけではないと一般に考えられている。ただしコアタンパク質は、糖鎖の密度や立体構造に影響を与えることにより、E-セレクチンと糖鎖との結合に間接的な影響を与えると考えられる。
3. P-セレクチンリガンドの特異的コアタンパク質PSGL-1 (P-selectin glycoprotein ligand-1)
P-セレクチンは、PADGEM (platelet activation-dependent granule external membrane)、GMP-140 (granule membrane protein of 140 kDa)、CD62Pなどの別名があり、血管内皮細胞と活性化血小板に発現し、白血球上の糖鎖リガンドと結合する。炎症における血小板-白血球および血管内皮細胞-白血球の相互作用に関与する。P-セレクチンは血小板のα顆粒や血管内皮細胞のWibel-Palade 顆粒に含まれ、刺激によって細胞表層に移行(トランスロケーション)して発現される。またマウスの血管内皮細胞では、mRNAの誘導によって刺激後数時間後に発現が誘導されるE-セレクチンと類似の機構が存在することも知られている。
研究の初期には、P-セレクチンのリガンドもまたシアリルLewisxやシアリルLewisaであると考えられていた13。E-セレクチンとP-セレクチンのCタイプレクチンドメインは相同性がたしかに高い。しかし、E-セレクチンとP-セレクチンのリガンド特異性には大きな違いがある。固相化したシアリルLewisx への結合能を見ると、E-セレクチンと同等の結合を得るためには、5 倍から10 倍程度の濃度のP-セレクチンを用意しなければならない。P-セレクチンを介した接着は細胞をNaClO3などの硫酸化阻害剤の存在下で培養すると阻止されるのに対し、E-セレクチンを介した接着は影響をうけない。P-セレクチンのリガンド活性はプロテアーゼ処理にきわめて弱いのに対して、E-セレクチンに対するリガンドの結合能はプロテアーゼにほとんど影響されない。こうしたことがきっかけとなって、P-セレクチンリガンドの特異的なコアタンパク質である220 kDaの糖タンパク質PSGL-1 (P-selectin glycoprotein ligand-1)が発見されるに至った。PSGL-1がシアリルLewisx糖鎖を有し、さらにN末端付近のチロシン残基が硫酸化されていることがP-セレクチンへの結合には必須である14-16。P-セレクチンへの結合にはシアリルLewisx糖鎖と硫酸化チロシン残基とが共に必要であるが、E-セレクチンへの結合にはシアリルLewisx糖鎖の存在のみで十分である。また、P-セレクチンへの結合にはPSGL-1が二量体を形成していることも重要とする考え方もある。シアリルLewisx糖鎖を有し、さらにこれらの条件を満たしたPSGL-1とP-セレクチンとの結合親和性はきわめて高く、10-9 M程度のKm値が報告されている。これまで知られたセレクチンリガンドのコアタンパク質のうちで、セレクチンに特異的に要求される事を示す証拠が最も多く集積しているのは、PSGL-1である。ただし、N末端付近に三個存在するチロシン残基については、どのチロシン残基が硫酸化されているかについての特異性には乏しいようであり、この点にまだ曖昧な点が残されている。
4. L-セレクチンを介した細胞接着の特徴
L-セレクチンは、LAM-1 (leukocyte adhesion molecule-1)、LECAM-1 (leukocyte-endothelial cell adhesion molecule-1)、MEL-14抗原 (gp90mel)、CD62Lなどたくさんの別名があり、白血球に構成的に発現されている。L-セレクチンはもともとナイーブTリンパ球の末梢リンパ節へのホーミングに関与する接着分子として記載された17,18。リンパ球のホーミングにあたっては、リンパ節の高血管内皮細静脈 (high endothelial venule, HEV) がホーミングするリンパ球の入り口の役割を演じる。L-セレクチンがリンパ球側に発現しているので、HEV側にはL-セレクチンのリガンド糖鎖が発現していなければならないはずである。以前には、この糖鎖リガンドもシアリルLewisxであると考えられていた。
しかし、このHEV上のL-セレクチンリガンドを普通の抗シアリルLewisx抗体で検出しようとすると、なかなか一筋縄ではいかない19。良く使われる抗シアリルLewisx抗体のうちでHEV上のL-セレクチンリガンドを検出できるのは、ほんの一部の抗体に過ぎず、多くの抗シアリルLewisx抗体がこれを検出できなかったのである19,20。HEV上のL-セレクチンリガンドを検出できる抗シアリルLewisx抗体は、L-セレクチン依存性の細胞接着をも阻害した19。これらの結果は、HEV上のL-セレクチンリガンドが、シアリルLewisx類似の糖鎖ではあるものの、シアリルLewisxそのものではないことを示していた。この結論は、HEVをシアリダーゼ処理しても、抗Lewisx抗体との反応性が出現しないことからも支持された。もしHEV上のL-セレクチンリガンドがふつうのシアリルLewisxであれば、シアリダーゼ処理によって抗Lewisx抗体との反応性をもったLewisx糖鎖がかならず出現するはずだからである。
この謎は、HEVに存在するのが硫酸化修飾をうけたシアリルLewisxであることが判明するに至ってようやく解決した。この硫酸化修飾によって、多くの抗シアリルLewisx抗体や抗Lewisx抗体の反応性が阻害されていたのである。硫酸化修飾によって影響をうけない少数の抗体のみが、HEV上の硫酸化修飾をうけたシアリルLewisxを検出できたわけである。ヒト末梢リンパ節HEV上の硫酸化L-セレクチンリガンドはシアリル6-スルホLewisxと同定された21。一方、マウスのHEV上のL-セレクチンリガンドは、ヒトとは異なり6’-スルホあるいは6,6’-ジスルホ糖鎖であると報告された22,23。ヒトではシアリル6-スルホLewisxは末梢リンパ節のみならず、腸管のパイエル板、虫垂、GALT(gut-associated lymphoreticular tissues)のHEV様血管内皮にも発現している(Fig. 3)。ヒトとマウスで糖鎖リガンドがかなり相違しているわけであるが、フコース転移酵素と6-硫酸基転移酵素の遺伝子を共に導入する事によって細胞にL-セレクチンとの結合性を有するリガンド活性を再構成できることから、どちらの動物種でも、6-硫酸化修飾が重要であると考えられる24。遺伝子導入によって再構成されたリガンドは、およそ60〜120 μm/sec程度のローリング速度での白血球ローリングを引き起こす25が、これは生体内で観察された値26にきわめて近い値である。現在のところ、HEV上のL-セレクチンリガンド合成にかかわる6-硫酸基転移酵素の候補として二種のアイソザイムの遺伝子が得られており27,28、そのうち片方のノックアウトによって、L-セレクチン依存性のリンパ球ホーミングが約50%低下したと報告されている29。
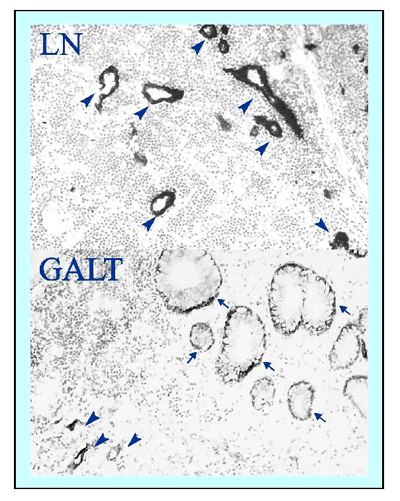
Fig.3
L-セレクチンの特異的リガンド、シアリル6-スルホLewisxの末梢リンパ節(上パネル)およびGALT (gut-associated lymphoreticular tissue、下パネル) HEV様血管における発現。特異抗体G152を用いた免疫組織学的染色の結果を示す。矢頭はHEV様血管におけるシアリル6-スルホLewisxの発現を示し、細い矢印は周辺の腸管上皮細胞における発現を示す。
これまでにL-セレクチンリガンドのコアタンパク質がいくつか報告されている。GlyCAM-1、CD34、Sgp150/>200、ポドカリキシンなどである30-33。 PSGL-1 もまた、L-セレクチンと高親和性の結合をもたらすとされている34-37。PSGL-1は血管内皮細胞には発現していないので、このPSGL-1の意義は、白血球と血管内皮細胞とのあいだの相互作用ではなくて、白血球−白血球相互作用において発揮されると考えられる。これまでのところ、L-セレクチンが特定のコアタンパク質を特異的に要求することを明確に示した例は乏しい。コアタンパク質GlyCAM-1はまだヒトでは見出されていないし、CD34ノックアウトマウスにおいてとくにリンパ球のホーミングが障害されているという記載は見られてない38。こうしたコアタンパク質を持たない細胞でも、フコース転移酵素VIIと6-硫酸基転移酵素の遺伝子を導入しさえすれば、生理的条件下でのL-セレクチン依存性ローリングとほぼ同じ速度でのローリングが観察される。このことは、L-セレクチン依存性接着においてはリガンドの糖鎖部分が本質的な役割を演じていることを示している。もちろんコアタンパク質は、糖鎖の密度や立体構造に影響を与えることにより、L-セレクチンと糖鎖との結合に間接的な影響を与えると考えられる。
5. E-、P-およびL-セレクチンそれぞれの特色あるリガンド特異性
ELISAなどの手法でリコンビナントセレクチンIgの結合を調べると、全てのセレクチンがシアリルLewisxと結合能を持つことが古くから知られている13。この方法を使う限り、シアリル6-スルホLewisxにも全てのセレクチンが結合する39。しかしこうしたELISA法は、生理的には細胞接着を起こさないようなたいへん親和性の低い結合も検出してしまうことが少なくない。そこで我々は、シアリルLewisxとシアリル6-スルホLewisxとの双方を発現し、そのうえPSGL-1も発現しているようなリンパ球系細胞を用いて、まず細胞レベルで三種のセレクチンのリガンド特異性を調べてみた40。すると、E-セレクチンとP-セレクチンのこの細胞への結合は、抗シアリルLewisx抗体でも抗シアリル6-スルホLewisx抗体でも部分的に阻害され、両抗体を同時に与えるとはじめて結合がほぼ完全に阻害された(Fig. 4)。一方、L-セレクチンのこの細胞への結合は抗シアリルLewisx抗体では全く阻害されず、抗シアリル6-スルホLewisx抗体でほぼ完全に阻害された(Fig. 4)40。この結果から、シアリルLewisxとシアリル6-スルホLewisxとはどちらもE-セレクチンとP-セレクチンのリガンドとしてはたらき、L-セレクチンだけは特異的にシアリル6-スルホLewisxを要求することがわかった(Fig. 5)。 抗PSGL-1抗体を加えると、P-セレクチンのこの細胞への結合は完全に阻害されたが、 L-セレクチンの結合はわずかしか阻害されず、E-セレクチンの結合は全く阻害されなかった(Fig. 4) 40。 このことから、以前から提唱されているようにP-セレクチンがPSGL-1を特異的に要求することが再確認された(Fig. 5)。しかしL-セレクチンは、以前から主張されていたほどにはPSGL-1を強く要求しないことがうかがわれた。
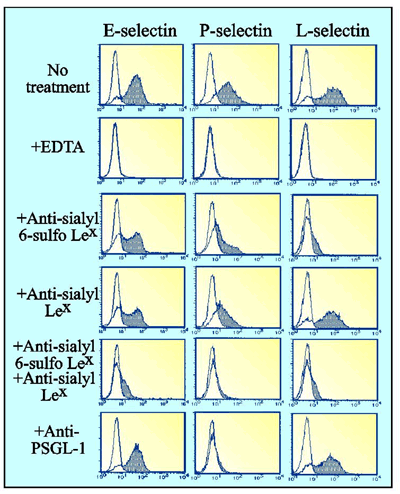
Fig.4 セレクチンの三つのファミリーメンバーのリガンド特異性を示す模式図。
シアリルLewisxとシアリル6-スルホLewisxとの双方を発現し、そのうえPSGL-1も発現しているようなリンパ球系細胞に対するリコンビナントセレクチンIgの結合をフローサイトメトリーで調べた結果を示す40。
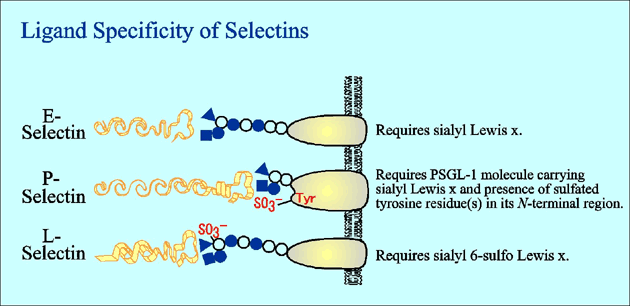
Fig.5 E-、L-およびP-セレクチンの糖鎖およびPSGL-1に対するリガンド特異性の検討の一例。
最近我々は、フコース転移酵素VII、6-硫酸基転移酵素およびPSGL-1遺伝子を三重に導入したCOS7細胞を作製して、この問題をshear flow下の細胞ローリング実験でさらに確かめてみた41。これらの遺伝子を全て導入した細胞は全てのセレクチンのローリングを媒介する能力を持ち、三つのセレクチンのリガンド特異性を比較する上で格好の陽性対照細胞として役だった。三つの遺伝子のうちどれか一つを省いた細胞を作製したり、あるいは変異を導入した機能のない遺伝子と置き換えるなどして、この万能の陽性対照細胞と比較することで細胞接着の変化を詳細に検討した。野生型のPSGL-1を、その最も大切なN末付近のチロシン残基をすべて他のアミノ酸に置換したミュータント型のPSGL-1に置き換えても、L-セレクチン依存性のローリングはほとんど影響を受けなかった。あるいはまた、このN末付近のチロシン残基を含んだ部分をタンパク質分解酵素モカラギンで分解してしまっても、L-セレクチン依存性のローリングはほとんど影響を受けなかった。しかし、6-硫酸基転移酵素を省いて、フコース転移酵素VIIとPSGL-1だけを遺伝子導入した場合には、L-セレクチン依存性のローリングは陽性対照の6 %にまで低下してしまった41。
P-セレクチン依存性のローリングは、PSGL-1をチロシン残基のないミュータント型のPSGL-1に置き換えたり、あるいはモカラギンで分解すると、ほとんど完全に阻害された。逆に、6-硫酸基転移酵素を省いて、フコース転移酵素VIIとPSGL-1の遺伝子だけを導入しても、ローリングは陽性対照とほとんど変わらなかった41。E-セレクチン依存性のローリングは、フコース転移酵素VIIさえ導入されていれば、他の二つの遺伝子の有無にあまり影響されなかった。これらの結果41は、先の結果40と合わせて、三つのセレクチンがそれぞれ異なる独特のリガンド特異性を持っていることを示す。その概要をTable 1に示した。
6. 展望:細胞表面糖鎖のモジュレーションによるセレクチン依存性接着の制御
タンパク質や核酸が生体の維持に必要な機能性分子であることは広く受け入れられているが、糖鎖そのものがそのような意味で第三の機能性分子であるかどうかはまだ広く受け入れられているとは云えず、セレクチンの研究分野でさえも、これまでは重要な生理的意義はむしろコアタンパク質のようなアグリコン部分にあると考えられがちであった。しかし最近の研究の進展により、セレクチンを介した細胞接着の調節には、リガンドの糖鎖部分が主役を演じていることが判明しつつある。これはFunctional Glycomicsの時代の開幕を意味するのかも知れない。
顆粒球や単球はセレクチンリガンドを構成的に発現しているけれども、リンパ球では糖鎖リガンドの発現は活発に変化している。白血球のセレクチンリガンドの合成にはフコース転移酵素Fuc-T VIIとFuc-T IVが関与する。健常人末梢血中のほとんどのリンパ球はシアリルLewisxを発現せず、炎症性刺激によって活性化されて始めて強く発現が誘導され、P-やE-セレクチンに接着するようになる。この変化はフコース転移酵素Fuc-T VIIとFuc-T IVの転写誘導をともなっており、両酵素遺伝子の転写は炎症性サイトカインによってきわめてダイナミックに調節されている42-48。
一方、白血球上のセレクチンリガンドのコアタンパク質としてもっとも重要なPSGL-1は、広範な白血球にはじめから構成的に発現している。シアリルLewisxを発現しているような白血球はほとんど例外なくPSGL-1を発現しているが、PSGL-1を発現する白血球の全てがシアリルLewisx陽性であるわけではない。炎症性刺激によっても、PSGL-1そのものの発現はあまり変化しない。こうした所見は、炎症刺激にともなって白血球のセレクチン結合能が亢進するのは、主としてシアリルLewisx糖鎖の発現誘導によっており、コアタンパク質PSGL-1の発現誘導に依存しているのではない事を示している。近年、PSGL-1の重要なチロシン残基を硫酸化する酵素がクローニングされているが49,50、こうした酵素がP-セレクチン依存性接着を調節していることを示す証拠は、得られていないようである。
炎症の際にもL-セレクチンが白血球-白血球間や白血球-血管内皮細胞間の接着に関与すると考えている研究者もいる35,51。炎症巣における白血球-血管内皮細胞間の接着にL-セレクチンが関与するなら、炎症刺激によって血管内皮細胞上になんらかのL-セレクチンリガンドの発現が誘導されるのでなければならない。6-硫酸基転移酵素の調節機構は今のところまだ良く分かっていないが、少なくとも、炎症性サイトカインの刺激により、一部の6-硫酸基転移酵素には中等度の転写誘導がおこることが観察されている24。
セレクチンを介した細胞接着の調節において糖鎖がきわめて重要な役割を演じていることを示す格好の例としては、糖鎖リガンドのシアル酸部分に起こる独特の翻訳後修飾によって、すみやかに細胞接着能が不活化される調節機構がある。シアル酸はセレクチンの糖鎖リガンド分子の重要な構成成分である。刺激によって細胞内カルシウムイオンの動員が起こると、このシアル酸がサイクリックシアル酸に変えられ、リガンドはセレクチンとの結合能を失ってしまう。この現象ははじめリンパ球系細胞の発現するシアリル6-スルホLewisxについて観察され52、ついで上皮系細胞においても確認された53。セレクチンリガンドの細胞接着能が不活化されるこの反応は、細胞にカルシウムイオノフォアを加えるとすぐに始まって約五分後にはほぼ完了するきわめてすみやかな反応であり、シアル酸シクラーゼと呼ばれる酵素によって触媒されている43,54,55。このようなすみやかな糖鎖の構造変化はこれまで知られていなかったし、しかもこの構造変化が、細胞接着にかかわる重要な生理的機能の変化をもたらすわけであるから、糖鎖が生体の重要な機能性分子であることがこの例からたいへん良く理解されるであろう。
Suggested Readings
- Hakomori SI: Inaugural Article, The glycosynapse. Proc. Natl. Acad. Sci. USA, 99: 225-232, 2002.
- Kunkel EJ, Butcher EC: Chemokines and the tissue-specific migration of lymphocytes. Immunity, 16:1-4, 2002.
- Cummings RD: Chapter 26, Selectins. In "Essentials of Glycobiology" edited by Varki A, Cummings RD, Esko J, Freeze H, Hart G, Marth J: Cold Spring Harbor Laboratory Press, N.Y., pp. 391-415, 1999.
References
- Kannagi, R. Carbohydrate determinants involved in inflammation and homing of lymphocytes. In Glycoword – Glycopathology, ed. by Kusunoki, S., https://www.glycoforum.gr.jp/glycoword/glycopathology/GD-A07J.html, Sept. 15, 2000.
- Lowe JB, Stoolman LM, Nair RP, Larsen RD, Berhend TL, Marks RM: ELAM-1-dependent cell adhesion to vascular endothelium determined by a transfected human fucosyltransferase cDNA. Cell, 63, 475-484, 1990
- Phillips ML, Nudelman E, Gaeta FC, Perez M, Singhal AK, Hakomori S, Paulson JC: ELAM-1 mediates cell adhesion by recognition of a carbohydrate ligand, sialyl-Lex. Science, 250, 1130-1132, 1990
- Walz G, Aruffo A, Kolanus W, Bevilacqua M, Seed B: Recognition by ELAM-1 of the sialyl-Lex determinant on myeloid and tumor cells. Science, 250, 1132-1135, 1990
- Takada A, Ohmori K, Takahashi N, Tsuyuoka K, Yago K, Zenita K, Hasegawa A, Kannagi R: Adhesion of human cancer cells to vascular endothelium mediated by a carbohydrate antigen, sialyl Lewis A. Biochem. Biophys. Res. Commun., 179, 713-719, 1991
- Berg EL, Robinson MK, Mansson O, Butcher EC, Magnani JL: A carbohydrate domain common to both sialyl Lea and sialyl Lex is recognized by the endothelial cell leukocyte adhesion molecule ELAM-1. J. Biol. Chem., 266, 14869-14872, 1991
- Kannagi R: Carbohydrate-mediated cell adhesion involved in hematogenous metastasis of cancer. Glycoconjugate J., 14, 577-584, 1997
- Stroud MR, Handa K, Salyan ME, Ito K, Levery SB, Hakomori S, Reinhold BB, Reinhold VN: Monosialogangliosides of human myelogenous leukemia HL60 cells and normal human leukocytes. 2. Characterization of E-selectin binding fractions, and structural requirements for physiological binding to E-selectin. Biochemistry, 35, 770-778, 1996
- Stroud MR, Handa K, Salyan ME, Ito K, Levery SB, Hakomori S, Reinhold BB, Reinhold WN: Monosialogangliosides of human myelogenous leukemia HL60 cells and normal human leukocytes. 1. Separation of E-selectin binding from nonbinding gangliosides, and absence of sialosyl-Lex having tetraosyl to octaosyl core. Biochemistry, 35, 758-769, 1996
- Handa K, Stroud MR, Hakomori S: Sialosyl-fucosyl poly-LacNAc without the sialosyl-Lex epitope as the physiological myeloid cell ligand in E-selectin-dependent adhesion: studies under static and dynamic flow conditions. Biochemistry, 36, 12412-12420, 1997
- Picker LJ, Warnock RA, Burns AR, Doerschuk CM, Berg EL, Butcher EC: The neutrophil selectin LECAM-1 presents carbohydrate ligands to the vascular selectins ELAM-1 and GMP-140. Cell, 66, 921-933, 1991
- Steegmaier M, Levinovitz A, Isenmann S, Borges E, Lenter M, Kocher HP, Kleuser B, Vestweber D: The E-selectin-ligand ESL-1 is a variant of a receptor for fibroblast growth factor. Nature, 373, 615-620, 1995
- Foxall C, Watson SR, Dowbenko D, Fennie C, Lasky LA, Kiso M, Hasegawa A, Asa D, Brandley BK: The three members of the selectin receptor family recognize a common carbohydrate epitope, the sialyl Lewisx oligosaccharide. J. Cell Biol., 117, 895-902, 1992
- De Luca M, Dunlop LC, Andrews RK, Flannery JV, Jr. Ettling R, Cumming DA, Veldman M, Berndt MC: A novel cobra venom metalloproteinase, mocarhagin, cleaves a 10-amino acid peptide from the mature N terminus of P-selectin glycoprotein ligand receptor, PSGL-1, and abolishes P-selectin binding. J. Biol. Chem., 270, 26734-26737, 1995
- Pouyani T, Seed B: PSGL-1 recognition of P-selectin is controlled by a tyrosine sulfation consensus at the PSGL-1 amino terminus. Cell, 83, 333-343, 1995
- Sako D, Comess KM, Barone KM, Camphausen RT, Cumming DA, Shaw GD: A sulfated peptide segment at the amino terminus of PSGL-1 is critical for P-selectin binding. Cell, 83, 323-331, 1995
- Gallatin WM, Weissman IL, Butcher EC: A cell-surface molecule involved in organ-specific homing of lymphocytes. Nature, 304, 30-34, 1983
- Geoffroy JS, Rosen SD: Demonstration that a lectin-like receptor (gp90MEL) directly mediates adhesion of lymphocytes to high endothelial venules of lymph nodes. J. Cell Biol., 109, 2463-2469, 1989
- Sawada M, Takada A, Ohwaki I, Takahashi N, Tateno H, Sakamoto J, Kannagi R: Specific expression of a complex sialyl Lewis X antigen on high endothelial venules of human lymph nodes: Possible candidate for L-selectin ligand. Biochem. Biophys. Res. Commun., 193, 337-347, 1993
- Mitsuoka C, Kawakami-Kimura N, Kasugai-Sawada M, Hiraiwa N, Toda K, Ishida H, Kiso M, Hasegawa A, Kannagi R: Sulfated sialyl Lewis X, the putative L-selectin ligand, detected on endothelial cells of high endothelial venules by a distinct set of anti-sialyl Lewis X antibodies. Biochem. Biophys. Res. Commun., 230, 546-551, 1997
- Mitsuoka C, Sawada-Kasugai M, Ando-Furui K, Izawa M, Nakanishi H, Nakamura S, Ishida H, Kiso M, Kannagi R: Identification of a major carbohydrate capping group of the L-selectin ligand on high endothelial venules in human lymph nodes as 6-sulfo sialyl Lewis X. J. Biol. Chem., 273, 11225-11233, 1998
- Hemmerich S, Rosen SD: 6'-sulfated sialyl Lewis x is a major capping group of GlyCAM-1. Biochemistry, 33, 4830-4835, 1994
- Hemmerich S, Leffler H, Rosen SD: Structure of the O-glycans in GlyCAM-1, an endothelial-derived ligand for L-selectin. J. Biol. Chem., 270, 12035-12047, 1995
- Kimura N, Mitsuoka C, Kanamori A, Hiraiwa N, Uchimura K, Muramatsu T, Tamatani T, Kansas GS, Kannagi R: Reconstitution of functional L-selectin ligands on a cultured human endothelial cell line by co-transfection of α1→3 fucosyltransferase VII and newly cloned GlcNAcβ: 6-sulfotransferase cDNA. Proc. Natl. Acad. Sci. USA, 96, 4530-4535, 1999
- Uchimura K, El-Fasakhany FM, Hori M, Hemmerich S, Blink SE, Kansas GS, Kanamori A, Kumamoto K, Kannagi R, Muramatsu T: Specificities of N-acetylglucosamine-6-O-sulfotransferases in relation to L-selectin ligand synthesis and tumor-associated enzyme expression. J. Biol. Chem., 277, 3979-3984, 2002
- Stein JV, Cheng G, Stockton BM, Fors BP, Butcher EC, von Andrian UH: L-selectin-mediated leukocyte adhesion in vivo: microvillous distribution determines tethering efficiency, but not rolling velocity. J. Exp. Med., 189, 37-50, 1999
- Uchimura K, Muramatsu H, Kadomatsu K, Fan QW, Kurosawa N, Mitsuoka C, Kannagi R, Habuchi O, Muramatsu T: Molecular cloning and characterization of an N-acetylglucosamine-6-O-sulfotransferase. J. Biol. Chem., 273, 22577-22583, 1998
- Bistrup A, Bhakta S, Lee JK, Belov YY, Gunn MD, Zuo F-R, Huang C-C, Kannagi R, Rosen SD, Hemmerich S: Sulfotransferases of two specificities function in the reconstitution of high endothelial cell ligands for L-selectin. J. Cell Biol., 145, 899-910, 1999
- Hemmerich S, Bistrup A, Singer MS, Van Zante A, Lee JK, Tsay D, Peters M, Carminati JL, Brennan TJ, Carver-Moore K, Leviten M, Fuentes ME, Ruddle NH, Rosen SD: Sulfation of L-selectin ligands by an HEV-restricted sulfotransferase regulates lymphocyte homing to lymph nodes. Immunity, 15, 237-247, 2001
- Lasky LA, Singer MS, Dowbenko D, Imai Y, Henzel WJ, Grimley C, Fennie C, Gillett N, Watson SR, Rosen SD: An endothelial ligand for L-selectin is a novel mucin-like molecule. Cell, 69, 927-938, 1992
- Baumhueter S, Singer MS, Henzel W, Hemmerich S, Renz M, Rosen SD, Lasky LA: Binding of L-selectin to the vascular sialomucin CD34. Science, 262, 436-438, 1993
- Derry CJ, Faveeuw C, Mordsley KR, Ager A: Novel chondroitin sulfate-modified ligands for L-selectin on lymph node high endothelial venules. Eur. J. Immunol., 29, 419-430, 1999
- Sassetti C, Tangemann K, Singer MS, Kershaw DB, Rosen SD: Identification of podocalyxin-like protein as a high endothelial venule ligand for L-selectin: Parallels to CD34. J. Exp. Med., 187, 1965-1975, 1998
- Spertini O, Cordey AS, Monai N, Giuffr? L, Schapira M: P-selectin glycoprotein ligand 1 is a ligand for L-selectin on neutrophils, monocytes, and CD34+ hematopoietic progenitor cells. J. Cell Biol., 135, 523-531, 1996
- Walcheck B, Moore KL, McEver RP, Kishimoto TK: Neutrophil-neutrophil interactions under hydrodynamic shear stress involve L-selectin and PSGL-1. A mechanism that amplifies initial leukocyte accumulation on P-selectin in vitro. J. Clin. Invest., 98, 1081-1087, 1996
- Guyer DA, Moore KL, Lynam EB, Schammel CMG, Rogelj S, McEver RP, Sklar LA: P-selectin glycoprotein ligand-1 (PSGL-1) is a ligand for L-selectin in neutrophil aggregation. Blood, 88, 2415-2421, 1996
- Tu L, Chen A, Delahunty MD, Moore KL, Watson SR, McEver RP, Tedder TF: L-selectin binds to P-selectin glycoprotein ligand-1 on leukocytes ミ Interactions between the lectin, epidermal growth factor, and consensus repeat domains of the selectins determine ligand binding specificity. J. Immunol., 157, 3995-4004, 1996
- Tu L, Delahunty MD, Ding H, Luscinskas FW, Tedder TF: The cutaneous lymphocyte antigen is an essential component of the L-selectin ligand induced on human vascular endothelial cells. J. Exp. Med., 189, 241-252, 1999
- Yoshino K, Ohmoto H, Kondo N, Tsujishita H, Hiramatsu Y, Inoue Y, Kondo H: Studies on selectin blockers. 4. Structure-function relationships of sulfated sialyl Lewis X hexasaccharide ceramides toward E-, P-, and L-selectin binding. J. Med. Chem., 40, 455-462, 1997
- Ohmori K, Kanda K, Mitsuoka C, Kanamori A, Kurata-Miura K, Sasaki K, Nishi T, Tamatani T, Kannagi R: P- and E-Selectins recognize sialyl 6-sulfo Lewis X, the recently-identified L-selectin ligand. Biochem. Biophys. Res. Commun., 278, 90-96, 2000
- Kanamori A, Kojima N, Uchimura K, Muramatsu T, Tamatani T, Berndt MC, Kansas GS, Kannagi R: Distinct sulfation requirements of selectins disclosed using cells which support rolling mediated by all three selectins under shear flow: L-SELECTIN PREFERS CARBOHYDRATE 6-SULFATION TO TYROSINE SULFATION WHEREAS P-SELECTIN DOES NOT. J. Biol. Chem., 277: in press, 2002
- Hiraiwa N, Hiraiwa M, Kannagi R: Human T-cell leukemia virus-1 encoded Tax protein transactivates α1→3 fucosyltransferase Fuc-T VII, which synthesizes sialyl Lewis X, a selectin ligand expressed on adult T-cell leukemia cells. Biochem. Biophys. Res. Commun., 231, 183-186, 1997
- Kannagi R: Transcriptional regulation of expression of carbohydrate ligands for cell adhesion molecules in the selectin family, in Wu AM. (ed): Advances in Experimental Medicine and Biology, Volume 491, Molecular Immunology of Complex Carbohydrates II. New York, Plenum Press, 2001, pp 267-278
- Kannagi R: Regulatory roles of carbohydrate ligands for selectins in homing of lymphocytes. Curr. Opin. Struct. Biol., 12, in press, 2002
- Wagers AJ, Stoolman LM, Kannagi R, Craig R, Kansas GS: Expression of leukocyte fucosyltransferases regulates binding to E-selectin: relationship to previously implicated carbohydrate epitopes. J. Immunol., 159, 1917-1929, 1997
- Knibbs RN, Craig RA, Natsuka S, Chang A, Cameron M, Lowe JB, Stoolman LM: The fucosyltransferase FucT-VII regulates E-selectin ligand synthesis in human T cells. J. Cell Biol., 133, 911-920, 1996
- White SJ, Underhill GH, Kaplan MH, Kansas GS: Cutting edge: differential requirements for Stat4 in expression of glycosyltransferases responsible for selectin ligand formation in Th1 cells. J. Immunol., 167, 628-631, 2001
- Wagers AJ, Kansas GS: Potent induction of α (1,3)-fucosyltransferase VII in activated CD4+ T cells by TGF-β1 through a p38 mitogen-activated protein kinase-dependent pathway. J. Immunol., 165, 5011-5016, 2000
- Ouyang Y, Lane WS, Moore KL: Tyrosylprotein sulfotransferase: purification and molecular cloning of an enzyme that catalyzes tyrosine O-sulfation, a common posttranslational modification of eukaryotic proteins. Proc. Natl. Acad. Sci. USA, 95, 2896-2901, 1998
- Ouyang YB, Moore KL: Molecular cloning and expression of human and mouse tyrosylprotein sulfotransferase-2 and a tyrosylprotein sulfotransferase homologue in Caenorhabditis elegans. J. Biol. Chem., 273, 24770-24774, 1998
- Walcheck B, Kahn J, Fisher JM, Wang BB, Fisk RS, Payan DG, Feehan C, Betageri R, Darlak K, Spatola AF, Kishimoto TK: Neutrophil rolling altered by inhibition of L-selectin shedding in vitro. Nature, 380, 720-723, 1996
- Mitsuoka C, Ohmori K, Kimura N, Kanamori A, Komba S, Ishida H, Kiso M, Kannagi R: Regulation of selectin binding activity by cyclization of sialic acid moiety of carbohydrate ligands on human leukocytes. Proc. Natl. Acad. Sci. USA, 96, 1597-1602, 1999
- Izawa M, Kumamoto K, Mitsuoka C, Kanamori C, Kanamori A, Ohmori K, Ishida H, Nakamura S, Kurata-Miura K, Sasaki K, Nishi T, Kannagi R: Expression of sialyl 6-sulfo Lewis X is inversely correlated with conventional sialyl Lewis X expression in human colorectal cancer. Cancer Res., 60, 1410-1416, 2000
- Kannagi R, Kanamori A: Glycobiology of sialyl 6-sulfo Lewis X, a new carbohydrate ligand for selectins. Trends Glycosci. Glycotechnol., 11, 329-344, 1999
- Kannagi R, Mitsuoka C, Ohmori K, et al: Cyclic sialic acid: a new regulatory mechanism of selectin ligand activity, in Inoue Y, Lee YC, Troy FA. (eds): Sialobiology and Other Novel Forms of Glycosylation. Osaka, Japan, Gakushin Publisher, 1999, pp 37-43