
氏名:佐藤 ちひろ
1992年東京大学大学院理学系研究科生物化学科卒業。1997年東京大学大学院理学系研究科生物化学専攻博士課程修了。1996年-1998年および1998年-2001年日本学術振興会特別研究員(北島 健博士に師事)。2001年研究機関研究員(生物分子応答研究センター)を経て、現在名古屋大学大学院生命農学研究科応用生命化学講座助手。現在の研究テーマはジ・オリゴ・ポリシアル酸の生物学的機能の解析。

氏名:北島 健
1987年:東京大学大学院理学系研究科生物化学科卒業。1987年:博士(理学)取得。1987年〜1989年:日本学術振興会特別研究員。1989年〜1996年東京大学理学部助手。1996年〜2000年:名古屋大学大学院生命農学研究科助教授。現在:名古屋大学生物分子応答研究センター助教授。
1999年日本糖質学会奨励賞受賞
シアル酸は、N-アセチルノイラミン酸 (Neu5Ac)、N-グリコリルノイラミン酸 (Neu5Gc)、デアミノノイラミン酸 (KDN; 2-ケト-3-デオキシ-D-グリセロ-D-ガラクト-ノノン酸) のアセチル化、硫酸化、メチル化、ラクチル化あるいはラクトン形成などに起因する置換体とあわせてほぼ40種類からなる酸性糖の総称である (図1)。
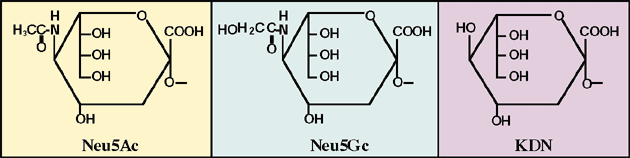
図 1 シアル酸の構造
大抵の場合、シアル酸は糖タンパク質や糖脂質において糖鎖の非還元末端部位にモノシアリル基として存在しており、リガンド-受容体および細胞-細胞間相互作用に重要な役割を果たしていることが知られている。
またシアル酸は、シアル酸同士が縮重合したシアル酸重合体を形成する場合がある。8-200程度の重合度 (DP)をもつポリシアル酸糖鎖エピトープは、その構成シアル酸の種類 (Neu5Ac, Neu5Gc, KDN) や内部シアル酸の結合位置の違い (α2→ height="12">5Oglycolyl, α2→8, α2→9, α2→8/9)によって多様な構造を呈する (図2)。
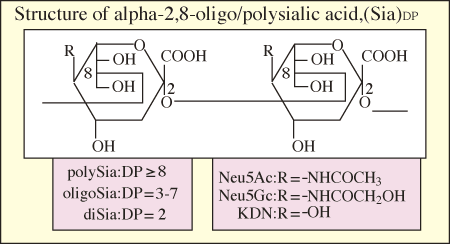
図 2 α2→8-結合ポリシアル酸構造
脳に存在する神経細胞接着分子 (NCAM) はポリシアル酸含有糖タンパク質の中で最も詳細に研究されている分子である。ポリシアル酸構造をもつNCAMは胎児の脳に多量に発現しており、成人の脳へ分化するとNCAMの量は変わらないが、そのポリシアリル化の度合いが激減する。しかし、成人の脳においても、神経系の再構築が活発に行われている嗅球と海馬ではポリシアリル化NCAMが存在している。現在、N-CAMにおける α2→8 結合ポリシアル酸構造は、NCAM同士の強固な接着を防ぐことによって、正常な神経の構築を司る重要な調節因子であると考えられている(図3)。
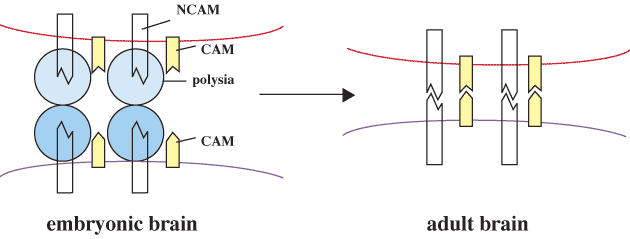
図 3 ポリシアル酸の機能
またポリシアル酸エピトープは癌胎児性抗原として多くのヒト癌細胞にも再発現し、腫瘍マーカーとして広く認知されている。
最近、糖タンパク質上に、シアル酸が2-7残基程度までからなるユニークなジ・オリゴシアル酸構造が、近年開発された高感度の化学的検出法と、免疫化学的手法を適用することによって、従来認識されている以上に広く存在していることがわかってきた。シアル酸が2残基、タンデムに連なったα2→8結合ジシアル酸構造はガングリオシドではよく見られる構造単位であり、細胞接着、細胞分化、シグナル伝達など、多くの生物学的機能を果たしていることが知られているが、糖タンパク質上のジ・オリゴシアル酸構造の機能は不明のままであった。そこでここではこれまで明らかになっている糖タンパク質上のジ・オリゴシアル酸の検出、存在、その生合成および機能について簡単に言及する。
蛍光C7/C9分析
α2→8結合N-アシルノイラミン酸 (Neu5Acyl)のオリゴ・ポリマー構造を過ヨウ素酸酸化すると、非還元末端残基のグリセロール側鎖は酸化され骨格炭素が2つ少ないN-アシルノイラミン酸のC7-アナログを生じる。つまりNeu5AcおよびNeu5GcからそれぞれC7(Neu5Ac) (5-アセトアミド-3,5-ジデオキシ-L-アラビノ-2-ヘプツロソン酸)またはC7(Neu5Gc) (5-ヒドロキシアセトアミド-3,5-ジデオキシ-L-アラビノ-ヘプツロソン酸) が生じる。一方、内部の残基はインタクトなNeu5Ac (C9(Neu5Ac)) または Neu5Gc (C9(Neu5Gc)) のままである。したがって過ヨウ素酸酸化物においてC9化合物が検出されるということは、その試料に、内部のα2→8結合N-アシルノイラミン酸残基の存在、すなわちオリゴシアル酸鎖の存在を強く示唆する。αケト酸を特異的に標識する試薬である1,2-ジアミノ4,5-メチレンジオキシベンゼン (DMB)で蛍光標識したC7化合物およびC9化合物は、逆相高速液体クロマトグラフィー(HPLC) で分離・定量される。この方法で少なくとも1 ngのα2→8結合オリゴ・ポリシアル酸鎖を定量することができる。この蛍光C7/C9分析はPVDF膜にブロットした糖タンパク質にも適用できる。
緩和酸水解-蛍光HPLC分析
オリゴ・ポリシアル酸鎖の緩和酸水解によって産生される一連のオリゴ・ポリマーをDMBを用いて直接ラベルし、陰イオン交換HPLCによって分析する。この方法は、複合糖質中に見いだされる構成シアル酸、内部シアル酸の結合様式、重合度(DP)が異なる様々な種類のシアル酸オリゴ・ポリマーに適用できる。ジシアル酸の検出限界は13 fmolであった。この方法は、SDS-PAGEで分離し、PVDF膜にブロットした非常に微量な試料にも適用できる。
ここでは高感度検出法を紹介したが他にもいくつかの検出方法があるので他書を参照されたい。
ジ・オリゴ・ポリシアル酸構造を特異的に認識する抗体による検出
多くの糖鎖エピトープの構造的、機能的研究に抗体は有用である。しかしそのためには抗体の特異性の厳密な理解が必要である。これまでに開発された抗体の特異性を、一連の重合度をもつ共通な合成脂質結合ジ・オリゴ・ポリシアロ糖抗原を用いて精密に調べることによって、抗体認識に必要な重合度と非還元末端残基の必要性に基づいて、3つのグループに分けることができる(Table)。実際、これらの抗体を用いて、未知試料の重合度を予測することが可能である。
グループ I抗体は、DPが8以上の長く伸長したポリシアル酸鎖を認識する“抗ポリシアル酸抗体”である。これらの抗体はポリシアル酸構造の内部領域のシアル酸残基によって形成されるヘリックス構造を認識する。非還元末端は抗体の認識に関与しない。グループ II抗体はDP 2-7のオリゴシアル酸とポリシアル酸鎖の両方を認識する“抗オリゴ+ポリシアル酸抗体”である。これらの抗体は非還元末端を含むオリゴ・ポリシアル酸構造の末端部位を認識する。グループIII抗体はDP 2-4のジ・オリゴシアル酸のみを認識し、ポリシアル酸を認識しない“抗オリゴシアル酸抗体”である。これらの抗体はDP 2-4のオリゴシアル酸の特異的立体構造を認識することがわかっている。
Table Classification of anti-di/oligo/polySia antibodies
|
Name oftd
antibody
|
Animal origin a)
andtd
Ig-type b)
|
Specificity ontd
Sia
|
Specificity ontd
DP
|
| <Group I> anti-polySia antibody | |||
| H.46 | ho, poly, IgM | Neu5Ac | DP≥8 |
| 735 | mo, mono, IgG2a | Neu5Ac | DP≥11 |
| <Group II> anti-oligo+polySia antibody | |||
| 12E3 | mo, mono, IgM | Neu5Ac | DP≥5 |
| OL.28 | mo, mono, IgM | Neu5Ac | DP≥4 |
| 2-4B | mo, mono, IgM | Neu5Gc | DP≥2 |
| kdn8kdn | mo, mono, IgM | KDN | DP≥2 |
| <Gropu III >anti-oligoSia antibody | |||
| S2-566 | mo, mono, IgM | Neu5Ac | DP=2 c) |
| AC1 | mo, mono, IgG3 | Neu5Gc | DP= 2-4 |
エンドシアリダーゼはα2→8結合ポリシアル酸構造の検出、あるいはポリシアル酸のみを特異的に消失させることを可能にするプローブである。Endo-Nと言われているバクテリオファージK1F由来の可溶性酵素は以下の反応を触媒する:
(→8Neu5Acylα2→)n-X (n>5) → (→8Neu5Acylα2→)2-4 + (→8Neu5Acylα2→)2-X
バクテリオファージK1F由来のEndo-Nの他に、基質特異性が異なる二種類のエンドシアリダーゼが現在までに見つかっている。ひとつはEndo-NE であり、もうひとつは別種のバクテリオファージ由来のエンドシアリダーゼである。切断に必要な最少重合度はそれぞれDP≥11、DP≥3であると報告されている。
またエキソシアリダーゼの中にもシアル酸の結合様式特異的な切断を行うシアリダーゼが販売されており、α2,3-結合とα2,6-結合を特異的に切断するシアリダーゼとα2,3-結合、α2,6-、α2,8-結合を区別しないシアリダーゼを組み合わせることにより、α2,8-結合シアル酸構造の存在を特定することが可能となる。
ラット脳や他の組織におけるα2→8結合ジシアル酸構造は、1977年に初めてFinneらによって報告された。その後、いくつかのジシアル酸含有糖タンパク質が哺乳動物において報告されている。ウシ副腎髄質のクロマフィン顆粒中のクロモグラニン糖ペプチド上のO-型糖鎖、ヒト赤血球グリコフォリンのO-型糖鎖、臍帯血赤血球のバンド3タンパク質のN-型糖鎖である。最近、α2→8結合ジシアル酸残基がニジマス体腔液由来の糖タンパク質上、ラットT細胞上の100 kDa糖タンパク質に見出されている。さらに著者らは上述の高感度な検出方法を用いることによって、哺乳動物の種々の臓器にジシアル酸含有糖タンパク質の存在を明らかにしている。哺乳動物の脳においては、ある特定の脳局在糖タンパク質がジ・オリゴシアル酸構造をもつ。また、ウシ胎児血清中よりフェツイン、α2-マクログロブリン、adipoQ上にもdiSia構造が存在する。また、ヒト白血病細胞 (HL60)、ヒトテラトカルシノーマ細胞 (PA1)、マウス神経芽細胞(Neuro2A)、マウス筋繊維芽細胞 (C2C12)、マウス前脂肪細胞 (3T3-L1)においてもジ・オリゴシアル酸含有糖タンパク質が検出され、ある糖タンパク質上では、この糖鎖エピトープの発現が分化前後で制御されている。さらに最近の発見として、ヒトメラノーマ細胞のインテグリンα5サブユニットにオリゴシアル酸が結合していることが明らかにされている。
現在知られているα2→8結合以外のジ・オリゴシアル酸構造としてα2→5Oglycolyl結合やα2→9結合がある。前者はウニ卵350kDaの精子結合タンパク質上に存在し、その非還元末端のNeu5Gc残基は9-O-硫酸化されている。後者はヒトテラトカルシノーマ細胞に報告されている。
糖タンパク質上のα2→8結合ジ・オリゴシアル酸の発現は糖タンパク質の分子種に特異的であり、細胞種や組織、また発生段階あるいは分化に特異的である。したがって、これらのシアロ糖鎖エピトープの生合成は厳密に制御されているはずである。これまでにいくつかのグループによってα2→8結合シアル酸を合成するシアル酸転移酵素がクローニングされ、複合糖質上のジ・オリゴ・ポリシアル酸の生合成に関わる酵素が出そろってきた。ポリシアル酸鎖の生合成にはSTXとPSTが共に深く関わっていることが明らかにされているが、現時点でジ・オリゴシアル酸の生合成経路は解明されていない。N-CAMや魚卵PSGP上のポリシアル酸鎖の生合成の研究から、ジ・オリゴシアル酸糖鎖エピトープの生合成の解明への多くの手がかりを得ることが可能であろう。しかしながらこれまでの研究からST8SiaIIIが糖タンパク質上のジ・オリゴシアル酸の生合成に関わっている可能性も高い。ただし、ごく最近ではヒトの血中にトランスシアリダーゼ活性が検出され、α2→8-結合シアル酸構造を作り出すことが明らかにされており、この様な活性によってジ・オリゴシアル酸が生合成される可能性も出てきている。
α2→8結合KDN、α2→5Oglycolyl結合Neu5Gc およびα2→9結合Neu5Ac の生合成に関わる酵素についてはまだ全くわかっていない。アセチル化、ラクチル化、硫酸化、メチル化、ラクトン化のようなシアル酸残基の修飾反応を触媒する酵素も完全に同定されるには至っていない。
α2→8結合ポリシアル酸鎖は哺乳動物において胎児型N-CAMに結合しており、その重合度は成体脳になるとオリゴシアル酸構造へと劇的に変化することが知られている。著者らはブタ脳におけるジ・オリゴシアル酸含有糖タンパク質の発生に伴う変化を解析し、二つのことを明らかにしている。第一は、哺乳動物における共通の特徴であり、胎児脳N-CAMが長いポリシアリル基をもつのに対して、成体脳N-CAMはジ・オリゴシアル酸鎖をもつことである。第二に、成体脳においても胎児脳においてもN-CAMの他にもいくつかの糖タンパク質がα2→8結合ジシアル酸糖鎖エピトープを持ち、これらのジシアル酸含有糖タンパク質は胎児脳に比べて成体脳で発現が増加していることである。このように糖タンパク質上のジ・オリゴ・ポリシアル酸糖鎖エピトープの発現には、神経系の発達段階において2つの大きな流れが存在する。つまり、N-CAM上のポリシアル酸鎖がジ・オリゴシアル酸鎖へと変化する流れと、特定の数種の糖タンパク質上のジシアル酸糖鎖エピトープが増加する流れである。ポリシアル酸鎖は神経突起伸長やシナプス形成において、ポリアニオン同士の反接着作用によって、N-CAMが関与する細胞間相互作用を負の方向へ制御することが知られている。発生過程でN-CAM上のポリシアル酸鎖がジ・オリゴシアル酸鎖へ変化するということは、ポリシアル酸による反接着作用を解除することになり、それによってN-CAM同士のホモフィリックな結合活性の上昇を引き起こし、結果として、神経細胞同士の接着を引き起こすことになる。一方、成体脳における糖タンパク質上のジシアル酸糖鎖エピトープの増加は、このエピトープの機能的重要性も示唆している。たとえば、ジシアル酸糖鎖エピトープが、それに対して特異的な認識分子を通して、細胞-細胞間、細胞-リガンド間相互作用を媒介する可能性が考えられる。ガングリオシドにおけるα2→8結合ジシアル酸鎖の場合には、神経突起伸長をはじめ、細胞接着、分化、シグナル伝達において機能することがよく知られている。ごく最近、著者らは神経突起伸長に糖タンパク質上のジシアル酸エピトープが重要であることを見出している。したがって、糖タンパク質におけるジ・オリゴシアル酸構造がガングリオシドで提唱されているような機能の一部を担っている可能性が高いといえる。
筆者らは最近、ウシ血清中のフェツイン、α2マクログロブリン(α2M)、およびadipo Q(Adiponectin, ACRP30)がジシアル酸含有糖タンパク質であることを証明している。しかしながら、フェツインの1%、α2Mの4%、adipo Qの数%にジシアル酸構造が存在しており、全分子にジシアル酸構造が存在するわけではない。これらの糖タンパク質は恒常的に発現されているが、発生段階や生理学的変化に呼応して生合成されるごく一部の分子だけがα2→8結合ジシアル酸を発現することによって、このようなことが起こると考えられる。α2Mやadipo Qの血中レベルが、生理学的な変化によって変動するという事実は注目に値する。また、興味深いことにジシアル酸構造をもつα2Mのほとんどは170kDaポリペプチド鎖に切断がおこり、110kDaおよび60 kDaのポリペプチド鎖を生じている。α2Mのこの種の切断は普通、炎症時などで誘起されるある種のプロテアーゼ活性をα2Mが抑える際に起こることが知られている。そのため、α2M上のジシアル酸構造は炎症反応の際にα2Mの機能を制御している可能性が考えられる。同様に、フェツインやadipo Qにおいても、ジシアル酸鎖がこれらの血清糖タンパク質の生理学的役割を制御しているかも知れない。近年、シアル酸を認識する免疫グロブリン様レクチン(シグレク)が血球上や血清中に多数種存在していることが注目されている。現在までにシグレクは11種類同定されているが、その中でシグレク-7はジシアル酸構造に強い親和性を、シグレク-1と5は弱い親和性を持つことが明らかになっている。このことは、ジシアル酸含有複合糖質との相互作用を考える上で興味深い。
T細胞の活性化において、ガングリオシドがシグナル伝達経路に関与していることが知られている。T細胞の活性化はT細胞受容体を刺激することによって引き起こされるためT細胞受容体の一部であるCD3に対する抗体の架橋作用で活性化が引き起こされるが、この活性化はCD4抗体と共存して架橋すると、さらに効果的である。最近、ラットT細胞に抗ガングリオシド抗体であるAC1 (α2→8結合diNeu5Gc特異的)と抗CD4抗体をともに作用させると、著しい活性化がみられるが、どちらか一方の抗体のみを作用させたときはラットT細胞の活性化が弱いという事実が明らかになった。興味深いことはラットT細胞において、AC1エピトープは糖脂質の (Neu5Gc)GD1cおよび100kDa糖タンパク質の共通抗原であるという点である。すなわち、CD4と糖脂質上だけでなく糖タンパク質上にも存在するdiNeu5Gc糖鎖エピトープがT細胞活性化の調節経路に関与することを強く示唆している。
ヒトメラノーマ細胞に存在するインテグリンα5サブユニットに、オリゴシアル酸構造が存在することが明らかになっている。インテグリンは、フィブロネクチンの受容体であることが知られている。インテグリンα5上のオリゴシアル酸のフィブロネクチンへの関与を、結合特異的シアリダーゼと特異抗体を用いて調べたところ、インテグリンα5上のオリゴシアル酸構造の存在により、フィブロネクチン高親和性高次構造が維持され、その結果、インテグリンα5β1のフィブロネクチンへの接着を促していることが示された。また、これとは別に、ジシアリルガングリオシド(GT1bとGD3)はα5サブユニットのハイマンノース糖鎖と相互作用し、上皮細胞とフィブロネクチンの相互作用を調節している可能性も示されている。このように、細胞と細胞外マトリックスとのインテグリンを介した相互作用にもジ・オリゴシアル酸が密接に関わっているのである。
ニジマス卵巣および体腔液においては、いくつかの糖タンパク質がジシアル酸、オリゴシアル酸、ポリシアル酸糖鎖エピトープを持つことが知られている。ニジマス卵巣PSGPにおけるオリゴ・ポリシアル酸鎖は、受精時の卵活性化とそれに続く一連の反応を推進することに役立っているだけでなく、発生途上の胚の物理的保護や、微生物の侵入防御にも関わっている。ニジマス卵体腔液におけるα2→8結合ジシアル酸含有糖タンパク質やKDN-gp上のα2→8結合ジ・オリゴシアル酸鎖の機能は不明であるが、生物学的防御、精子-卵相互作用に関与すると推定されている。α2→8結合オリゴ・ポリシアル酸鎖はカルシウムイオンに対して比較的高い結合活性を持つことが知られており、この事実は、カルシウムイオンが受精や発生の過程のリガンドと受容体の結合および一連の酵素反応において重要であることが知られている点からも注目に値する。
ウニ卵ではα2→5Oglycolyl結合オリゴ・ポリシアル酸および9-O-硫酸化ジシアル酸糖鎖エピトープが卵ゼリー糖タンパク質および350kDa 精子結合タンパク質 (SBP) にそれぞれ存在している。両者ともO-結合型糖鎖上にそのエピトープが存在する。卵ゼリーにおけるポリシアル酸の機能は明らかにされていないが、受精の際、卵ゼリーのO-結合型糖鎖上の硫酸化ジシアル酸構造が、先体反応後の精子と結合することが示されている。一方、ウニ精子では、8-O-硫酸化ジシアル酸構造がガングリオシド上に見いだされており、著者らはこの糖鎖エピトープをもつガングリオシドがウニ卵の350kDa精子結合タンパク質 (SBP)と結合することを明らかにしている。
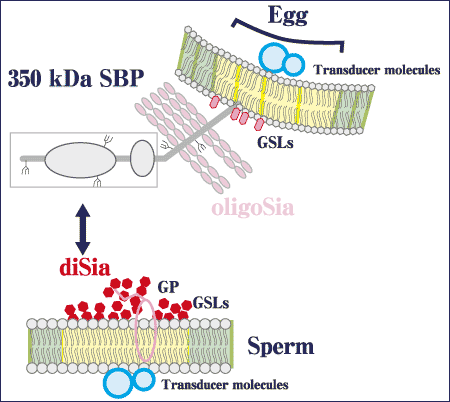
図 3 受精におけるジシアル酸の機能
興味深いことは、この糖鎖エピトープが糖タンパク質上にも共発現している点である。したがってガングリオシドや糖タンパク質上の8-O-硫酸化ジシアル酸構造は、共同して卵上の350 kDa SBPと結合することによって、精子-卵相互作用の一端を担っていると考えられる。
糖タンパク質上のジ・オリゴシアル酸糖鎖エピトープの存在が証明され、数多くの機能が示唆される現在、これらの糖鎖エピトープの生物学的重要性が解明されるためには、以下のことが課題となる。まず第1に、これらの糖鎖エピトープをもつ糖鎖の構造解析およびその担体タンパク質の同定である。第2には、ジ・オリゴシアル酸構造を認識、結合する分子の存在を明らかにすることである。ポリシアル酸構造はそれ同士の負電荷による強い反発作用によって細胞間相互作用を負に制御している。それに比して、ジ・オリゴシアル酸構造はポリシアル酸よりも負電荷が少なく、ある特定の認識タンパク質によって認識される可能性が高い。ジシアル酸構造のみを持つ糖タンパク質もあれば、ジ・オリゴシアル酸を併せ持つ糖タンパク質もある。またこれらの糖鎖エピトープは発生段階特異的、分化特異的、組織特異的、細胞特異的に発現している。したがって、ジ・オリゴシアル酸含有糖タンパク質と、それと結合する分子との相互作用において、シアル酸の重合度が厳密に認識されている可能性がある。第3には、ジ・オリゴシアル酸とその受容体との相互作用がどのように細胞内へのシグナル伝達系へと伝わり、細胞の挙動を変化させているかを明らかにすることである。第4に、ガングリオシドと糖タンパク質の共通エピトープの存在意義の解明である。神経系ではα2→8結合ジシアル酸構造は脳内の同じ細胞由来の糖脂質と糖タンパク質に共通する糖鎖エピトープとみなされる。またラットT細胞における ジシアル酸エピトープやウニ精子におけるα2→8結合硫酸化ジシアル酸構造も同様の例である。この点に関して、今後、共通エピトープを持つ糖タンパク質と糖脂質が共存している膜でのこれらの分子の分布様式の解析(ラフト構造など)や共通エピトープの立体構造解析を行う必要がある。