
氏名:古川 鋼一
古川鋼一教授は1975年に名古屋大学医学部を卒業し、1884年にPh.D.を授与された。名古屋東市民病院及び国立名古屋病院で最初の内科医トレーニングを受けた後、1980年、名古屋大学第一内科臨床血液学教室の山田一正助教授の講座に移った。1984−88年の5年間、Memorial Sloan-KetteringがんセンターのDr.Kenneth O. Lloydのもとでresearch associateとして研究した。その後1988年、長崎大学医学部腫瘍医学講座珠玖洋教授の教室で助手となり、その後助教授に昇格した。1997年、名古屋大学医学部第二生化学講座の教授に就任した。Glycobiologyの編集委員である。
多様な糖鎖の構造は、細胞−細胞間あるいは細胞−細胞外基質間の相互作用において生物学的に深い意味を持つと信じられている。というのは、蛋白質及び脂質に付加された糖鎖構造が、発生、組織分化、細胞の活性化、及び老化に伴って変化するからである。この糖鎖部分は、グリコシル化や糖鎖のプロセッシングのある特定のステップに対する阻害剤を使用するなど、種々の手法によって実験的に改変することが可能である。そしてこれらのアプローチに基づいて糖鎖機能に関する多くの情報が蓄積されてきているにも関わらず1、個々の糖鎖構造の生物学的な役割については十分な解明がなされていない。その理由は、糖鎖を特異的にかつ徹底的に阻害剤によって除去することが難しいからであり、さらにこれらの手法が、生体内の多細胞系における糖鎖の役割を解析するのに効果的でないからである。
この十年間、多くの糖転移酵素遺伝子がクローニングされ、糖転移酵素遺伝子と糖鎖修飾酵素遺伝子の操作によって培養細胞中の糖鎖構造をいかなるパターンにも変えることができるようになり、また糖鎖のプロフィールを変えると細胞表現型がどうなるかを示すことができるようになった。生体内において糖転移酵素をコントロールした形で撹乱する最も有効な方法は、transgenesisである。すなわち糖転移酵素遺伝子及び糖鎖修飾酵素遺伝子のトランスジェニックマウスやノックアウトマウスの系統を作製することである2。相同組み換え技術や多分化能を持つ培養胚性幹細胞(ES細胞)が利用可能となったことで、特定の遺伝子のヌル変異体の作製が可能になった。
糖転移酵素や硫酸転移酵素に対する遺伝子ノックアウトマウスの作製に関する最近の進歩は、糖鎖の様々な新規機能を明らかにし、生体内での機能についての新たな知見をもたらしている(表 1)。しかしながら多細胞生物個体における個々の糖鎖構造の役割を正しく十分に理解する上で、糖転移酵素の遺伝子ノックアウトは様々な問題点と制約を内包している。そこで、糖転移酵素や修飾酵素の遺伝子をノックアウトしたマウスの研究から得られた複合糖鎖の役割についての知見を要約し、今後の糖鎖生物学研究の発展のための教訓を明らかにせんとした。
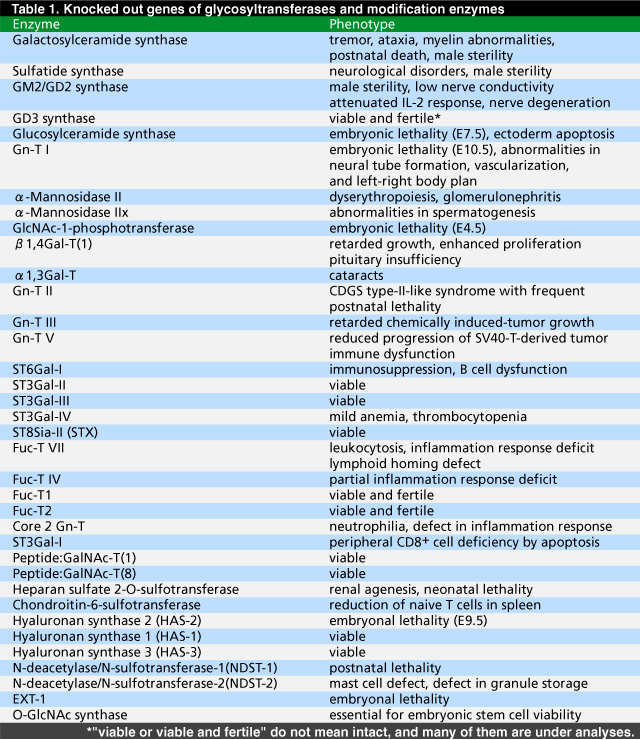
表 1
ガラクトシルセラミド合成酵素はガラクトシルセラミドとその硫酸誘導体であるスルファチドの合成に必須であり(図1)、両者ともにミエリン中に多く存在する。この遺伝子を欠損したヌル変異マウスでは、ミエリンを作ることはできるが、加齢に伴って脊髄で重篤な神経学的変化が見られる。このことからガラクトシルセラミド及び/またはスルファチドは、ミエリンの機能と安定性に対して重要な役割を果たしていることが示唆された3。また、これらの変異マウスでは後期パキティン期の精母細胞や精子細胞が存在せず、この酵素が精母細胞から最初の減数分裂へ至る過程に必要なことが分かる。スルファチド合成酵素はスルファチド、セミノリピド及び硫酸化ラクトシルセラミドの合成に働く(図1)。スルファチド合成酵素のノックアウトマウスはガラクトシルセラミド合成酵素ノックアウトマウスと比べた時、似たような神経学的異常と精子形成の不全が見られる4。この事実から硫酸化のステップが実際に神経系と生殖系の両方に重要であることが分かる。GM2/GD2 合成酵素は複合型ガングリオシドを合成するための鍵となる酵素である(図1)。この酵素のヌル変異マウスでは複合型ガングリオシドが全くできないが、見かけ上、生まれも発育も正常である5。しかしながら不妊症であり、精子形成不全が見られる6。これらのマウスではテストステロンが精巣間質のLeydig 細胞中に蓄積する一方で、血清中のテストステロン値が非常に低いことから、ガングリオシド複合体がテストステロンの輸送に必須であることが示唆された(図2)。ノックアウトマウスでは、IL-2刺激時の脾臓T細胞の増殖反応が減少していた7。変異体マウスではIL-2処理後のJAK1、JAK3とSAT5の活性化レベルが減少しており、複合型ガングリオシドがIL-2受容体の適切な機能遂行に必要なことが示唆された。GM2/GD2合成酵素遺伝子のヌル変異マウスは見かけ上正常な脳形態を示す。しかしながら頸骨神経から体性知覚皮質(somatosensory cortex)への神経伝達度は明らかに低下している5。ノックアウトマウスでは加齢に伴い坐骨神経や脊髄の著しい変性と脱髄が認められると共に、舌下神経を切除した場合の再生が乏しいことから、ガングリオシドが神経組織の維持や修復に重要であることが示された8,9。グルコシルセラミド合成酵素(GST)は大多数の糖脂質の前駆体となるグルコシルセラミドを合成する(図1)。6.5日胚までは、グルコシルセラミド合成酵素のヌル変異マウスは正常胎仔と変わらないが、胎生9.5日になると全て死んでしまう10。このステージでは胚の嚢胚形成が行われ、胎仔は内胚葉、中胚葉、外胚葉の3胚葉を有している。著明なアポトーシスが7.5日胚の外胚葉に集中的に起きることが主たる原因で胎生致死となると考えられる。
これらの知見からスフィンゴ糖脂質の存在が胚の発生には必須であり、スルファチドと複合型ガングリオシドの両方が神経系、雄の生殖器及び他の全身的な制御システムの調節に関与していることが示唆された。
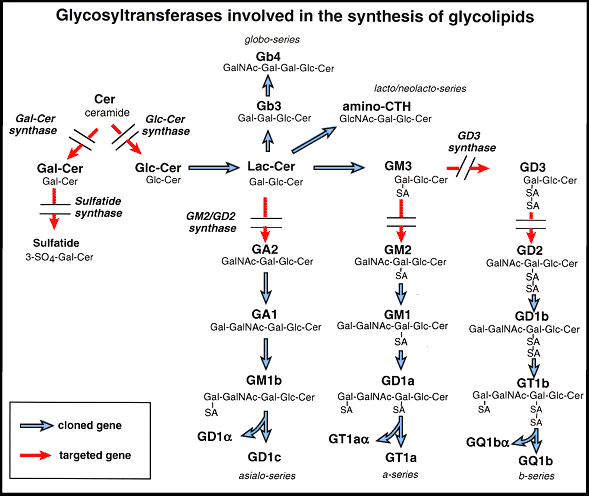
図 1 スフィンゴ糖脂質とスルファチドの合成経路
SA, sialic acid; Gb3,globotriaosylceramide. ガングリオシドの命名法はSvennerholm39の方法に準拠。遺伝子を破壊した酵素が二重線で示されている。
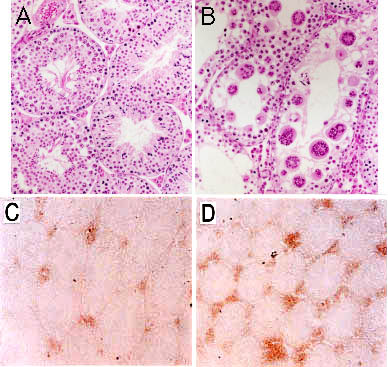
図 2 複合型ガングリオシドはテストステロン輸送に必須である
A; 野生型マウスの精巣、B; 変異マウスの精巣、精子形成不全と多くの多核巨大細胞が見られる。CとD; 野生型(C)と変異マウス(D)の間質Leydig細胞にあるテストステロンの染色パターンを示した。複合型ガングリオシド欠損マウスでは著しく血清中テストステロン値が減少したが、一方でLeydig細胞ではテストステロンの蓄積が見られた。E; Leydig細胞から細精管と血管へのテストステロンの輸送が減少することを示した概念図。
糖タンパク質中のアスパラギン結合オリゴ糖(N-グリカン)は高マンノ−ス型、複合型及びハイブリッド型(混成型)に分類される。複合型及び混成型グリカンのコア構造は高マンノ−ス型グリカンが修飾を受けることで形成される。
N-アセチルグルコサミニルトランスフェラーゼI(Gn-T1)遺伝子は、高マンノース型オリゴ糖、(Man) 5(GlcNAc) 2から複合型及び混成型のN-グリカンを作る上で鍵となる反応を触媒する(図3A)。ヌル変異マウスの全ての胎仔は胎生10.5日以前に死んでしまう11,12。複合型N-結合オリゴ糖は、神経管形成、血管形成、そして左右非対称性形成などの形態形成過程において重要である。α-マンノシダーゼ-IIは、N-アセチルグルコサミンの転移後のN-グリカンオリゴ糖生合成の最初のプロセッシングステップを触媒する(図3B)。実際、α-マンノシダーゼ-IIを欠損したマウスでは、赤血球の複合型N-グリカンの消失を伴った赤血球異形成性貧血になることから13、N-結合オリゴ糖の生合成には細胞種に特異的な多様性が存在することが示唆された。α-マンノシダーゼII xは最近クローニングされたが、これは主として中間〜cisゴルジに存在することが示された。α−マンノシダーゼII xは(Man) 6(GlcNAc) 2の2つのマンノシル残基を加水分解する。この酵素を欠いたノックアウトマウスをしらべると、精子形成においてこの遺伝子が非常に重要な役割を演じていることが分かった14。ドリコールリン酸N-アセチルグルコサミン-1-リン酸トランスフェラーゼ(GPT)は、N-結合オリゴ糖の産生に必須であるドリコールオリゴ糖前駆体形成の第一段階で必要とされる。この酵素が欠損した胚は、着床前の発生と着床までは完了できるが、その後まもなく受精後4-5日の間で死んでしまう。従って初期の胚形成と着床後の発生にはN-グリカンが必須の役割を果たしていることが示された15。β-1,4-ガラクトシルトランスフェラーゼ(β4Gal-T1)欠損マウスは正常に生まれ、生殖能はあるが、成長が遅く多くはやがて死んでしまう16。皮膚や小腸の上皮細胞で増殖が亢進していることから、出生後の上皮細胞の増殖や分化の制御にβGal-T1が重要な役割を果たしていることが示唆された。Galβ1,4GlcNAcの構造は複合型N-グリカン、O-グリカンそして糖脂質に共通に存在することから、以上の症状は予想外のことで、アイソフォームの存在が示唆される。α-1,3ガラクトシルトランスフェラーゼ遺伝子ノックアウトマウス:ヌル変異マウスは主としてその生殖不能と異種抗原性に関して研究された。興味深いことにノックアウトマウスは他の臓器には問題がなかったが、白内障を発症した17。β-1,4N-アセチルグルコサミニルトランスフェラーゼIII(Gn-T III)はN-グリカンの種々の混成型や複合型N-グリカン上に見られるバイセクティング(2分岐)GlcNAc結合を合成する。また、この酵素はN-グリカン生合成における制御的役割を果たし、バイセクティングGlcNAcの付加の後にはα-マンノシダーゼII、Gn-T II, Gn-T IV, Gn-T V 及びコアα-1,6-Fuc-Tの後続反応が不可能になる。しかしながら、Gn-T III(Mgat3)欠損マウスは生存可能であり正常に繁殖することから、N-グリカンにおけるバイセクティングGlcNAcは正常の発生、恒常性維持、生殖には不要であるらしい18。
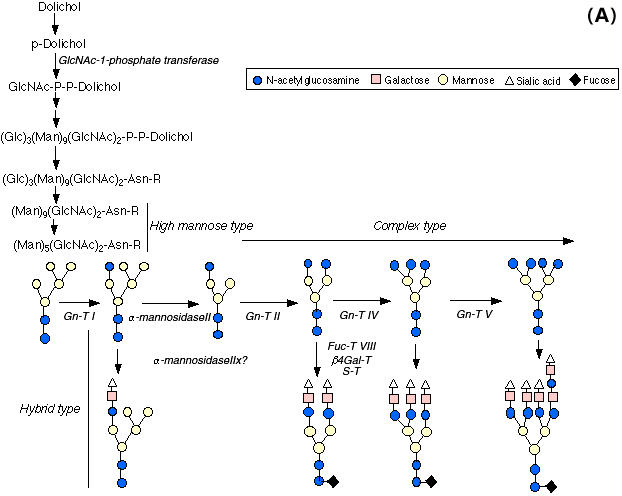
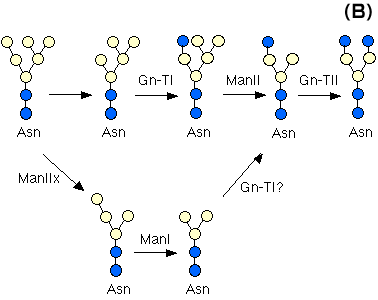
図 3 N-結合オリゴ糖の生合成経路(A)とαマンノシダーゼII xの作用(B)
N-アセチルグルコサミニルトランスフェラーゼV 遺伝子(Gn-T V)欠損マウスでは様々な異常が見られた19。Gn-T Vが関与するグリカン産物、β1,6 GlcNAc-分岐N-結合グリカンの産生量は、通常がんで増加し病気の進展と相関する。Gn-T V欠損マウスでは見かけ上正常であるが、ある種の外的条件に対する反応において違いが見られる。ポリオマウイルスmiddle Tがん遺伝子で誘発される乳がんの増殖と転移がGn-T Vヌルマウスでは有意に低い。遺伝子産物が膜のrufflingとフォスファチジル-イノシトール3キナーゼ-タンパク質キナーゼBの活性を誘導し、生体内でがん遺伝子のシグナリングとがんの増殖を増幅させる正のフィードバックループを推進している。これらの遺伝子産物はまたT細胞の免疫制御にも関与している。α-2,6-シアリルトランスフェラーゼ(ST6Gal)はN-アセチルラクトサミン端にSiaα2,6Galβ1,4GlcNAc の3糖を合成する。結果として形成されてくるSiaα2,6Galβ1,4GlcNAc 構造が共通して複合型N-グリカンに見い出される。ST6Gal 1欠損マウスは生存可能で、繁殖できる20。しかしヌル変異マウスでは血清IgM値が低下し、IgMとCD40架橋に対するB細胞増殖反応が損なわれることが示された。また、抗体産生が重度に低下していて、ST6Gal 1欠損マウスの表現型はCD22欠損に比べより重症であったことから、ガラクトースにα2-6結合したシアル酸は、多くの分子によって認識され、B細胞の活性化と免疫機能に関与していることが示唆された。ST3Gal-IVはin vitro ではN-及びO-グリカンに作用し、多くの組織で高度に発現している。ST3Gal-IV-欠損マウスは概ね正常に発育し行動も正常であるが、軽度の貧血と、血小板サイズの増大を伴った重度の血小板減少症を呈した21。
種々のN-グリカン合成酵素遺伝子のノックアウトマウスの中で、主たる合成経路及びプロセシング経路に関与しているものを破壊した場合、全身的かつ重篤な結果がもたらされた。一方末梢的な構造の合成経路の遺伝子を破壊した場合は、組織特異的で、比較的軽度の表現型の変化を示した。
9つのフコース転移酵素遺伝子が今日までに報告されているが、うち7つはα1,4あるいはα1,3/4フコシル化を触媒する。それらの中で、Fuc-T VII、Fuc-T IV及び Fuc-T IX遺伝子がターゲッティングされたが、最初の2つは白血球の形成と接着に関与することが報告されている。これらの2つの遺伝子産物は個別に、しかし時には重複する形で重要な役割を演じる。α-1,3-フコース転移酵素(Fuc-T VII)-欠損マウスは、Fuc-TVIIがL-、E-、そしてP-セレクチンに対するリガンド合成に必須であることを示した22。ヌルの変異マウスは白血球増多症になり、白血球の血管外浸潤が損なわれて、リンパ球のホーミングができないことが分かった。Fuc-T IV-欠損マウスでは炎症反応の不全が認められる。皮膚の微小血管では、Fuc-T VIIによって作られるP-セレクチンのリガンドは白血球が最初に内皮細胞に接着する際に非常に重要である。一方で、E-セレクチンリガンドは、ローリング速度を最も遅延せしめるが、その場合Fuc-T IVとFuc-T VIIの同時発現を必要とし、そのことからセレクチン依存性の接着におけるFuc-T IVの役割が示された23。
O-グリカンに属する種々の構造が知られているが、これまで2,3の合成ステップについてノックアウトマウスを用いたアプローチにより解析されている。
コア2β-1,6-N-アセチルグルコサミン転移酵素(C2Gn-T)は広くセリン/スレオニン結合オリゴ糖(O-グリカン)の合成に関わっている(図3)。コア2O-グリカンはこれまでムチンの産生とセレクチンリガンドの生合成に必須であると考えられてきた。C2Gn-Tを欠損したマウスは好中球増多症を伴う限られた異常表現型を呈し、セレクチンリガンドの一部が欠けていることが示された24。即ちE-、L-、P-セレクチンを発現している基質上での好中球のローリング、及び炎症部位への好中球の移送は低下するが、リンパ節へのリンパ球ホーミングは変わらない。これらの結果はE-及びP-セレクチンの機能的リガンドはコア2構造を持ったO-グリカン上にあるが、一方C2Gn-Tによって産生されるL-セレクチンリガンドはリンパ球ホーミングに必要でないことを示している25。ST3Gal-Iはセリン/スレオニン結合2糖、Galβ1-3GalNAcにSiaα2-3Gal構造を形成するシアル酸転移酵素である。多くの脊椎動物で胸腺T細胞の発生期間中にコア1O-グリカンにシアル酸が付加される。ST3Gal-Iが不活化されると、末端CD8+T細胞は免疫刺激なしにアポトーシスを起こして数が減少することが明らかになった26。従ってST3Gal-Iは、アポトーシスによってCD8+ T細胞を消失させるホメオスターシスのメカニズムに関与していると共に、生存可能なCD8+ メモリーT細胞の産生を助長している。ポリペプチド-N-アセチルガラクトサミン転移酵素(polypeptide:GalNAc-T)は単糖GalNAcをセリンとスレオニン残基へ転移する反応を触媒するが、それによってO-結合オリゴ糖の生合成が開始される。今日までに12種のファミリーメンバーが報告されている。GalNAc-T-1とGalNAc-T-8がノックアウトされている。GalNAc-T-1遺伝子ペプタイドのヌル変異マウスでは、正常なT細胞の発生と2次的リンパ器官のコロニー形成が見られたことから、ほ乳類のO-グリカン生合成には多数のポリペプタイドGalNAc-Tsが関与していることが示された27。但しノックアウトされたと考えられたGalNAc-T-1は実は他のファミリーメンバーであることが最近明らかになった。
この様にO-グリカンが欠損すると、一般的に免疫制御系の機能不全がもたらされるが、他の組織や臓器についての分析はまだこれからである。
プロテオグリカンは異なるコアタンパク質と、型、数、長さの異なるグリコサミノグリカン(GAG)からなる陰性多荷電の分子である。多くの酵素がプロテオグリカンのGAGの生合成に関与している。すなわちGAGとコアタンパク質の間の共通結合領域の合成、個々のGAGの繰り返しユニットの開始や伸長、そしてN-脱アセチル化、N-硫酸化、6-O、4-O、2-O、3-O硫酸化及びエピメリゼーションなどのGAGの修飾反応に対して各々の酵素が関与している。
ヘパラン硫酸2-O-硫酸転移酵素は、硫酸基をヘパラン硫酸のイズロン酸残基の2の位置に転移する。挿入変異法により2-O-硫酸転移酵素遺伝子を破壊した場合、ホモ接合体変異マウスは新生児期に死んでしまい28、両側性の腎形成不全と眼及び骨格の欠陥が見られた。これは特異的な糖鎖修飾を受けたプロテオグリカンが脊椎動物の発生期間中の形態形成に関与していることを遺伝学的に示した最初の証拠である。ヒアルロン酸合成酵素(HAS)は脊椎動物でヒアルロン酸を作る。細胞外基質成分のヒアルロン酸(HA)は、タンパク質を結合せず、直鎖状で枝分かれを持たない、GlcNAc-β1, 4GlcAβ1,3の2糖からなるポリマーであることから、その研究は大変困難であった。3つのHASの内、HAS2はマウスの胎仔発生に対して必須である:HAS2ヌル変異の胎仔は致死性であるが29、HAS1とHAS3のヌル変異体は致死性ではない。N-脱アセチル/N-硫酸転移酵素(NDST)はN-アセチル基を脱離し、N-硫酸化の反応を触媒する。この反応はヘパリン及びヘパラン硫酸の生合成では非常に重要なステップである。3つのNDST、すなわちNDST-1、NDST-2、NDST-3が単離された。NDST-1のヌル変異体は生まれるが直後に死んでしまう。NDST-2 ヌル変異体マウスは生存可能、繁殖可能で、20ヶ月目まで特に目立った病理的表現型の変化は見られない。これらの動物では結合組織型の肥満細胞がほとんどなく、肥満細胞中のヘパリンが消失しているが、肝臓中のヘパラン硫酸レベルは変化していない30,31。EXT1〜3は、遺伝性多発性外骨腫症において、がん抑制遺伝子として定義されたものであるが、EXT1とEXT2はヘパラン硫酸の生合成に必要である糖転移酵素であることが明らかにされた32,33。EXT1のホモ接合変異体では嚢胚形成がうまくできず、全般的に中胚葉と胎児外組織の組織的形成ができないことから、胎仔が小さなものとなる34。つまりEXT1は初期胚発生時の嚢胚形成及びヘパラン硫酸の生合成に必須のものである。
GAGの修飾酵素の変異マウスでは一般的に形態形成及び器官形成が損なわれる。GAGのより基本的な構造の生合成に関わる転移酵素が欠損すると致死性になることから、発生期の基本的プロセスにおけるGAGの重要性が示唆された。
O-GlcNAc合成酵素遺伝子は、広範な核及び細胞質タンパク質のセリン/スレオニン残基にO-結合型N-アセチルグルコサミン(O-GlcNAc)を1つだけ付ける結合反応に関与している。この遺伝子はXq13(ヒト)に局在しているcento metric X-関連遺伝子にコードされ、少なくとも1つの機能対立遺伝子が胚性幹細胞の生存及びマウス個体発生に必須であることが示された35。
糖転移酵素及び糖鎖修飾酵素の遺伝子ノックアウト戦略は、強力なアプローチであり、しばしば生体内での糖鎖構造の役割に関して明快な結果をもたらす。実際、上述したように遺伝子ノックアウトマウスの解析から多くの予期せぬ結果が報告されている。これらの中の幾つかはこれまでの生化学的な研究によって得られた知識では予想することができなかった。ノックアウトマウスの解析は、個々の糖鎖構造の生体内での機能についてしばしば非常に新規な情報を提供してくれ、その信頼度も高い。スルファチド合成酵素、Gal-Cer合成酵素、及び複合型ガングリオシド合成酵素の変異マウスは、正確なメカニズムは同一ではないけれども、共通して精子形成に必須の役割を果たしていることが示された。このことから、個々の遺伝子の主たる役割について先入観を持つべきではなく、また、器官や組織についてある遺伝子を破壊した効果が必ずしもその遺伝子の発現レベルと相関していないかもしれないと言うことが示唆された。例えば精巣におけるGM2/GD2合成酵素遺伝子の発現レベルとその産物量は他の組織に比べ大変低いが、その遺伝子欠損マウスにおいては精子形成不全が最も重篤な症状である。
異常表現型は時にヌル変異マウスが生まれた時点で現れるが、いくつかの異常な変化は長期観察あるいは加齢に伴って、より明瞭となってくると思われる。従って変異マウスの変化を見つけるためには、複合型ガングリオシド欠損変異マウスで神経変性が見つかった時の様に、根気強く長期間観察することが必要である。GnT-V-欠損マウスで示されたように、潜在的な欠損を顕在化させるには変異マウスに対して種々のストレスを加えることが必要なのかも知れない。
種々の変異マウスの表現型の解釈に当たっては、沢山の問題が解決され乗り越えられねばならない。ノックアウトマウスの組織で除去されるはずであったが実際はのこっている糖鎖構造の正確な解析は、変異マウスの表現型を正しく適切に解釈するために非常に重要である。最近、一つのグリコシド結合の形成に複数の酵素が従来思われていたよりも高頻度で関与していることが解ってきている。従って"失われた"構造に対しての特異的な抗体やレクチンを使った注意深い免疫化学的な分析が、化学的分析と共に必要とされる。同時に多数の似たような遺伝子を二重、三重にノックアウトすることにより糖鎖構造を完全に除去し、個々の遺伝子産物の役割を完璧に明らかにする必要がある。
いくつかの例を除き、遺伝子を破壊した結果もたらされた表現型の分子メカニズムはまだ十分に分かっていない。遺伝子ノックアウトマウスの細胞や組織はin vitroで糖鎖機能の分子メカニズムをさらに解析するための貴重な材料となる。これらの努力を重ねることで、細胞や組織で起こっている事象の制御メカニズム全体における糖鎖の貢献が明らかになると考えられる。
ショウジョウバエ(Drosophila melanogaster)と線虫(Caenorhabditis elegans)は、複合糖質の生体内での機能を調べる上で有用な生物であり、遺伝子破壊の技術が進んでいること、ゲノム配列や遺伝子変異の情報が利用できること、そしてその生存期間が短いことがメリットである36。まさにヘパラン硫酸プロテオグリカンが発生期に果たす重要な役割がショウジョウバエの系で示された37,38。しかしながら、多くの糖鎖構造は脊椎動物と無脊椎動物の間で、それ程正確に保存されてはいない。従って、多細胞環境における糖鎖化合物の生体内機能については、マウスを用いたノックアウトアプローチが重要な情報を提供し続けるものと考えられる。