
氏名:鈴木 明身
1947年に福島県で生まれ、信州大学医学部を卒業後、東京大学で医学博士を取得した。山川民夫教授の研究室で糖脂質の生化学の研究を始めた。Ernest Klenk賞を得、1978年から1980年までAlbert Einstein医科大学のDonald Marcus教授の研究室で糖脂質の免疫学を研究した。その後、東京大学生化学教室に戻り、マウスを用いて糖脂質の遺伝学に関する研究を始めた。研究の興味は糖脂質発現制御や、糖脂質や膜に結合した機能性糖タンパク質に支えられたミクロドメインの形成と機能の解明にある。1999年に、東京都臨床医学総合研究所から理研フロンティアシステムに移り、現在理研フロンティア研究システムの生体超分子システム研究グループのグループ長として研究を指揮している。1985年には日本生化学会賞を、1990年には基礎科学のための井上賞を受賞した。
2002年1月4日、朝日新聞は第一面に二つの記事を掲載した。一つはヒトとチンパンジーの間での遺伝子配列の違いに関する報告で、違いは1.23 %であり、他のもう一つはGalα1-3Galエピトープの発現を欠損するクローン豚の生産に成功したという記事である。この論文の主題である“シアル酸とヒトの進化”と、これらの二つの話題がいかに関連するか、以下に概説する。
シアル酸の歴史は興味深い、人間味のあるものである1。ウプサラのGunnar Blixは1936年にウシ顎下腺ムチンを水と加熱することにより結晶を単離した。彼は後にこの物質を酸性の性質と起源となった物質に因みシアル酸と命名した。1940年にはErnst Klenkもまたケルンにおいて、Tay-Sach's病、この病気は現在ではβ-ヘキソサミニダーゼに関係する遺伝子の変異に起因する先天的な代謝性異常症であることが分かっている、の患者の脳から精製した酸性糖脂質の弱酸加水分解物から得られた物質を結晶化した。Klenkはこの結晶化した物質を、その酸性の特性と起源となった神経組織に因んでノイラミン酸と命名した。構造決定はBlix、Klenkに加え、ハイデルベルグの Richard Kuhn、東京の山川民夫、キャンベラの Alfred Gottschalk および 仙台の檜山登ら多くの研究者によって行われた。種々の構造が提案されたが、最終的にGottschalkが図1に示した正しい構造を報告した。1957年Nature誌にBlix、KlenkおよびGottschalkの3人の連名で非常に短いノートが掲載され2、ノイラミン酸と呼ばれる骨格構造を有する物質に対してファミリー名としてシアル酸という名称を用いるとすることで、これらの物質の学術名が合意に達したことが公にされた。以来キールのSchauerらは精力的に天然に存在するノイラミン酸誘導体の構造研究を進め、シアル酸ファミリーに属する30以上の分子を発見した3。ほ乳動物におけるシアル酸の分布を見ると興味あるデータが蓄積されてきている。ブタの顎下腺ムチンはN-グリコリルノイラミン酸(Neu5Gc)を含んでいた。ヒト脳の糖脂質のシアル酸は専らN-アセチルノイラミン酸(Neu5Ac)で、山川によりウマ赤血球から単離された糖脂質のシアル酸はNeu5Gcであった。即ちNeu5Gcは種特異的な分布を示し、ヒトでは正常組織においてはNeu5Gcを欠損し、ほ乳動物としてはユニークであることである。
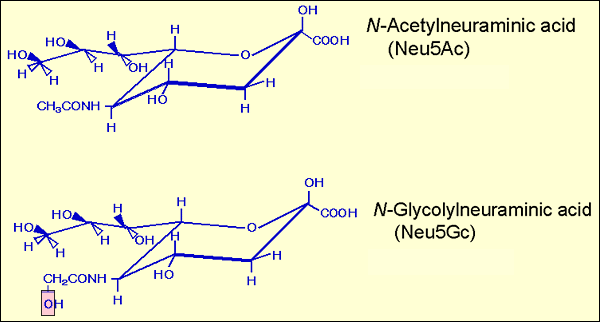
図 1 Neu5AcとNeu5Gcの構造
抗生物質、ワクチンの開発以前には、ジフテリアおよび破傷風の様な重篤な感染症の治療は、ウマ、ヒツジおよびヤギのような大型のほ乳動物に病原菌を免疫することによって得られた抗血清を注射することであった。しかし患者への二回目の注射は高頻度で重篤なアナフィラキシー反応を引き起した。この原因は注入された抗血清中に存在する異種動物由来の外来成分に対する抗体(異好性抗体)の産生に起因したものと考えられ、この抗体は後にチェコの研究者で、この現象を報告した研究者のHanganutziuとDeicherにより、HD抗体と名付けられた。日本の内貴とアメリカのMilgromはNeu5Gcを含む糖鎖が異好性抗原の一つであることを発見した。これら一連の証拠からHD抗体の産生は二次的免疫反応であり、ヒトは異種抗原であるNeu5Gcの刺激なしには抗体を生ずるものではないことが示された。
ヒトに対するNeu5Gcの免疫原性はGalα1-3Galエピトープとは全く異なる。ヒトは自然抗体として抗Galα1-3Gal抗体を持っているが、抗Neu5Gc抗体は持っていないからである。ブタ臓器をヒトに移植すると既に存在する抗Galα1-3Gal抗体により直ちに拒絶されてしまう。従ってブタ臓器の異種移植にはGalα1-3Galエピトープを欠損させた変異体の生産が必須となる。次に問題になるのはNeu5Gcの発現で、移植された臓器が生着維持されるために、Neu5Gcの発現を抑えることが必要になる。Neu5Gcの抗体産生を免疫抑制剤でコントロールすることも一つの方法であるが、Neu5Gcに関わる問題は異種移植の発展において次のターゲットの一つとなる。
RosemanはNeu5AcがN-アセチルマンノサミンとピルビン酸からバクテリアの酵素によって生合成されることを発見した4。ほ乳動物の合成酵素はN-アセチルマンノサミン-6-リン酸とホスホエノールピルビン酸からN-アセチルノイラミン-9-リン酸を合成する。ShauerのグループはNeu5Gcの生合成を研究し、水酸化反応が律速反応であり、反応はシチジンモノホスホ-Neu5Acを基質として行われ、フリーのNeu5Acでは行われないことを見出した5。水酸化に関わる酵素の精製は、我々がCMP-Neu5Acの水酸化は一つの酵素ではなく、複数の酵素で行われる複合反応であることを見出して初めて成功した。我々の研究室の小堤はマウスの肝臓の細胞質タンパク質をイオン交換クロマトグラフィーにかけ濃度勾配法により分離したが、どの画分にも水酸化活性は回収されないことに気づいた。小堤はこの現象をいくつかの因子が異なった画分に分画されてしまったことで説明できるかも知れないと考えた。これを混合実験で立証した。酵素の活性には二つの画分が必要であった。そして一つの画分はチトクロームb5で置換できた6。このようにして、水酸化反応のメカニズムが提唱された。即ち、CMP-Neu5Acの水酸化は水酸化酵素、チトクロームb5およびNADH依存性チトクロームb5還元酵素によって行われる(図2)。チトクロームb5やチトクロームb5還元酵素がヒトで欠損するとは考えられず、鍵を握るのは水酸化酵素であると考えられた。そこで水酸化酵素の精製に着手した。行程はアフィニティークロマトグラフィーを含むいくつかのクロマトグラフィーを組合わせたものである7。酵素の興味ある特性の一つは、水酸化酵素はCMP-Neu5Acの存在する状態でのみチトクロームb5固定化カラムに結合するということである。このことは、水酸化酵素が基質であるCMP-Neu5Acに結合して、コンフォメーションを変化させ、チトクロームb5の結合部位を露出させることを示唆している(図3)。水酸化酵素が精製され、精製酵素から得られた数個のペプチドからアミノ酸配列が得られた。このアミノ酸配列からマウス肝臓のcDNAがクローンされ、塩基配列が決められた8。
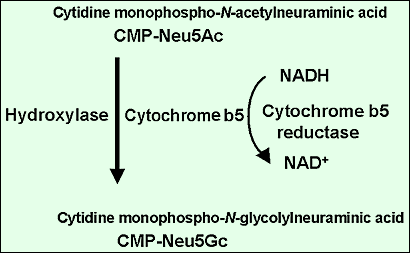
図 2 CMP-NeuAcの水酸化
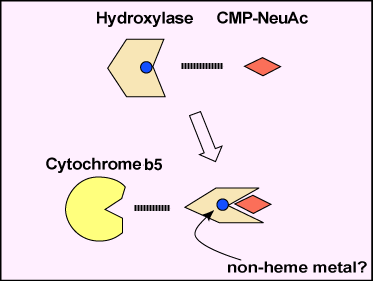
図 3 水酸化酵素のコンフォメーション変化のスキーム。
水酸化酵素はCMP-Neu5Ac基質の存在下にそのコンフォメーションを変化させ、チトクロームb5の結合部位を作り出す。
上述したように、正常なヒト組織は糖タンパク質および糖脂質の糖鎖の単糖成分としてNeu5Gcを持っていない。これは正常ヒト組織から単離した糖鎖の構造解析を扱った多くの論文によっても支持されている。もう一つの重要な発見は、これも既に述べたことであるが、Neu5Gcはヒトに対して抗原性があることである。 我々は、ヒトは何故Neu5Gcを産生できないかという疑問に答えることに焦点を絞り、実験を続けることにした。最も重要な課題はヒトに水酸化酵素の遺伝子が存在するかということである。そこでヒトのcDNAをクローンし、その配列の解析を行った。一つのcDNAがHeLa細胞cDNAライブラリーからクローン化できた。マウスとヒトのcDNAの比較から両者の配列はヒトcDNAに92bpの欠損があることを除けば非常に類似していた9。92bp断片はマウス水酸化酵素の一つのエクソンに相当する(図4)。ヒトは活性のある水酸化酵素をこの欠損があるが故に産生できないと結論された。Ajit Varkiらは、ヒトは92bp断片の欠損により作り出されたストップコドンの存在によって小さなペプチドが産生されることを示唆した10。我々はヒト水酸化酵素の欠損部位をマウスのアミノ酸配列で補ったキメラ酵素を作り、この人工的酵素は水酸化活性を持つことを確認した9。
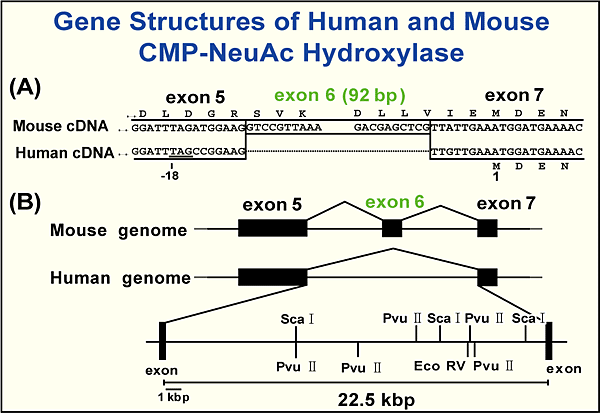
図 4 ヒトCMP-NeuAc水酸化酵素遺伝子の92bp欠損。
(A)cDNAと(B)遺伝子の比較
Varkiらは、チンパンジーは組織中にNeu5Gcを持つことを示した。彼らはチンパンジーの水酸化酵素cDNAをクローン化して配列を決め、チンパンジーの水酸化酵素のcDNAにはヒト水酸化酵素に見られる欠損部位がなく、マウスのcDNAと相同であることを見出した10。そしてヒトの欠損はヒトの祖先がチンパンジーの祖先から分岐した後で起きたと結論した。92bpの欠損はヒトとチンパンジーの遺伝子の違いを示す例の一つである。即ち、この違いはヒトとチンパンジーのゲノムの1.23 %の違いの一部分である。高畑らは最近、いかにして欠損を生じたかその分子メカニズムを報告した。マウスの92bpエクソンおよびその前後のイントロンに対応するヒトの遺伝子塩基配列を解析し、AluSq 因子が、ヒトのゲノムの同一部位ではAluY 因子に置換され、その結果起きた相同組み換えの結果92bpのエクソンを含む遺伝子断片が除かれたと提唱した11。このことは少なくとも100万年前に広まったとしている。そうだとすると次にこの欠損がホモサピエンスの進化の過程のいつ生じたかと言う興味ある疑問が生ずる。Varkiらはこの疑問に答えるべく研究を継続している。
ヒトが水酸化酵素遺伝子の92bp断片を欠損したことは、種々のほ乳動物の神経細胞以外の臓器が共通に持っているNeu5Gcを結合した糖鎖の発現能力を、ヒトは喪失したことを明白に示している。Neu5Gc糖鎖の喪失とチンパンジーと異なるヒトの特性の間に何らかの関連性があるのだろうか?ヒトという種属の生存にこの欠損はプラスに働くのだろうか、あるいはマイナスに働くのだろうか?残念ながら我々はNeu5Gc糖鎖の本質的な生理的機能を未だ十分理解していないのでこの疑問に答えることができない。しかし断片的ではあるが、興味ある観察結果が蓄積してきている。Neu5Gcを結合した糖脂質、GM3(Neu5Gc)はEscherichia coli K99の受容体として機能し、子豚に重篤な下痢を引き起こす。Neu5Gcα2-6Galβ糖鎖はマウスのシアル酸を認識する免疫グロブリン様レクチンの一種であるCD22の優先的リガンドとなる。インフルエンザウイルスの亜種にはNeu5Gc糖鎖を識別する赤血球凝集素が存在する。オリゴデンドロサイトではin vitroでNeu5Gcの発現を誘発することによりミエリン形成が阻害される。水酸化酵素の遺伝子導入、強制発現マウスは胚発生の時期で死滅する。水酸化酵素遺伝子のノックアウトマウスはB 細胞の二次免疫応答が亢進している。Neu5Gc糖鎖はNeu5Ac糖鎖に比しシアリダーゼによりゆっくりと切断される。水酸化酵素のmRNAはヒトも含めてほ乳動物の脳では検出されないことから、Neu5Gcの発現が脳の形態形成や機能に有利ではない可能性が考えられる、等である。
Varkiは、Neu5Gcの欠落が我々の祖先がその生息地を拡大することを可能にしたと推定した。第一にH. erectus が新しい環境において種々の動物からの感染症を回避することで、第二に他の脊椎動物を家畜化して、飼育することでH. sapiensが家畜から感染する危険性を少なくすることで、可能になったと考えている11。この推論は魅力的であるが他の可能性についても考える必要があると我々は考える。糖鎖の代謝に関わる酵素の突然変異はABOやLewis式血液型糖鎖、糖鎖加水分解酵素の先天性代謝異常、糖付加反応に見られる先天性異常などでヒトによく見られる。それ故ヒト以外のほ乳類においてもこれらの糖鎖関連遺伝子の突然変異は起きている可能性があり、もしNeu5Gcが重篤な感染症を惹起する病原菌の受容体であるとすると、Neu5Gc発現欠損の変異は動物の生存にとって有利となるにちがいない。Neu5Gcの多様な変異の一例に、アジアのイヌは赤血球にNeu5Gcを発現しているが、ヨーロッパ起源のイヌでは欠損することが上げられる。この組織特異的な欠損の分子メカニズムはまだ解明されていない。またこれとはべつの問題として、ほぼ全てのほ乳動物は中枢神経系でのみ、おそらく転写の段階で水酸化酵素の発現を抑制するまだよく分かっていない分子メカニズムを獲得したことが上げられる。この抑制はヒトも含めたほ乳動物間で保存されている。このことは中枢神経系の形成と発生はげっ歯類から霊長類までNeu5Acに支えられており、Neu5Gc糖鎖では支えられていないことを示している。それ故に、Neu5Gc糖鎖は末梢神経系あるいは内臓臓器に必要であり、Neu5GcはNeu5Acよりもよく機能を支える、そしてこれらの内のあるものは生活様式や食習慣を変えたヒトではもはや必要のない機能を支えているかもしれない、と言う素朴な推測が生じてくる。
チンパンジーを含めほ乳類とヒトの間の違いとして現れるヒトのCMP-Neu5Ac水酸化酵素の突然変異に、どのような意味があるのだろうか。我々は現在この疑問に答えることができない。しかし水酸化酵素の遺伝子における92bpの欠損はユニークで興味ある突然変異であり、回答を探す手がかりとなる。ヒト以外のほ乳動物のNeu5Gcの機能に関する研究、そしてCMP-Neu5Ac水酸化酵素の翻訳、転写制御に関する分子メカニズムの研究が、この疑問に答える手がかりを与えるだろう。ホモサピエンスの祖先を研究する考古学的アプローチもまた興味ある研究対象である。糖タンパク質、糖脂質の糖鎖は細胞が生存するために必須のものではないが、個体の生存には必須の物質であると我々は信じている。我々はいま、個体、種、動物、植物等がこの惑星「地球」の上で環境の激変を含む種々の生存ストレスを乗り越え、どのように生き残っていくかに焦点を合わせて研究を進めていかなければならない。

図 5 チンパンジーと森を出たホモサピエンスの祖先
(図はNHK スペシャル生命・40億年はるかな旅 5巻、1995年から転載)