
Hollyfield博士は、1966年、University of Texasにて動物学でPh.D.を取得した。その後、Fight for Sight, Inc. (Schaumburg, IL)の奨学金により、Utrecht(オランダ)のHubrecht Laboratoryでポスドクとしてトレーニングを積んだ。1969年、ニューヨーク市のColumbia University, College of Physicians and SurgeonsのDepartment of Anatomyで眼科学の助教に任命される。1977年、Baylor College of MedicineのCullen Eye Instituteに移り、Foundation Fighting Blindness (Hunt Valley, MD)の支援をうけて設立された研究所の所長に就任した。1995年にはCleveland Clinic Foundationに新設されたCole Eye InstituteのDirector of Researchとなる。彼の研究は、網膜と網膜色素上皮の発生および細胞生物学への貢献が認められ、International Society for Eye Research (San Francisco, CA)のEndre Balazs Prize、Alcon Research Institute Award (Ft. Worth, TX)、Retina Research Foundation (Houston, TX)のMarjorie W. Margolin Award、 Sam and Bertha Brochstein Awards、 Research to Prevent Blindness (New York, NY)からの賞、Allergan Laboratories (Irvine, CA)のOcular Cell and Molecular Biology Prize、Hendrix College (Conway, AR)のDistinguished Alumnus Awardなどの数々の栄誉を受けている。Hollyfield博士は、International Society of Eye Researchの事務局長と会長、 Association for Research in Vision and Ophthalmology (Bethesda, MD)では評議員と会長を務めた。1992年よりExperimental Eye Researchの編集長である。
杆体、錐体光受容体の内節および外節は、網膜の外表面から網膜色素上皮に向かって突出する。光受容体間マトリックス(Interphotoreceptor matrix 以下IPMと略記する)という新しいマトリックスは、これらの細胞の外周を取り巻いている (Fig. 1)。結合組織が基底膜下に存在して、胚性中胚葉と神経提由来であるのに対し、IPMは両端を神経外胚葉から発達した二つの上皮頂側によって囲まれた区画に存在する。これらの上皮頂側は、眼胞が縮小してから接触し、二重壁を持つ眼杯が形成される (Fig. 2)。IPMは光受容体の機能と維持に必要とされるいくつかの重要な活動に深い関わりを持つとされている。たとえば、網膜の接着、光受容体の整列、成長因子の提示、レチノイド輸送、貪食作用における光受容体外節の認識などである1-8。
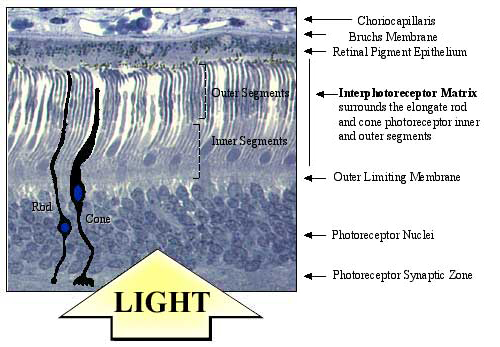
Fig. 1 光受容体間マトリックス(Interphotoreceptor matrix: IPM) の位置。
光に反応して最初の神経シグナルを産生する光受容体細胞は、脊椎動物の網膜の外層に位置する。これらの一次感覚神経は、別々の領域に区画化された特異的な光受容体機能をコントロールする細胞小器官と共に細長く伸びている。視色素を含み、光感受性である外節は細胞の最も遠位にある。外節は、粗面小胞体、ゴルジ装置、ミトコンドリアなどが存在している内節と、毛様部により連結される。内節の下には核があり、これは網膜の外核層に位置する。軸索は短く、神経終末は外網状層に接する。IPMは網膜色素上皮と外境界膜の間の区画を満たす。このマトリックスは、網膜の外表面から突出している内外節の光受容体を取り囲んでいる。光受容体−網膜色素上皮間の代謝産物の輸送や交換はIPMを介して行われている。(顕微鏡写真は正常のヒト成人網膜を示す。)
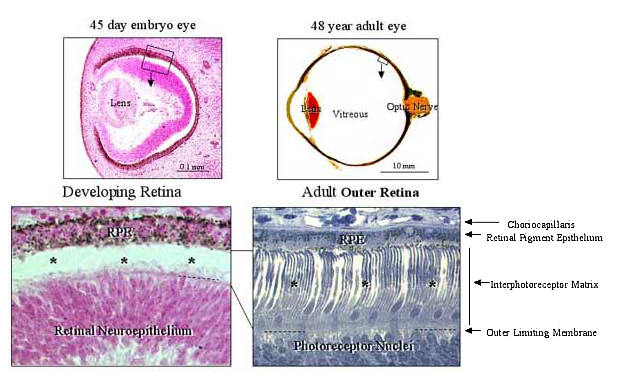
Fig. 2 IPMの胚性起源。
IPMが位置する組織境界面は、眼胞が消失し眼杯の二重壁が形成される初期眼発達において出現する。この初期形態形成において、眼杯壁の神経上皮の内層(後の網膜)、外層(後の網膜色素上皮、retinal pigment epithelium: RPE)それぞれの頂側面をひきあわせる。この図は、受精後45日のヒト胎児の外眼壁の光受容体細胞(*)形成前と同じ領域の48歳の成人の眼の網膜外表面から細長く伸びた光受容体細胞(*)を比較したものである。基底膜下にある結合組織マトリックスとは対照的に、IPMは上皮由来の二層間に存在し、これは上皮細胞頂側表面にある糖衣に相当する。
この章ではIPM中のヒアルロン酸(以下HAと略記する)解析の簡単な歴史と、このマトリックス中で最近同定された新しいヒアルアドヘリンについての考察を示す。そしてIPMの構築のモデルをもって結論とする。このモデルではIPMが構築されるときHAが骨格として重要な役割を果たすことを示す。
初期のIPMの生化学研究では、細胞外分子を網膜の外側から洗い出して解析しようと試みられていた。この方法では少量のHAとコンドロイチン硫酸が同定された1-8 。このマトリックス中に新しいレクチン分子の存在が知られ、より積極的なIPMの抽出法が用いられるまで、HAとその関連分子が水性溶液で抽出されにくいことはわからなかった9,10。ウシ11とヒト12の網膜を使った研究では最初にIPMの水親和性が確認された。網膜を蒸留水中に置くと細胞外部分が急速に腫脹して、網膜外側からはがれ、これで迅速にIPMが分離される (Fig. 3)。
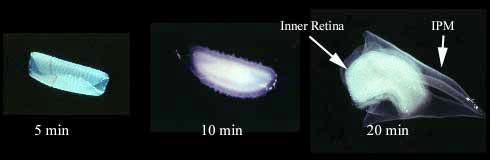
Fig. 3 IPMの分離。
網膜やその断片を蒸留水中に置くと、IPMの高い水親和性により平常時の2.5倍以上に膨張する。この組み合わせ図は3 mm径の円板状の網膜を蒸留水中に置いたときのIPMの剥離を示したものである。大きく膨張した透明なシート(右)にIPMが含まれている。この物質はチョーク様の網膜内層から容易に分離でき、形態的、生化学的解析に利用できる。
分離されたIPMを使って、これまでは従来の光学顕微鏡によって行われていた杆体および錐体マトリックス分画にある異なるレクチン結合ドメインの分布が調べられた13,14。これらの研究が、ピーナッツ・アグルチニン(peanut agglutinin:以下PNAと略記する) は基本的には錐体マトリックス部分を認識し、一方、小麦胚芽レクチン(wheat germ agglutinin:以下WGAと略記する) とマーキア・アムレンシス・アグルチニン(Maackia amurensus agglutinin: MAA) は杆体関連マトリックスに高い親和性を持つことを示した11,15,16 (Fig. 4) 。杆体および錐体マトリックスにおける異なるレクチン染色性は、種々の哺乳類から分離されたIPMについても確認されている (Fig. 5) 。さらに分離IPMの電子顕微鏡観察でも、このマトリックスは細胞外成分からなり水溶液中で安定であることが示された(Fig. 4) 。
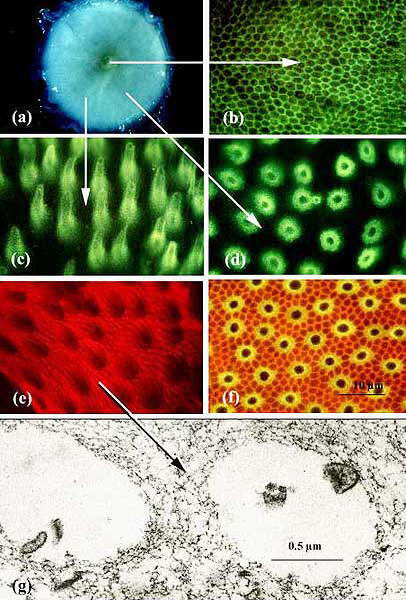
Fig. 4 IPM中の特徴的なレクチン結合部位。
画像(a)は中心窩(黄中心)を含む3 mm径の円板状のヒト成人網膜で、蒸留水処理により部分的にIPMが脱離している。剥離したIPMをFITCラベルしたPNAで染色すると、中心窩の錐体周囲のマトリックス中に、緑色の蛍光が連続して細網状に観察される(b)。錐体の密度が低くなる中心窩の周辺では、やはり錐体関連マトリックスとPNAは結合するが、染色されるそれぞれの錐体のマトリックスは、中心窩にある個々の錐体周囲のマトリックスと比較して増大している(c, d)。PNAに修飾された錐体のマトリックスの側面像である(c)。これらの明るい蛍光の部位はFig. 1で示した内節および外節の錐体周囲に見える透明な領域を占めているのであろう。
正面像で見ると、所々見られる杆体マトリックス区画を除き、錐体マトリックス区画の同部位がPNAで染まる(d)。ローダミンでラベルしたWGA では錐体マトリックス区画は弱く染色されるだけだが、杆体マトリックスは強く染色される(e)。FITCラベルPNAとローダミンラベルWGAを同時に使うと、錐体マトリックス区画が黄色に染まり、錐体周囲に両方のレクチンが共存していることが明瞭となる (f) 。分離されたIPMの電顕像は、蒸留水で分離したIPMが細胞成分ではなく光受容体周囲のマトリックス成分であることを実際に証明している(g)。この画像中では、IPMは杆体光受容体に占められていた電子透過性のスペース(この空間領域にはいくつかの膜の破片が見える)周囲の相互に連結された細線維様の突起の細網状構造形成からなる。分離IPMを一塊のままWGA-フェリチンで染色すると、フェリチンがマトリックス細線維状構造に結合していることが認められる。

Fig. 5 他の哺乳類網膜IPM中のレクチン結合ドメイン。
様々な種の哺乳類のIPMは、Fig. 3で示した方法で同様に分離できる。これまでに調べた全ての動物でFig. 4で述べたヒトIPMと同様のレクチン染色パターンをとる。
分離されたIPM中の杆体および錐体関連領域のレクチン結合特性は、この区画に含まれる特異的分子の同定および特徴づけに役立った。マトリックス分子をSDS/PAGEとブロッティングで分析すると、PNAで染まる150 kDの大きさの1本のバンドが認められた (Fig. 6) 。
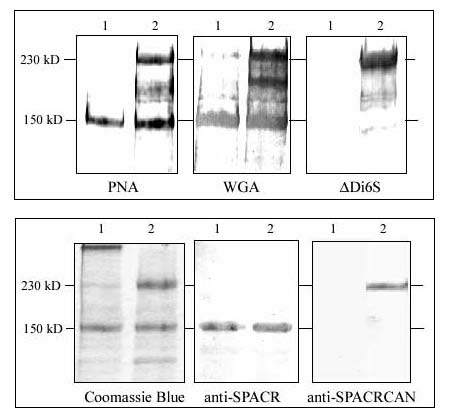
Fig. 6 IPM分子の同定。
IPMタンパクとプロテオグリカンのレクチン染色およびウエスタンブロットはSDS/PAGEで分離して行った。対になっているサンプルレーンはそれぞれレクチンまたは抗体のブロットを表している。レーン1は未消化IPMサンプル、レーン2はコンドロイチナーゼABC消化したIPMサンプルを含む。上段:未消化サンプルではPNAは150 kDのシングルバンドのみに結合する。酵素消化により、230 kDの顕著なバンドを含むいくつかの高分子量のバンドが現れる。WGAブロットではより多くのバンドが現れるが、150 kDのバンドは消化前後で共に顕著であり、それに対して230 kDのバンドはコンドロイチナーゼ消化後に最も明瞭となる。
コンドロイチナーゼABC消化後に残った2糖のコンドロイチン6硫酸を認識するΔDi6Sモノクローナル抗体は未消化サンプルとは反応しないが、コンドロイチナーゼ消化サンプルでは230 kDのバンドを強くラベルする。レーン下方には、いくつかバックグラウンドが染色されるものの150 kDのバンドはラベルされない。下段:左に示したものに相当するクーマシー・ブルー染色したポリアクリルアミドゲルから150 kDのバンド (SPACR) と230 kDのバンド (SPACRCAN) を切り出した。これらの分離したバンドはポリクローナル抗体作製に使用した。ウエスタンブロットに抗SPACR抗体を用いると150 kDに免疫反応性のシングルバンドが現れ、染色強度はコンドロイチナーゼABC消化の前後で同様である。対照的に、抗SPACRCAN抗体ではコンドロイチナーゼABC消化後のみに免疫反応が現れ、反応は主に230 kDのSPACRCANのバンドに対してである。
この区画にはコンドロイチン硫酸プロテオグリカンの存在が報告されているので3,17,18、SDS/PAGEの前にIPMサンプルのコンドロイチナーゼ消化を行いコア蛋白からコンドロイチン硫酸鎖を除いた。コンドロイチナーゼ消化によりPNAで顕著に染色される少なくとも2本の新しいバンドが認められ、PNAに結合する分子のいくつかはコンドロイチン硫酸プロテオグリカンであることを示している。同様のレクチンブロットにおいて、WGAはたくさんのバンドと結合したが、150 kDと230 kDのバンドはコンドロイチナーゼ消化後に顕著に認められた (Fig. 6) 。150 kDと230 kDのバンドをSDS/PAGE後に切り出し、ポリクローナル抗体を作製した。これらの抗体を用いると、ウエスタンブロットでは150 kDと230 kDのバンドがそれぞれ検出され (Fig. 6) 、組織切片の免疫染色を行うとIPMに対してユニークな局在を示した (Fig. 7) 。
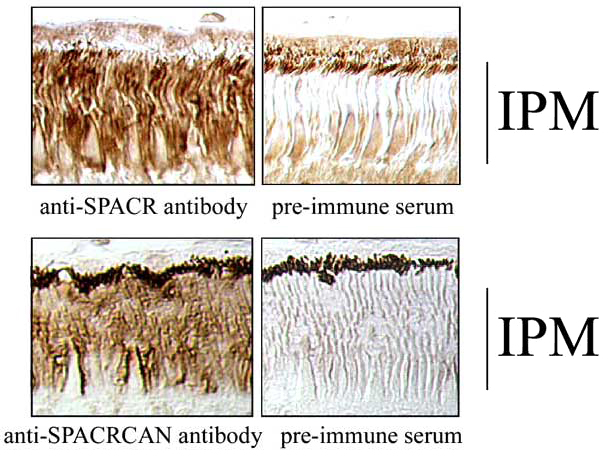
Fig. 7 IPM中のSPACRとSPACRCANの免疫局在性。
Fig. 6で述べたSPACRとSPACRCANの抗体の免疫反応の局在を調べるため、霊長類(アカゲザル)の網膜の切片を用いた。それぞれの抗体によるIPM区画の強い免疫反応と、免疫前血清コントロールによるIPM染色の欠如に注目してもらいたい。
我々は、この150 kDの糖タンパクにはN結合型および豊富なO結合型オリゴ糖鎖が存在し、そのうちのいくつかはシアル酸でキャップされていることを見出した。したがって、この分子をSPACR (SialoglycoProtein Associated with Cones and Rods)と名付けた15。SPACRの遺伝子はクローニングされ、第6染色体q14にマップされた。230 kDのプロテオグリカンの遺伝子もクローニングされ、第3染色体q11.2にマップされた。SPACRに対する高い相同性とコンドロイチン硫酸との共有結合の存在から、この分子をSPACRCANと名付けた19 (Fig. 8) 。
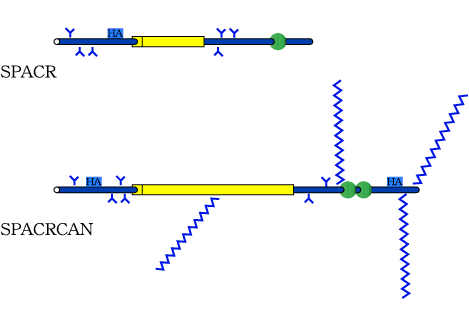
Fig. 8 予想されるアミノ酸配列中の主要モチーフを表したヒトSPACRおよびSPACRCANの分子モデル。
SPACRとSPACRCANは構造的に高い相同性を示す19 。両分子とも、多数のO結合型オリゴ糖鎖の結合可能部位を含むポリペプチド中央の領域に、大きなムチン様ドメイン(黄色の領域)を持つ。N結合型オリゴ糖鎖のコンセンサス部位(青いY字型の突出)の集団がムチン様ドメインの両側に存在する。上皮細胞成長因子(EGF)様ドメイン(緑の円)は、SPACRでは1つ、SPACRCANでは2つ、C末端付近に存在する。両分子はムチンドメインのN末端側に推定上のRHAMMタイプHA結合モチーフ(青い四角)を含む。SPACRCANはC末端近くに第2のHA結合モチーフを持つ。SPACRCANは4カ所のグリコサミノグリカン鎖が結合するコンセンサス部位を含む(これらの部位に結合した鎖は鋸歯状の青線で表した)。
哺乳類ではグリコサミノグリカン鎖が結合する通常のコンセンサス部位はSPACRには存在しないが、トリではムチンドメインのN末端側にグリコサミノグリカン鎖結合部位が存在する。コンドロイチン硫酸とNおよびO結合型糖複合体の酵素的除去によるSDS/PAGEでの移動度の変化は、糖は見かけ分子量が400 kDであるSPACRCAN分子の3分の2を占めることを示している。同様の実験より糖タンパクSPACRでは、NおよびO結合型糖鎖が見かけ上の分子量の約3分の1を占めることを示している。
我々はアグリカン由来のHA結合複合体を用いて、蒸留水分離をしたIPM中のHAも同定した19,20。予想されるSPACRとSPACRCANポリペプチドの配列中にRHAMMタイプのHA結合可能モチーフを発見し21、
これらの分子がHAと相互作用する可能性が示唆された (Fig. 7)a
。これらの分子の相互作用を直接に測定するために、外来性のHA、SPACR、コンドロイチナーゼ消化したSPACRCANを用いていくつかの沈降実験を行った。この実験から、これらの新しいIPM分子は、HA存在下では塩化セチルピリジニウム中で沈殿するが、HAが存在しないと塩化セチルピリジニウム中でも沈殿しないことがわかった。この結果より、これらの分子はHAと直接結合することが強く示唆された19,20。
a このシリーズのTurleyとHarrisonの総説を参照。
IPM中のHAの分布を検索するために、HAを保持した状態でヒト網膜の切片を検鏡できるように、特異的プローブとしてアグリカン由来のビオチン化HA結合複合体(bHABC)を用いた (Fig. 9) 。硝子体側の網膜表面と脈絡膜の結合組織は強く染色され、IPMは全体に弱い染色が認められた。Streptomyces hyaluronidaseはHAに対して高い特異性を持つため、組織切片上のbHABCの局在の特異性を検証するために多くの研究者がこの酵素を用いた消化を行っている。驚いたことにIPM中のHA染色はStreptomyces hyaluronidase消化に対して抵抗性であった。そのために、約22糖鎖長のHAオリゴとbHABCのプレインキュベーションにより染色をブロックするコントロール実験の必要があった。これらの吸収コントロールはIPMの染色を完全に抑え、プローブは実際にIPM中のHAと相互作用していることを示した (Fig. 9) 。
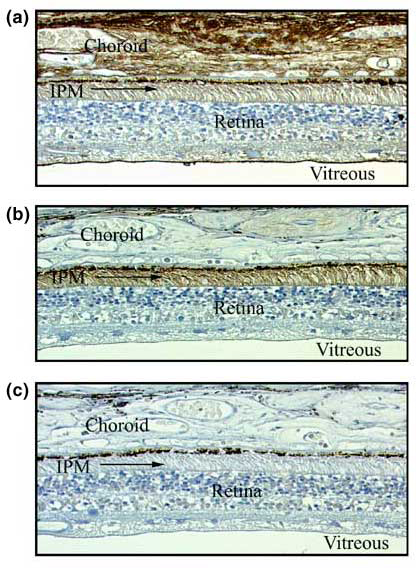
Fig. 9 IPM中のHA分布。
切片は54歳男性ドナーの眼から作成した。(a)この切片はHA分布を実証するためにbHABCで染色した。脈絡膜および水晶体と接する網膜表面が強く染色される。IPMは中等度に染色される。 (b)この切片はbHABC染色の前にStreptomyces hyaluronidase消化を行った。この酵素処理では脈絡膜と水晶体側の網膜表面の染色は消滅したが、IPM中のHA染色レベルは未消化サンプルより増強されている。(c)未消化およびStreptomyces hyaluronidase消化した切片に、あらかじめ22糖鎖長のHA断片とインキュベートしたbHABCプローブを用いると染色は全て消滅し、網膜色素上皮内の黒いメラニン色素のみが残る( Fig. 10 参照)。
IPM中のHAのStreptomyces hyaluronidase消化に対するこの奇妙な抵抗性を探究するために、他のHAを分解する酵素であるStreptomyces hyaluronidase、精巣ヒアルロニダーゼ、コンドロイチナーゼABCを同様の実験に用いた。これらの酵素はHAと同様にコンドロイチン硫酸も分解し、それぞれIPMの染色も完全に消滅させた。結果は、これらのコンドロイチン硫酸とHA両方を分解しうる酵素はIPM中のHAを分解するが、HAのみを分解しうる酵素はIPM中のHAを分解できないことを示している (Fig. 10) 。
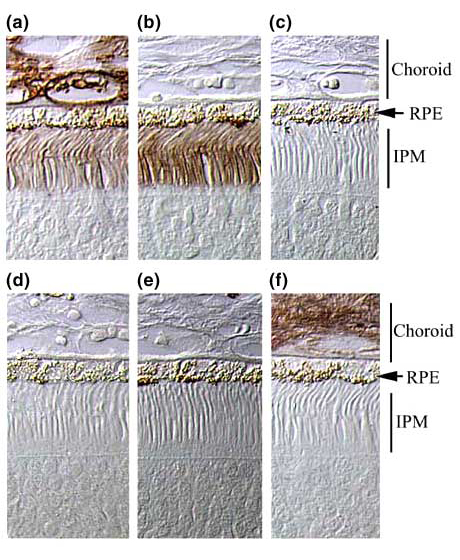
Fig. 10 IPM中のHAの酵素分解に対する感受性。
bHABCとインキュベートしたコントロールは、IPM中のHAの弱い染色と脈絡膜中のHAのより強い染色を示している(a)。Streptomyces hyaluronidase(HAに対し特異性高い)消化後、脈絡膜中のHA染色は消失するが、IPM中のHA染色レベルは未消化コントロールより増強されている(b)。22糖鎖長のHA断片とインキュベートしたbHABCを用いるとStreptomyces hyaluronidase 消化後に存在したHA染色はすべて消失する(c)。組織をStreptomyces hyaluronidase(HAおよびコンドロイチン硫酸を分解する)で消化するとIPMと脈絡膜中の染色は消失する (d)。組織を精巣ヒアルロニダーゼ(HAおよびコンドロイチン硫酸を分解する)で消化するとIPMと脈絡膜中の染色は消失する(e)。組織をコンドロイチナーゼABC(コンドロイチン硫酸およびHAを分解する)で消化するとIPM中の染色は消失するが、脈絡膜中の染色は残存する(f)。これらの消化は、コンドロイチン硫酸とHAの両者を分解する酵素はIPM中のHAを分解できるが、HAのみを分解する酵素はIPM中のHAを分解できないことを示している。これらの結果より、我々はIPM中のプロテオグリカンSPACRCANに共有結合するコンドロイチン硫酸がStreptomyces hyaluronidaseのHA骨格への接近を妨げると考える。コンドロイチン硫酸が分解されると、複合体中に深く埋もれているHAは分解されやすくなる。
以上の結果より、コンドロイチン硫酸が共有結合しているプロテオグリカンSPACRCANがStreptomyces hyaluronidaseのIPM中のHA骨格への接近を阻止すると考える。正常ではコンドロイチン硫酸に遮蔽されているHAは、コンドロイチン硫酸が分解されると分解に対して脆弱となる。これらの結果より示唆されるSPACR、SPACRCANとHAの関連を表したIPMのモデルをFig. 11に示す。
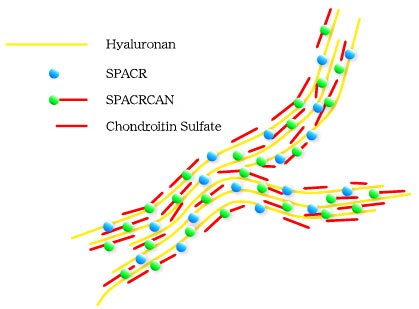
Fig. 11 IPM中のHAとSPACRおよびSPACRCANの関連。
SPACRおよびSPACRCANとIPM中のHA骨格の結合モデルはFig. 10に示したHAの酵素分解のデータに基づく。SPACRCANに結合するコンドロイチン硫酸鎖は、HA骨格をHA特異的な分解酵素から保護する。コンドロイチン硫酸とHAを攻撃する酵素がHA骨格を分解できるのは、コンドロイチン硫酸鎖の分解により、深部にあるHA骨格が酵素に曝されるためである。
新しい糖タンパクSPACRとプロテオグリカンSPACRCANの解析や、それらの実証された相互作用から、我々はHAがIPM中のこれらを含む分子をアンカーする基本的な骨格として機能するのではないかと考えた。他のHAに結合する分子は、IPMと接する細胞(ミューラー細胞、光受容体細胞、網膜色素上皮細胞)の細胞膜にある。これらの中には、広く知られているHA結合蛋白であり、ミューラー細胞の微絨毛の尖端に存在するCD 446や、網膜色素上皮(RPE)の頂側領域に局在するRHAMM22が含まれる。光受容体の細胞膜に存在するプロテオグリカンであるニューログリカンCは、細胞外ドメインにRHAMMタイプのHA結合モチーフを含む23。 酸素調節光受容体タンパク(Oxygen-regulated photoreceptor protein-1: 以下ORP-1) をコードする遺伝子の発現が光受容体内に認められ、これが網膜色素変性症の遺伝子座に関連することが最近になって発見された24。 ORP-1の予想されるアミノ酸配列はHA結合モチーフと推測される部位を14カ所含む。つまりはIPMと接している細胞表面のHA結合モチーフの存在が、細胞とHA骨格との相互作用を可能にする構造的な構成成分となっている。IPMの両側の細胞とHA骨格との結合が、このようなタンパク−糖や糖−糖の相互作用を介してIPMによる網膜とRPE間の構造的な連結の形成を可能にしていると考えられる(Fig. 12) 。
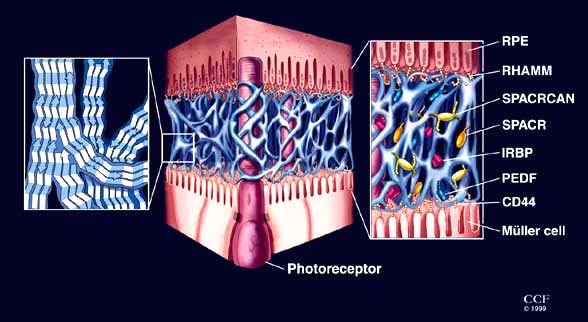
Fig. 12 IPM中のHA分布。
イラストは、それぞれのレベルのIPMの基本骨格に関与するHAとヒアルアドヘリンの機構を示す。左のパネルは、マトリックスの基本骨格構造を形成する直鎖状HAの、逆並行配置の可能性を示す。b
中央のパネルは、 Fig. 4の一番下のパネルで示したようなIPMの電顕像を改作して描いた、細胞外区画の連続した三次元骨格複合体(スケールは正確ではない)である。右のパネルは、IPMと接する細胞表面のHA結合モチーフ(CD44はミューラー細胞頂側微絨毛に存在し、RHAMMはRPE頂側突起の尖端に存在する)やIPM中に分泌された分子(SPACR、SPACRCAN、色素上皮由来因子(pigment epithelium derived factor:以下PEDF)、光受容体間マトリックス結合タンパク(interphotoreceptor matrix-binding protein:以下IRBP)と骨格との相互作用(スケールは正確ではない)を描いたものである。IRBPは食塩水でIPMから取り除けることから、この不溶性IPM複合体の一部とは考えられていない。(イラスト:Cleveland Clinic Foundation 医学イラストレーター David Schumick)
b このシリーズのスコットの総説を参照
この章で検証してきた事実は、HAがIPM構築の基本骨格を形成するという提案と一致するが、この新しいマトリックス構築モデルに内在している仮説のいくつかの側面を検証するためには、追加実験が必要である。さらなる研究に向けて重要な領域は:(A) IPM中に存在するHAと他の分子の増減(ターンオーバー)のパターンと速度の測定;(B) IPM中の骨格に結合する他の分子の同定;(C) 骨格中に存在するHAを合成する細胞の同定;(D) IPMに接している細胞が、HA骨格へ結合するために機能する他の分子の同定;(E) 網膜剥離に先行する骨格中の変化;(F) 網膜再接着に続く骨格の修復過程の理解。以上の点や他のIPMに関する研究が完了すれば、やがてこの新しいマトリックスにおけるHAの重要性がより完全に理解されるであろう。
謝辞-この研究に使用したヒト組織を提供したCleveland Eye Bankに謝意を表する。本研究はNational Institutes of Health (Bethesda, MD)、Foundation Fighting Blindness (Hunt Valley, MD)、Retina Research Foundation (Houston, TX)からの助成金およびCleveland Clinic Foundationの資金援助を受けた。このIPMの構築モデルの発展のための研究や討論に関わった同僚、共同研究者を以下に記す:Hugh H. Varner, Peter M-T. Ho, Steven J. Fliesler, Akihiko Tawara, Masayuki Iwasaki, Robert A. Landers, Lifang Tien, Kathy Myers, Matthew M, LaVail, Victoria C. Foletta, Jung Wha Lee, Shreeta Acharya, Ignacio R. Rodriguez, W. Scott Young, III, Ronald J. Midura, Preenie deS Senanayake, Raija Tammi, Markku Tammi, Anthony Calabro, Karen G. Shadrach, Qiuyun Chen, Kazutoshi Nishiyama, Vincent C. Hascall。最後に、妻であるMary E. Raybornの長年の公私にわたる協力に感謝する。彼女の素晴らしい技術的な専門知識と根気強さなしには、この論文中の画像の多くは生み出されなかったであろう。