
氏名:Eva Turley
Eva TurleyはRHAMMを発見し、クローンを得た細胞生物学者であり、ヒアルロン酸、ヒアルロン酸受容体、細胞の移動と浸潤を制御するシグナル伝達経路などの領域における専門家である。彼女はまた、RHAMM開発や製薬会社向けのヒアルロン酸治療剤における経験が豊かであり、これに関する特許を15件以上保持している。彼女は現在、Sick Children病院のシニア科学者であり、トロント大学の医薬、病理学部門および解剖学と細胞生物学部門の教授である。

氏名:Rene Harrison
Rena Harrisonは細胞、発生生物学を含むシグナル伝達と細胞骨格系の力学に力点をおいたいくつかの分野の研究を手がけてきた。彼女は理学士をWinnipeg大学で、理学修士をManitoba大学で終了した。彼女は現在、Turley博士のもとで博士過程を終えるところであり、カナダ医学研究協会の奨学金を得ている。彼女はヒアルロン酸受容体の細胞内シグナル伝達の動態について研究を継続する予定である。
RHAMMはヒアルロン酸に結合する能力でまとめられるhyaladherinsとよばれる一群の多様なタンパク質に属する。これらのタンパク質は細胞外または細胞内の分布とヒアルロン酸に結合するタンパク質一次構造によって分類することができる (図1).1
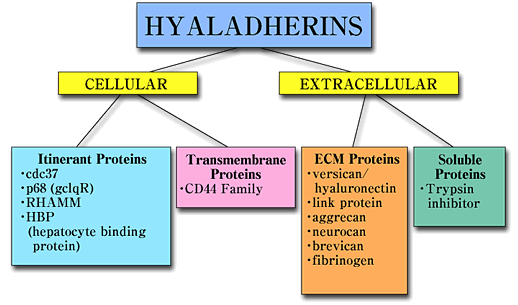
図1 Hyaladherin ファミリーのタンパク質。
Hyaladherinはヒアルロン酸に結合能を有する共通の性質でまとめれた異種タンパク質群である。これらは細胞の内外の存在場所によって分類することもできる。RHAMMはhyaladherinに属し、幾つかの場所で発生するようであり、それ故巡回するhyaladherinと呼ばれてきた。
Hyaladherinは細胞外マトリックス、細胞表面上、細胞内に見いだされる。ほとんどの既知のhyaladherinは100アミノ酸からなる”リンクモジュール”を介してヒアルロン酸に結合する。RHAMMのようなhyaladherinはいくつかの塩基性アミノ酸を含む9〜11アミノ酸によってヒアルロン酸に結合するサブグループである 1。この後者のグループに属するhyaladherinで同定されているほとんどのものは細胞内タンパク質であるが(図2)1,2 、RHAMMは細胞内と、細胞表面に多様な形態で存在する点で特徴的な分子である 。2-4 しかしながら、RHAMM はその細胞における分布を決める分子上の原理と、多様なタンパク構造を生み出すそのメカニズムを理解するという点についてはきわめてとらえどころのない分子のひとつである。もともとこのタンパク質はニワトリ胚心臓の線維芽細胞がコンフルエントに達する以前の粗な状態の細胞から漏れ出るか、または分泌されるかして、その培養上清から単離された1。生成途上のタンパク質分子はシグナルペプチドまたは膜貫通部位を持たないので、シャペロンタンパク質を介して細胞から出て、膜タンパク質、 GPI結合タンパク質との結合を介して細胞表面に取り込まれるのであろう。
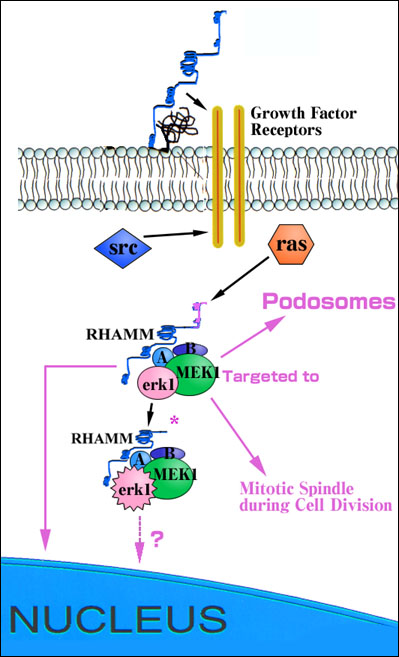
図2 ras/erk1およびsrcのシグナル伝達経路を制御するRHAMMの役割の想定図。
細胞表面のRHAMMはPDGF受容体の様な成長因子受容体に接することによってerk1の活性化を修飾すると提唱されている。細胞内RHAMMフォームはerk1結合タンパク質であり、MEK1のレベルでsrcとrasの両者の下流に作用し、rasを介するシグナルを制御する。RHAMMv4はおそらくポドゾームや有糸分裂紡錘体のようなダイナミックな構造体中のでは下流域の基質と上流の活性化体に近接して、MEK1/erk1や未同定の附属タンパク質(A,B)複合体を持ち込むことにより活性化を促進する。
抗体やペプチドによる阻害実験と同様に、細胞内に存在するRHAMMアイソフォームから重要なドメインを欠失させたドミナントネガティブ変異体を使うことによって、細胞表面と細胞内に存在する両方のRHAMMが細胞の運動性と細胞周期のG2M期を通過するのに必要であることが示された。細胞内のRHAMMフォームはerk1(細胞外の調節キナーゼからの)の結合タンパク質であるが、細胞表面のRHAMMフォームは PDGF受容体のような必須蛋白を介したシグナル伝達を修飾する協同受容体として働くようである。細胞内RHAMMのひとつ(v4)は、過剰発現により形質変換がおこる。
構成的に発現され、最も一般的なRHAMM mRNAはヒトでは85kDa、齧歯類では95kDaの最も大きい細胞内RHAMMタンパク質をコードし、それはv5と呼ばれている(図3、図4)。このRHAMMタンパク質はAb 1-3と反応する(図5)。v5にも多様な選択的スプライシングバリアントが存在するという証拠が蓄積されつつある (図3、図5)。4,7,8 より短いRHAMMフォーム(例、図3のv4)は抗体Ab2, Ab3(図5)と反応し、v5のN-末端領域を持ち、細胞を培養皿に播いてすぐや、組織傷害、またはsmall GTPaseであるras(rasheed sarcoma virus由来)の活性化に伴って出現する。
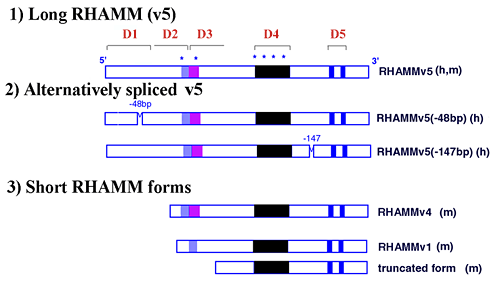
図3 ヒト(h)およびマウス(m)のRHAMMの予想されるドメイン構造
機能ドメイン(D1-D5)は構造/機能の解析により同定されており、 RHAMMを介する細胞の移動性と細胞周期の進行に必要とされている。D1は新規なタンパク質であり、erk1キナーゼの活性化を促進するRHAMM配列の機能を抑制的に制御する; D2は不完全なロイシンジッパーのコードをもち、RHAMM介在の細胞運動性とポドゾーム形成に必要とされている; D3は細胞内RHAMMとMEK1の相互作用に必要な新規な配列を持つ; D4は齧歯類では8回までの繰り返し構造をとる新規な配列をもち、細胞内RHAMMへのerk1の結合に関与している; D5はヒアルロン酸結合モチーフのコードをもち、細胞表面RHAMMとヒアルロン酸との相互作用および細胞内RHAMMのerk1への結合に関与する。 RHAMMはCD44のように多様な形で存在すると報告されていて、そのうちのある分子は最長のRHAMM(v5)のmRNA翻訳の際のオールタナテイブスプライシングにより生成される.幾つかのRHAMMの短い活性フォームもまた報告されており、これらは個々のmRNAの翻訳、v5翻訳の内部開始コドンの使用、あるいはv5タンパク質のタンパク分解によっても生成する。
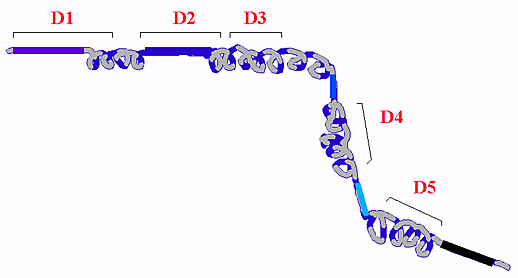
図4 予想されるRHAMMの2次構造およびそのドメイン構造
2次構造解析の結果は、ほとんどのRHAMMには機能ドメインの手前にしばしば小さな非コイルドコイルによって中断されたコイルドコイルが存在することを示している。
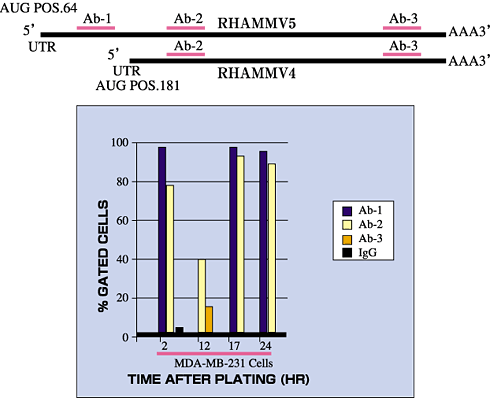
図5 RHAMMフォームはその発現が制御されている。
悪性の乳ガン細胞株(MDA-MB231)における細胞表面RHAMMの発現(3種の異なるRHAMM抗体により検出した)は、細胞播種後の時間により変動する。トランスフォームした線維芽細胞は、分子量や抗体反応性により同定されるv5(95kDa)とv4(73kDa)に相当する2つの主要なRHAMMフォームを発現する。73kDaの方はv5に見られるN末端構造をコードしていないのでv4を表すものと考えられる。
v5はほとんどの組織中に見いだされるところの通常発現のmRNA転写体の全長から翻訳される。v4をコード化した全長のRHAMM m-RNA転写体(図3)はv5転写体とは異なる5'未翻訳領域、D2を持っている。2 v4転写体は僅かであり、細胞の播種後直ちに発現する。しかしながら、v4タンパク質は、v5 mRNAの転写体やv5タンパク質の分解物中に存在する内部開始コドンの使用のような追加の機作によって発生することもあるだろう。
RHAMMは、細胞の運動性または細胞周期のシグナル伝達を調節することが知られている細胞内または細胞表面のタンパク質に共通の機能的ドメインの一次構造に類似性を示さない珍しいタンパク質である。というわけで、RHAMMに見られる生物学的効果に必要な鍵となる部位を同定するために、RHAMMの構造と機能の相関を求める一次構造の徹底的な解析が進められた。将来の挑戦としては、このhyaladherinが細胞の挙動をコントロールするメカニズムの明確な図式を提供するためにRHAMM結合タンパク質を同定することである。
RHAMMの163番目のアミノ酸からC末端まではその大部分がコイルドコイル構造で、この二次構造を中断する非コイルドコイルがある(図5)。コイルドコイル構造は自己会合を可能にすると考えられるが、そのことはRHAMM変異体がドミナントネガティブとして明らかに効果的に阻害する理論的根拠を与えるものであろう 。2 D2 - D5はおのおのがRHAMMv4による細胞移動と細胞周期の進行に通じて必要である。これらの領域のどの一つが欠落や変異してもRHAMMのシグナル伝達する能力や過剰発現して線維芽細胞の形質転換をさせる能力を失わせるに十分である。1 D1はD2 - D5のこのような機能を抑制的に制御しており(図4)、したがってv5はRHAMMの非活性型を現している。他方、v4のような短縮型(truncated form)はこのhyaluadherinの活性型を現している。この様にRHAMMは、ペプチド配列を除くことによって活性化されるrafのような発癌遺伝子に似ている。
v5特有のN-末端D1領域は、下流域のRHAMM配列の機能を負に制御している全く新しい配列であり、そのD2 - D5の機能を制御のしかたはまだ不明である。その構造はsrc(肉腫由来)相同性結合領域3(SH3)の存在と多様なerk1燐酸化部位によって特徴づけられている。 D1は附属する調節タンパク質と結合してRHAMM下流域の少なくとも一つを覆うことができるのかも知れない。あるいはSH3結合領域はv4とは別の細胞内区分にあって、シグナルの移動や細胞周期の推移に必要なキー基質のようなerk1の接近を制限しているかも知れない。
D2は不完全なleucine zipperのコードを持っており、細胞表面のRHAMMを細胞外マトリックス中のフィブロネクチンへの結合やプロドゾームの形成、細胞移動性の増進およびメタロプロテナーゼの放出に必要な相互作用を可能にしていることが示されている。6
細胞内RHAMMのD3はRHAMMとMEK1間の連携を仲介し、RHAMMの免疫沈降に伴って検出されるRHAMM/MEK1/erk1複合体を形成する3。MEKはRHAMMと in vitroでは結合しないので、この相互作用は間接的である。興味深いことに、D3はもう一つのMEK1結合タンパク質であるMP-1に存在する6アミノ酸配列、VSLEKEL、をコードしている。
D4はネズミのRHAMMに8回まで繰り返しがある21アミノ酸配列をもち、RHAMMがerk1と完全な結合をするのに必要とされる。この領域に対する抗体を培地に加えるとヒアルロン酸効果に似たような1、細胞の移動性や焦点接着の頻度の増進があり、この領域が細胞表面のRHAMMの機能にまた重要であることを示している。Prodom blast検索では、この領域はシグナル伝達に関与する91タンパク質のグループに分類されている。
RHAMM領域の機能の最初の報告はD5に存在するヒアルロン酸結合モチーフであった。このモチーフはcdc37やp68.1のような他の細胞間hyaladherinにも共通な塩基性アミノ酸の配列をコードしている。これらの領域はRHAMMの唯一のヒアルロン酸結合領域であり、外部からのヒアルロン酸によって移動性シグナルを発する鍵をにぎっている。2,9細胞内RHAMMではD5がerk1とRHAMMとの結合を仲介する。したがって、このことは細胞表面RHAMMはD5領域を通じてヒアルロン酸に結合し、細胞内のRHAMMフォームはこの部分を用いてerk1に結合することになる。このことは細胞内RHAMMフォームのこの領域の変異がerk1の活性化をブロックするという事実に一致する。2糖輸送の合図はv5のN-末端と全てのRHAMMフォームに共通なC-末端配列にあり、ヒアルロン酸を細胞内へ輸送するために必要なのであろう。10
さらに、すべてのRHAMMフォームに存在するサイクリン類似構造はRHAMMが細胞周期に関与しているとすることと一致する 。5しかしながら、パートナーとしてのタンパク質とこれらの興味深い相同性についての詳細な分子機能に関してはまだ明らかになっていない。
最後に、RHAMMはN-グリコシル化、ミリスチン化と、特に多くのセリンースレオニンリン酸化の可能部位を持つ。これらの修飾は細胞内分布とタンパク質相互作用に影響を与えると思われるが、まだ明らかではない。
細胞内分布
RHAMMはいくつかの研究室によって細胞表面、細胞質内と核に存在することが報告されている 。1,11 興味深いことに、RHAMMの生物学的に活性なフォームであるv4は主として、ポドソームや早い代謝回転を示す(たとえば非アセチル化)微小管などの動的な細胞内構造体や、紡錘体などの動的微小管構造体には局在するが(図6)、核には存在しない。それとは対照的に、v5は細胞内と核にびまん性に存在する。走査電子顕微鏡により細胞表面のRHAMMは、その分子的性状はまだよく判っていないが、伸びていこうとする微小絨毛に主に局在することが示されている。6 RHAMMの細胞表面フォームの発現は特に一過性に変動して発現し、細胞を播くとすぐに発現が上昇し細胞-細胞接触が増えるに従って徐々に低下する 。3,6 しかしながら、ヒアルロン酸のような分子の添加により、RHAMMがおそらくカベオリから細胞表面にすぐに現れる(図7)。3 この最後の結果から、いくらかの細胞内RHAMMは細胞表面に送り出されるために蓄えられていなければならないことが示唆される。
細胞表面のRHAMMはあまり動的ではなく疾病に伴ってより恒常的に発現されているようである。例えば、細胞表面のRHAMMは浸潤性の高い一群の多発性骨髄腫細胞、乳ガン細胞4の細胞表面にいつも検出され、関節症患者の関節液から単離したマクロファージに低いレベルで検出される。図3に示すRHAMMの選択的スプライシングをうけたフォームの多くは形質転換した細胞、またはガン生検で検出されるが、それらの細胞内分布は判っていない。
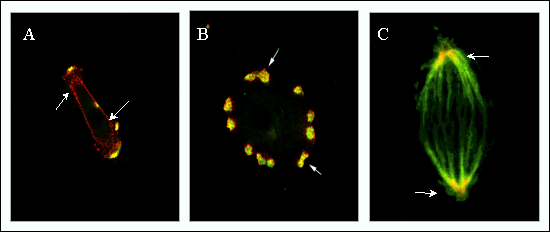
図6 RHAMMは一時的な構造体をとり、その発現は疾病過程で細胞表面にアップレギュレートされる(A,B)。
RHAMMとポドゾームのマーカーであるコンタクチンの2重免疫染色により、これらがプロテアーゼを放出する限局した部位に存在する。細胞播種後の初期(A,2時間)RHAMMは先ず細胞膜に局在しているが、細胞播種後8時間では(B)発達したポドゾームに移行する。(C)RHAMMとチュブリンは有糸分裂紡錘体の中で共存している。
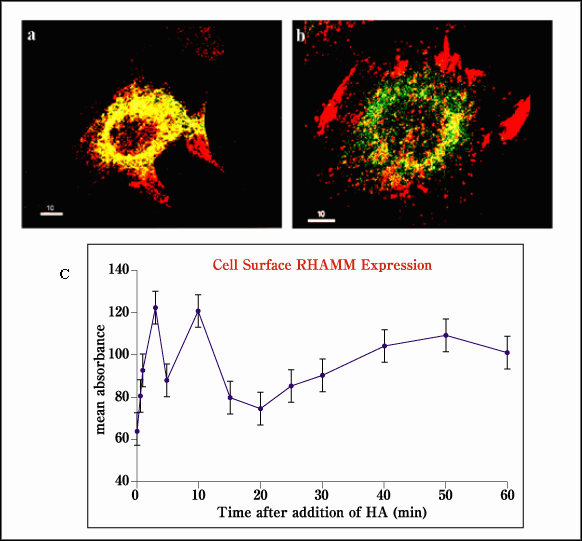
図7 細胞表面RHAMMは外因性ヒアルロン酸に応答して細胞表面上に‘瞬時出現’する。
RHAMM(赤)とカベオリン(緑)の同時局在は、ある細胞内RHAMMはカベオリンに蓄えられていることを示唆している(b)。細胞へのヒアルロン酸の添加は、FACs(c,Ab-3)により検出されるように細胞表面のカベオリからRHAMMの急速な再分散を引き起こす。
細胞種による分布
RHAMMはほとんどの正常な鳥類、ほ乳類の細胞で発現されている。それらには、線維芽細胞、平滑筋細胞、内皮細胞、マクロファージ、未分化胸腺細胞、B細胞系譜に属する細胞、骨髄間質細胞、ケラチノサイト、精子、アストロサイト、アストロサイト腫、中枢神経細胞、ミクログリア、伸びていこうとしている嗅球神経細胞、肺腺癌、悪性膵臓細胞、悪性肺上皮細胞が含まれる。 一般に、上記細胞の細胞表面のRHAMMと小型のRHAMMフォーム(例、v4)の最も高い発現は、継代後、早い時期に見られ、それは細胞が伸展し、移動と細胞周期を開始しているときである。
組織分布
成体または胎児組織でのRHAMMの発現の完全な研究は発表されていないが、RT-PCR解析法を用いた未報告の結果としてはv5はほとんどの組織に存在する。限られた組織の免疫組織化学による解析のわずかの報告ではRHAMMの発現は組織の中でも限られた細胞に見られるらしい。例えば、RHAMMはラット脳の高い応答性を示す、分岐している青斑では他の脳の細胞に比較して高い発現を示し12,13、発達中の胸腺の移動している髄質胸腺細胞に高い発現が認められる。
RHAMMが制御するシグナル伝達の特徴は、特定のシグナル伝達経路を活性化するにも関わらず同じ経路がPDGFのような増殖因子によってさらに活性化されうる程度にコントロールすることである。3,6 RHAMMが制御するシグナル伝達の重要な標的は細胞内骨格らしい。例えば、インテグリンや増殖因子がクラスター化する部位である接着斑を崩壊させるRHAMMv4の活性は、インテグリンを必要とする増殖因子のシグナル伝達を制限する能力に関わるであろう。
RHAMMv4は少なくとも二つの分子スイッチ、srcとsmall GTPaseであるp21 rasを通じてシグナル伝達を促進する(図2)。この両者は癌遺伝子として働き、細胞内骨格の会合、細胞増殖、移動を調節する事が示されている。特に、srcはチロシンキナーゼ活性を必要とする増殖因子に応答して細胞移動をおこすシグナル伝達に関与し、しかもまた、アクチン細胞内骨格の変化を仲介する。細胞表面RHAMMはヒアルロン酸とフィブロネクチンの両者に相互作用し、FAKとcortactinおよび接着斑の回転に伴って起こる出来事などのようなアクチンとインテグリンに結合する主要なタンパク質のリン酸化を調節する。2 RHAMM/ヒアルロン酸相互作用の結果、タンパク質チロシンリン酸化の変化がsrcを介して起こるが、srcは細胞表面のRHAMMによって一過性に活性化され、接着斑がはじめに配置されるラメラでRHAMMと相互作用する。9 細胞表面のRHAMMが制御するsrcの活性はこのhyaladherinが増殖因子を介したシグナル伝達系を修飾する活性に関与するのであろう。3,6
srcに対する影響に加え、細胞表面と細胞内のRHAMMフォームはp21 rasを介したシグナル伝達に必要である(図2)。Rasは少なくとも3つのMAPキナーゼ経路を含むいくつかの下流の経路を制御する。興味深いことに、RHAMMはこれらの内のたった一つerk1キナーゼ経路にのみ働くようであり、この相互作用には移動、増殖をシグナルするv4の能力を必要とする。 すべての細胞内フォームのRHAMMはerk1キナーゼに直接結合することができ、たいていのフォームはその上流のキナーゼ活性化因子であるMEK1に間接的に相互作用する。3 しかしながら、RHAMMの短いフォーム、特にv4はMEK1/erk1複合体の段階に働くことによってerkキナーゼを強力に活性化する。
v4はerkと分裂紡錘体とポドソームに共存し(図8)、この会合は一方で、微小管の代謝に、他方、ポドソームの安定性に必要であるようである。v4の機能はerk1/MEK複合体を特異的で動的な細胞内構造体の上流の活性化因子や修飾分子の所に局在させることなのであろう(図2)。7 v4の過剰発現はerk1キナーゼ活性を恒常的にバックグラウンドの4-5倍上昇させ、この活性化の程度はAP-1形成を促進するのに十分で 6、AP-1の発現はMMP-9のような遺伝子を制御した。RHAMMv4はerkを定常状態の4−5倍まで活性化するが、それはまた、IL-1、TNFαやPDGFなどの初期炎症サイトカインによるerkのさらなる活性化を制限することにもなり、RHAMMのない場合には20倍までerkの活性化を促進する。6
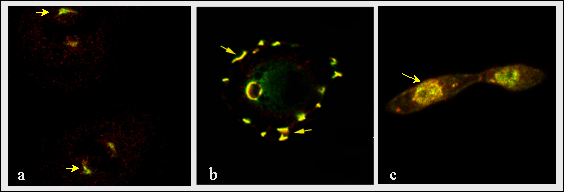
図8
ヘマグルチニンタグをつけたRHAMMと有糸分裂の紡錘体中のerk(a)、ポドゾーム(b)および核(c)(矢印)の共存。両分子の共存は、動的な細胞質構造に対しこのmapキナーゼに位置するv4の主要な役割を予言している。Erkは例えば、有子分裂紡錘体において種々の基質をリン酸化し、RHAMMは有糸分裂の際の基質へerkの限局した接近を可能にする鍵となる附属機能を演じているかもしれない。
上記のように多様なRHAMMフォームは疾病で過剰発現されていると報告されているが、v5フォームはほとんどの成体の組織において恒常的に発現されているようである。それゆえに、RHAMMの短いフォームが、たとえばブレオマイシンによる肺の傷害または、皮膚の切除傷害などの傷害に応答して正常組織でも一過性に現れることが最近示されたことは魅力的である。ラットの皮膚切除傷害においてRHAMMv4は傷害後、速やかに発現されるが24時間後までには消失する(図9)。その間、RHAMMはケラチノサイト、マクロファージと移動してきた線維芽細胞で発現が上昇している。
このような観察に一致して、erk1に結合、またはMEK1と複合体を作れないv4の機能阻害変異体をケラチノサイトに遺伝子導入して発現させると、erkの活性化が減少し、切除傷害の治癒過程に変化が起き、特に、傷害部位の収縮と再上皮化が制限を受ける(図10)。創傷治癒におけるRHAMMの影響は多面的らしく、RHAMMペプチドを齧歯類の皮膚傷害に使うと、収縮の減少が起こることはトランスジェニックモデルの結果と一致するが、III型コラーゲン合成の阻害もまた起こり、これが斑痕形成の減少を引き起こしてもいるようである(図10)。これらの効果のいくつかは傷害部位への線維芽細胞とマクロファージの移動を阻害することによるようである。ラット肺にブレオマイシンを注入すると同時にRHAMMペプチドを投与すると、マクロファージの流入を阻害し、その結果、肺組織の線維化が明らかに減少する。傷害後、慢性炎症や細胞の形質転換に引き続きRHAMMが強く発現されることから、このhyaladherinの発現制御に増殖因子や癌遺伝子が関与していることが予測されるが、このことはTGFβや突然変異によって活性型となったrasがRHAMMタンパク質の発現を促進するという報告とよく一致する。
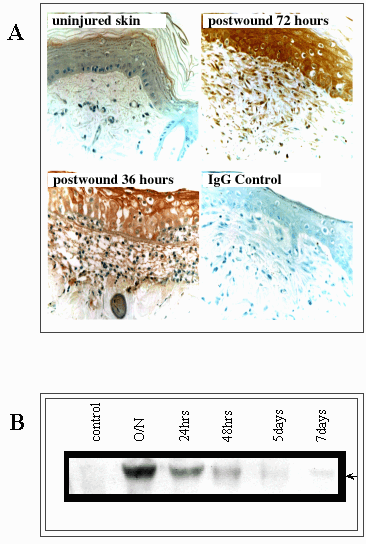
図9 RHAMMの発現、特に活性化した73kDa(v4)のそれは組織傷害に引き続いて一時的に増幅する。
(A)摘出した皮膚傷害部位におけるRHAMMの免疫染色は、ケラチノサイト、浸透するマクロファージおよび侵入する線維芽細胞においてこの巡回するhyaladherinのアップレギュレーションを示した。(B)傷害に対応したこの細胞の流入は、73kDaRHAMMタンパクの一時的な発現に符丁する。
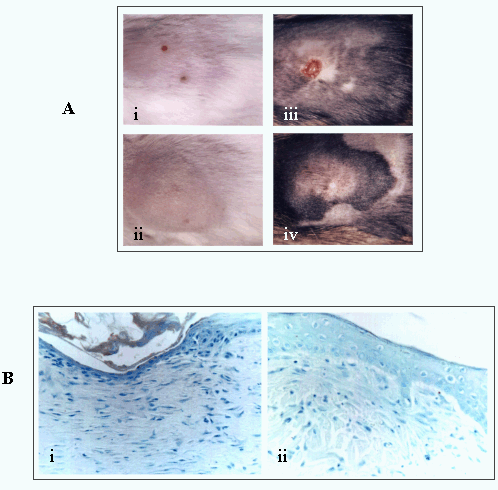
図10
(A)創傷治癒の過程は負のRHAMMv4を優性に発現している遺伝子導入マウスでは修正されている。(i,ii)は天然型マウスにおける切除術による損傷の3日(i)と1週間(ii)での傷害を示す。(iii,iv)は同時期の遺伝子導入マウスのそれを示す。 RHAMM機能の削除は傷害部位の収縮を阻害する。
(B)同様に摘出傷害部位にあるRHAMMペプチド類似体を適用するとコントロール(i)に見られる収縮(ii)が阻害される。
上記のデータは一過性に活性型のRHAMM(60-70kDa)が組織や細胞の傷害時に細胞を活性化する過程を調節するのにかかわるというモデルと一致する(図11)。組織中の細胞は一般に細胞の代謝によって一定の間隔で中断される細胞分化の定常状態に維持されている。傷害や身体的な突然変異などの害が及ぶと、細胞は傷害に応答するように活性化され、この活性化は正常では厳密にコントロールされた応答として起こるとすることは理屈にあっている。例えば、組織傷害に引き続き、血漿の流入と血小板の局所的な付着がサイトカインの急激な増加を引き起こす。もし細胞が直ちに最大にこれらの因子に応答すると、無秩序でコントロールできない修復の過程をたどることになる。活性化RHAMMと細胞表面RHAMMフォームの発現は、ポドソームの出現、erkキナーゼの活性化を調節していくつかのメタロプロテアーゼを発現させ、増殖因子の応答能を制限するなどによって特徴づけられる傷害の遷移過程を可能にする。この状態はマトリックスの再構成の開始を可能にし、その結果、局在する増殖/運動性因子の限定された活性化が起こり細胞移動/細胞周期が開始される。部分的には、細胞外マトリックスの再構成の結果、傷害部位に白血球が集積した後に余分にサイトカイン/増殖因子を供給し、結局、治癒過程を進行、拡大することが可能になる。このように、傷害の途中経過でのRHAMMの発現は、細胞のサイトカインに対する応答性をコントロールし、RHAMMが消失するとインテグリンの集積が起こり接着斑の形成が進んで応答性の増大が可能になる。
このモデルは一過性に、特に、細胞表面に発現されるRHAMMフォームが、治癒過程にある組織の線維化と斑痕形成の程度を制限し、これらのRHAMMフォームを発現していない非傷害組織に毒性を持たない優れた治療の標的を提供している。皮膚の切除傷害に伴う斑痕形成が、RHAMMペプチド存在下では減少することを示すデータは、確かにこの可能性を立証している。
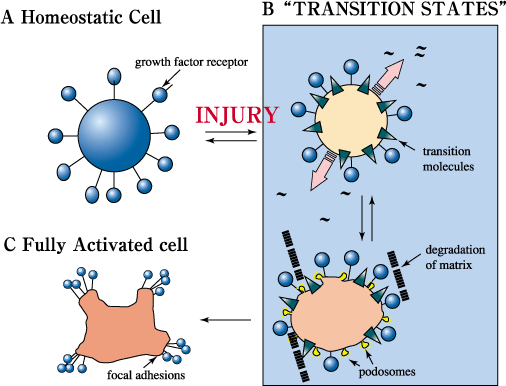
図11 傷害への対応期におけるRHAMMおよび巡回するhyaladherinの役割の提唱モデル
傷害に続いて、細胞がサイトカインや生長因子の「嵐」にさらされると,細胞はいくつかの中間ステップを経由するしっかりした制御過程のなかで活性化されるものと予測される。このことは、サイトカインや生長因子に高度に反応する十分活性化された細胞に対して、制御された進行を可能とさせる。傷害のある環境では、RHAMMや他の一時的な分子は、細胞の初期活性化に関与し(すなわち、ポドゾームの生産,マトリックス再構築の開始,成長因子の活性化,白血球の誘導)、傷害細胞がサイトカイン/生長因子に反応しうる量を制御するという2重の役割を演じるものと考えられる。RHAMMはこのように傷害応答の厳格なコントロールに寄与している。活性型RHAMMフォームが消失するにつれて,細胞は効率的な修復を行うためのより高度な反応状態に移行することが可能になる。一度この状態が確立されると,最高の活性化状態は抑制される。結果的に,活性RHAMMフォームの高レベルの維持は腫瘍のような疾病過程に寄与していると提案される。