氏名:遠藤玉夫
(財)東京都老人総合研究所・糖鎖生物学
慢性関節リウマチ患者は世界人口の約1%を占めるといわれている。この疾患は多発性関節炎を主症状とし、そのほか全身の臓器組織に広範な炎症を呈することを特徴としている。明確な原因はいまだに不明であるが、一種の免疫異常疾患、つまり自分の免疫グロブリンG(IgG)を抗原とする自己抗体であるリウマチ因子が出現し、形成された免疫複合体が関節、血管などに沈着して病変を起こす機序が一般に考えられている。リウマチ患者の血清IgGに糖鎖異常が起こる、という発見に端を発し多くの研究がなされた結果、慢性関節リウマチは糖鎖異常疾患の一種ではないかという段階まで達した。これは糖鎖と疾病に関連する、いわゆる糖鎖病理学と呼ばれる研究領域における大きな話題であり、慢性関節リウマチの病理においても新しい局面を拓くものとして期待されている。本稿ではIgG糖鎖の構造異常と慢性関節リウマチとの関連性について特に糖鎖生合成の面から解説してみたい。
ヒト血清IgGは、CH2領域の297番目のアスパラギンに糖鎖を持つ。この糖鎖構造は図1に示すように基本的には複合型2本鎖である。しかしながら、図1からも分かるように、ガラクトースを欠く、フコースを欠く、あるいはバイセクティングNーアセチルグルコサミンを欠くというように著しい多様性が見られる。
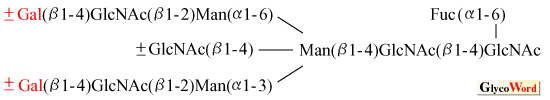
図 1 ヒト血清IgGの糖鎖構造
1985年に慢性関節リウマチ患者のIgG糖鎖は、ガラクトースを欠きNアセチルグルコサミンを末端に持つ糖鎖の割合が著しく増加するという発見がなされた1。これをきっかけとし多くの類似の研究がなされ、一冊の単行本が発刊されるに至った2。また、IgGのガラクトシル化の程度と病態との高い相関性などから同疾患における良い生化学的な疾患マーカー3のみならず疾患の本質に係わると考えられている4。一方、ガラクトース欠損は、IgGの重要な生理機能である補体の活性化やFc受容体への結合能を著しく損なうことも分っている5。
慢性関節リウマチ患者における血清IgGのガラクトース欠損という構造異常は、IgGを産生するB細胞のβ1,4ガラクトース転移酵素の異常に起因すると考えられている。実際、健常人とリウマチ患者のB細胞でβ1,4ガラクトース転移酵素活性を測定してみると、30-70%減少していることが分った。最近、β1,4ガラクトース転移酵素は、遺伝子ファミリーを形成していることが判明した(詳細については、本シリーズGlycoWord/Glycoprotein-B03および文献6を参照のこと)。一体どのβ1,4ガラクトース転移酵素が、B細胞においてIgG糖鎖のガラクトシル化に係わるのか興味が持たれる。さらに、このような研究を進めることは、複雑な疾患である慢性関節リウマチの病理において新しい局面を拓く糸口になることが期待される。