氏名:中田 博
京都産業大・工学部
ムチンは、気管、胃腸などの消化管、生殖腺などの内腔を覆う粘液の主要な糖タンパク質である。ムチンは、O-グリコシド結合を介してポリペプチド(コアタンパク質、アポムチン)に結合した無数の糖鎖を持つ。ムチンのコアタンパク質は様々なムチン遺伝子(MUC遺伝子)によりコードされている。ムチンを含む細胞表層の糖質の変化が、細胞の癌化の一般的な特徴として認められている。これらの変化が、細胞の接着性の変化、あるいは転移のような癌細胞の異常な挙動、免疫による防御からの回避に関与していると考えられている。
コアタンパク質
近年、多くのムチンのコアタンパク質をコードする遺伝子がクローニングされ、全配列、あるいは部分配列が明らかにされている。ほとんどのムチンが多くの反復配列ドメインを持っている。これらの反復配列ドメインはセリン、スレオニンに富み、完成されたムチンでは、ほとんどがO-グリコシル化されている。MUC1タンパク質は、上皮細胞の膜結合糖タンパク質(エピシアリン)であり、詳細に検討された最初のムチンである。正常細胞では、この糖タンパク質は乳腺細胞の先端面や乳脂肪滴に存在する。あるいは、膵臓、腎臓やいくつかの腺上皮細胞にも存在する。その局在性と細胞骨格との相互作用は、MUC1タンパク質が上皮細胞の極性を規定していることを示唆している。また、この分子は細胞表面から突出しているので、接着分子を覆うことにより細胞間の接着を妨げる可能性がある。MUC1タンパク質は300KDa以上の分子サイズがあり、その50%をO-グリカンが占める。このタンパク質は、短いN末端領域、水酸基を持つアミノ酸が25%を占める20アミノ酸の反復配列からなる中央領域、膜貫通領域、細胞質側の短いC末端領域からなる。その多形性は反復配列の数の違いに起因する。MUC1遺伝子は、クロモゾーム1のq21-q24に存在する。反復配列に対する抗体の反応性は癌において著しく上がるが、それはMUC1タンパク質のグリコシレーションの違いに起因する。正常ではグリコシル化されているペプチドで、グリコシル化されずに露出した部分がエピトープとなる。乳癌の患者から単離された細胞傷害性Tリンパ球はMUC1タンパク質のグリコシル化を受けていないペプチドを認識する。
幾つかの分泌性ムチンのコアタンパク質もクローニングされている。その内の一つ、小腸に発現されているMUC2タンパク質は詳細に研究されてきた。MUC2タンパク質をコードする遺伝子はクロモゾーム11のp15バンドにマップされている。完全長のMUC2 cDNAは5000以上のアミノ酸を含むアポムチンに相当する。そのタンパク質は、O-グリコシル化される可能性のあるセリン、スレオニンに富む2つの領域を持つ。すなわち、セリン、スレオニン、プロリンに富む不規則な反復配列からなる領域と、23アミノ酸の反復配列を含む領域である。
ヒトでは、少なくとも9つの異なるムチン遺伝子が上皮細胞のムチンをコードしている。ほとんどのムチンは反復配列を持ち、その反復配列の数により多形性を示し、その転写物はしばしば不均一である。癌化に伴うムチン遺伝子の発現に関して、最近のデータでは、一般化することは難しい。ムチン遺伝子の発現の亢進と抑制が癌細胞で報告されている。
糖鎖
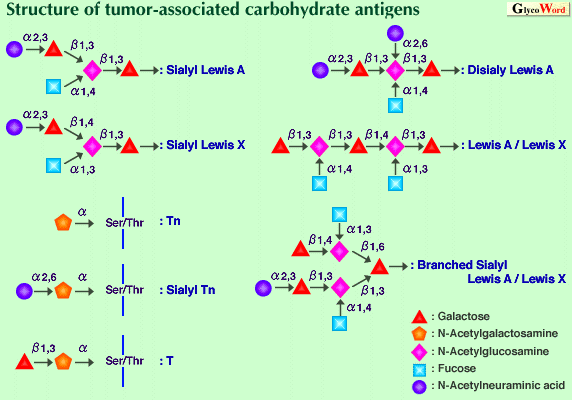
ムチンの糖鎖のほとんどがα-O-グリコシド結合により、N-アセチルガラクトサミンとセリン、スレオニンの水酸基との結合でコアタンパク質に結合している。一般的に、N-アセチルガラクトサミンの他に、フコース、ガラクトース、N-アセチルグルコサミン、シアル酸がムチンに見いだされる。母核領域はN-アセチルガラクトサミンと直接それに結合している糖からなる。N-アセチルガラクトサミンのC3の水酸基にβ1-3結合でガラクトースあるいはN-アセチルグルコサミンが結合するとそれぞれコア1とコア3構造となる。コア1と3構造にN-アセチルグルコサミンがβ1-6で結合すると、それぞれコア2と4になる。また、N-アセチルガラクトサミンにα1-3結合でN-アセチルガラクトサミンが結合するとコア5に、β1-6結合でN-アセチルグルコサミンが結合すると、コア6となる。これらの組み合わせで様々な母核構造をつくる。基幹領域は二糖:Gal (β1-3) GlcNAc(タイプ1)とGal (β1-4) GlcNAc(タイプ2)からなる。タイプ1と2の糖鎖は、さらにガラクトースにβ1-6とβ1-3結合でN-アセチルグルコサミンが結合することにより枝分かれする。基幹領域の糖鎖は、末梢の糖すなわち通常α結合したガラクトース、N-アセチルガラクトサミン、フコース、あるいはシアル酸で終結する。
糖鎖抗原に対し、多くの単クローン抗体が調製されてきた。これらの単クローン抗体は癌関連糖鎖抗原の研究に繁用されてきた。図に示すように、血液型抗原に代表されるような末梢の糖鎖に抗原性を有するものや、Tn、Tのような母核構造及びそれらにシアル酸が結合したシアリルTn、シアリルTのような抗原がある。構造的にも機能的にも詳細に検討されている癌関連糖鎖抗原は、シアリルルイスA抗原とその異性体であるシアリルルイスX抗原である。これらの抗原は癌細胞膜の糖脂質やムチン、それに癌患者血清中のムチンに見いだされる。これらの抗原が癌細胞の転移に関与しているとされているセレクチンファミリーのリガンドであることはよく知られている。多くの関連する抗原、またはジシアリルルイスA、ルイスAとルイスX、あるいはシアリルルイスAとルイスXなどのハイブリッドタイプのようなより複雑な抗原が報告されている。これらの抗原は、セレクチンに対し異なる親和性を持つ。
これらのタイプ1やタイプ2あるいはそのいずれかを持つような抗原に対し、糖鎖が短くなることでも抗原性が生ずる。これらの露出したエピトープが、肺癌、乳癌、結腸癌、膵癌由来の上皮細胞株の細胞膜に見いだされている。TnやシアリルTn抗原のクラスター構造が強い抗原性に必須である。シアリルルイスA、Xや関連抗原がセレクチンのリガンドであることは認められているが、不完全に合成された糖鎖とそのシアリル化された糖鎖の機能は未解明である。多くの臨床的研究が、これらの抗原の存在と長期間の生存率の間に明確な相関関係があることを示している。
ムチン様膜タンパク質
最近、ムチンという用語は拡大され、ロイコシアリンやGlyCAM-1の様な多くのO-グリコシル化された領域を持つ膜結合性ムチン様分子も含まれるようになってきた。白血球に発現されているPSGL-1はセレクチンに対するリガンド活性を持っている。P-セレクチンに対する高親和性結合には、硫酸化チロシンと糖鎖が必要である。GlyCAM-1、CD34やMAdCAM-1もムチン様分子でL-セレクチンに対する糖鎖リガンドを持つ。