
氏名:Vincent C. Hascall
(所属)オハイオ州44195、クリーブランド市、クリーブランド診療財団、ラーナー研究所、生体医学エンジニアリング部門(Wb3)
Dr. HascallのプロフィールはHA Today編集者のバイオスケッチ参照

氏名:Torvard C. Laurent
Torvard Laurent博士は、1958年にストックホルムのKarolinska Instituteから医学博士号を授与された。ボストンのRetina Foundationから3年間のフェローシップを受けた後、Uppsala大学に研究講座を開設し、1966年に教授に就任した。現在はこの大学の名誉教授であり、またストックホルムのWenner-Gren財団の科学部門委員長である。博士は結合組織化学の分野において、先駆的で国際的にも認められた研究業績をあげてきたが、中でもヒアルロン酸の物性、生理学及び医学応用に関する研究は特筆される。彼の輝かしい経歴の主なものは、1973-77;スウェーデン医学研究評議会の副議長、1973-76;スウェーデン生化学会会長、1991-94;スウェーデン王立科学アカデミー総裁、1994-;ノーベル財団評議会議長が挙げられる。Wenner-Gren財団の国際シンポジウムをオーガナイズする責務もある多忙な中で、最近「ヒアルロン酸の構造、生物学及び医学応用」に関するシンポジウムの開催とその報告集の編集をおこなった。
1934年、Karl Meyerとその助手のJohn Palmerはウシの眼の硝子体から新しいグリコサミノグリカン(ムコ多糖)を単離する方法を報告した1。彼らはこの物質がウロン酸とアミノ糖を含むが、硫酸エステルは含まないことを示し、「hyaloid(硝子体)+uronic acid(ウロン酸)から“hyaluronic acid(ヒアルロン酸)”」と命名するよう提案した。
これが、自然界において最も変化に富む、魅力的な高分子であるヒアルロン酸”Hyaluronic acid”の誕生であった。今日ではこの高分子物質は、in vivo(生体内)で水素イオン化した酸の形ではなく、ポリアニオンとして存在することから、多くの場合“ヒアルロナン(Hyaluronan)”と呼ばれている。(訳注:日本では一般に“ヒアルロン酸”という従来の呼び方が広く用いられているので、このシリーズもヒアルロン酸と呼ぶことにする)4。
Meyerの研究室が、ヒアルロン酸(以下HAと略す)を構成する基本的2糖の詳しい化学構造を決定するまでに、さらに20年を要した2。この間に彼らは、2糖中のウロン酸とアミノ糖がD-グルクロン酸とD-N-アセチルグルコサミンであり、それらはβ-1, 4とβ-1,3のグリコシド結合により交互に連結していることを明らかにした(Fig. 1)。
どちらの糖も、立体構造上グルコースと関連していて、グルコースはβ構造において、かさ高い置換基(ヒドロキシル基、カルボキシル基、隣接する糖と結合するアノメリック炭素)すべてが立体的に有利なエカトリアル位になる一方で、すべての小さい水素原子が立体的により不利なアキシアル位を占める。したがってFig. 1に示された2糖の構造はエネルギー的にたいへん安定している。
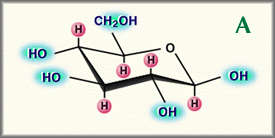

Fig. 1
β-D-グルコース(A)とヒアルロン酸の繰り返し2糖であるD-グルクロン酸-β-1, 3-D-N-アセチルグルコサミン-β-1, 4(B)の関係
H ; 疎水性の面に寄与するaxialの水素原子を示す。
ヒアルロン酸合成酵素(Hyaluronan synthase enzymes)は、活性化された糖ヌクレオチドのUDP-グルクロン酸とUDP-N-アセチルグルコサミンを基質として、成長する鎖にグルクロン酸とN-アセチルグルコサミンを交互に添加することで、2糖の繰り返しからなる線状高分子構造のヒアルロン酸を合成する1。
完成したHA分子における2糖の繰り返し数nは10,000またはそれ以上に達し、分子量は約400万Daとなる(各2糖の分子量は約400Da)。2糖の平均的長さは約1nmである。したがって10,000個の繰り返しからなるHA分子を端から端まで引き伸ばしたとすると10µmになるはずで、これはヒトの赤血球の直径にほぼ等しい。Fig. 2は2〜3本のからみ合ったHA分子を平らな表面に置き、コントラストをつけるために重金属によるロータリーシャドウ処理をして撮影した電子顕微鏡写真である。
1 これらの酵素とヒアルロン酸生合成のメカニズムは、このシリーズの後で登場する予定である
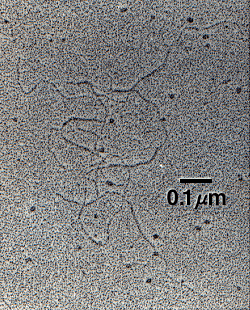
Fig. 2
電子顕微鏡写真はアラバマ大学のDr. Richard MayneとDr. Randolph Brewtonからの提供
生理的溶液中のHA分子の骨格は、2糖の化学構造、分子内水素結合そして溶媒との相互作用が組み合わさることで、堅いものとなっている。Fig. 1Bで示したアキシアル位の水素原子は非極性で、比較的疎水性の面を形成し、エカトリアル位の置換基は、より極性の強い親水性の面を形成する。その結果、全体としてねじれたリボン状構造となっている2。
すなわち、生理的溶液中のHA分子は、広がったランダムコイル構造をとり、Fig.3で示すように非常に大きな容積を占めることになる。生理的食塩水中に希薄濃度で溶けている場合、この容積中に含まれるHAの質量は非常に低く約0.1%(wt/vol)か、それ以下である。これは、HA濃度が1mg/ml以上になると各分子の占める容積がオーバーラップするであろうことを意味する。
2 HAのリボン構造とその結果としての溶液中の性質については、本シリーズの John Scottの総説を参照
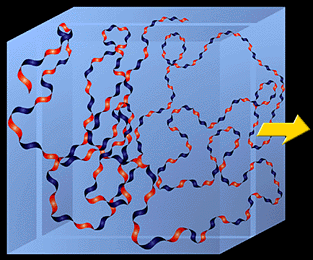
Fig. 3 3次元の空間におけるHAリボン構造のモデル
水色のボックスは溶液中におけるHA分子の広がりを示している。青と赤のねじれたひもは疎水性(青)と親水(赤)のリボン構造を表す。
矢印方向に引き出した薄い切片をFig. 4に示す。
HAのドメイン(空間)構造は、興味深い重要な影響をもたらす。水や電解質、栄養素のような小さな分子は、溶媒を通してドメイン内を自由に拡散できる。しかしタンパク質のような大きな分子になると、溶液中における流体力学的大きさのため、HAの空間から部分的に排除される。Fig. 4に示すように、ドメイン内におけるHAの網状構造によって、他の分子は大きければ大きいほど、限られた空間しか与えられない。このことにより、他の高分子物質はHAの網状構造によって拡散速度が遅くなると同時に、周りのHAを含まない部分に比べてその分子の濃度は低くなる。
ここで注目したいのは、HA鎖は溶液中で常に動いているため、拡散可能な網目(穴)の大きさが絶え間なく変化していることである。理論的には、あらゆる大きさの網目が可能だが、それが生じる確率は異なっている。つまり原則として、すべての分子はHAの網目の中を通過可能であるが、通過時の減速の度合は、その分子の流体容積に依存する。
グルクロン酸残基のカルボキシル基のpKは3〜4でそれはイオンの条件に依存する。したがって、pH7ではカルボキシル基はほとんどイオン化しており、HA分子は電荷の中性を維持するため、交換し得る陽性荷電のカウンターイオンを伴ったポリアニオンとして存在する。そのようなポリアニオンの空間を通して電解質が一方向に流れると、流動電位を生じるのに充分な電荷の分離がおこることになる。

Fig. 4
Fig. 3の垂直断面図。平均的な網目のサイズと大分子の部分排除を示したもの。
赤と青の部分はFig. 3の薄切片上のHA骨格を表わしている。
このHA切断面を取り囲むぼやけた灰色の部分は、拡散分子が接近できない領域を表わす。3つのサイズの異なる(黄色い)円は、拡散分子が利用できる空間を表わす。一番小さい空間(円)は、HA分子のいない部分、ほとんどの空間で生じることが可能で、かつ移動もできるが、一番大きい空間は、生じたとしてもHAの網目の中(Fig. 3)を移動することは、小さな空間よりも難しい。
HAは全ての脊椎動物に存在し、その起源は脊索を持った動物からと推測される。ある種の連鎖球菌の莢膜にも存在するが、これはおそらくHAの酵素的合成機構を脊椎動物の宿主から奪い取ったためと考えられる。
HAはほとんどの組織が分化する細胞外マトリックスの主成分である3。同時に、成熟した組織の多くの細胞外マトリックスの必須成分の一つでもある。HAは次の組織にも多く含まれている;ヒト硝子体(0.1-0.4 mg/g湿重量)、関節滑液(3-4 mg/ml)、排卵前の卵母細胞を囲む丘細胞が産生するマトリックス(~0.5 mg/ml)4、そして冠動脈再挟窄で動脈をふさぐ病的なマトリックスなどである5。
他方、組織の全体量からすれば少量ではあるが、HAがマトリックスに不可欠な構造要素として機能している場合もある。例えば、硝子軟骨中にHAは約1mg/g湿重量存在するが、これは他の成分がなくてもこの組織容積の全体を占めるのに十分な濃度である。しかし、同じ硝子軟骨中には巨大なコンドロイチン硫酸プロテオグリカンであるアグリカンが、より高い濃度(25-50 mg/g湿重量)で存在しており、HAは、タンパク質との特異的相互作用によってマトリックス中のアグリカン分子を保持しているため、その骨格は覆い隠されている6。他の結合組織、例えば大動脈の平滑筋細胞や、皮膚真皮の繊維芽細胞をとりまくマトリックスでは、HAはもっと濃度が低い。しかしながらこれらのマトリックスにおいても、軟骨と同じようにHAは大きなコンドロイチン硫酸プロラオグリカンを結合する足場を形成している。
体内で最も多くHAが含まれているのは皮膚であり(ヒト成人で平均7-8g、体全体の約50%を占める)、真皮(約0.5 mg/g湿重量)と表皮(約0.1 mg/g)の両方に存在する。面白いことに、真皮はほとんどが細胞外マトリックスから成り、細胞がまばらであるのに対し、表皮は逆に角質細胞から成り、細胞外マトリックスは2-3%である。こうして表皮の細胞の周りのマトリックス中の実際のHA濃度(推定2-4 mg/ml)は、真皮におけるそれ(推定-0.5mg/ml)より1桁高いものとなっている7。したがって角質細胞の周りのマトリックス中には、哺乳類組織中で、最高濃度の組織であるさい帯(約4 mg/ml)と同程度のHAが含まれることになる。興味深いのは、皮膚が発達したものである雄鶏のトサカは更に高いHAを含有する(最高7.5 mg/ml)。
3 組織の形態発生におけるHAの役割は、このシリーズの後で登場する解説で述べられる
4 本シリーズのAntonietta SalustriとCsaba Fulopの総説を参照
5 再挟窄での動脈マトリックスの形成におけるHAの役割も、このシリーズの後で登場する
6 軟骨の構造と機能に対するHAの役割については、このシリーズの後で登場する
7 表皮のHAの役割はシリーズの後で登場予定
HAの代謝は非常にダイナミックである。例えば、軟骨中の軟骨細胞は、組織の生涯を通じてHAを活発に合成し分解する。通常、合成は分解によってバランスが取れているので、組織中の濃度は一定に保たれる。代謝実験の結果、軟骨中でのHA分子の半減期は正常で2〜3週間であることが示された。表皮の角質細胞はHAを活発に合成・分解するもう1つの例である。この場合のHAの半減期は驚くほど短く、1日以下である。
また、時として細胞はHAを合成もしくは分解の一方しか行わないことがある。例えば真皮細胞は、HAを活発に合成するが分解はほとんどしない。真皮中のHA分子の大部分は、循環中に流れ出し、短時間の内にリンパ腺と肝臓の網内系細胞のレセプターにとらえられ、引き続きライソゾームで分解される。HA分子の血中における半減期は大変短く、わずか2〜3分である。関節組織、ひざ関節嚢中の内膜細胞はHAを合成し、滑液中に遊離している。その結果、HAは滑液の主成分となり、液の粘弾性に寄与している。また、関節液は血流に入る前にリンパ管へ流れ出る。リンパ系に張り巡らされている網内系細胞は、HAが血管系へ到達する前にほとんど90%のHAを除去する。ヒトの体の1/3のHAが、平均1日の間に代謝され置き換えられる。
HA個々の分子がそれぞれの広範なドメイン構造を維持できる濃度より実際は、組織中のHA濃度は高くなっていることが多い。多くの場合、HAは細胞外マトリックス中で他のマトリックス高分子との特異的相互作用により組織化されている。しかしながら、高濃度の溶液中で、高分子量のHA(例えば分子量500万で0.1mg/ml以上)は、立体的相互作用と、各分子間および分子内の自己会合を通して、分子の絡まった網目構造を形成することができる。
後者については、リボン構造の疎水性面が、他のHA分子または同一分子内の別領域にある疎水性面と可逆的に相互作用した結果生じる。このような網目構造は、単独のHA分子で予測されるものとは異なった性質を示す。それは、急激で持続時間の短い流れに抵抗できるという弾性的な性質で、その網目構造で外力や摩擦を分散することが可能となる(Fig. 5)。その一方で、持続時間の長い流れに対しては、網目構造の一部は乖離し、分子が整列することにより、HAも溶媒分子とともに移動し粘性を示す。顕著な粘弾性を持ち、安定した網目構造と半固体状の物質の生成を目的に、HAマトリックスに共有架橋結合を導入する方法が開発されている8。
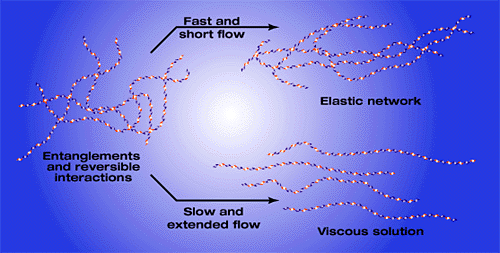
Fig. 5 粘性および弾性を示すHA溶液のモデル
8 架橋構造を持つHAとその応用はこのシリーズの今後の解説テーマの一つである。
ウシの眼の硝子体から抽出されたというその発見にふさわしく、ヒトに対するHAの最初の医学応用は、1950年代後半の、眼科手術時における硝子体の補充及び置換療法であった。ここで使用されたHAは当初はヒトさい帯から、その後まもなく雄鶏トサカから単離されたもので、高度に精製された高分子であった。後者の標品は、現在Healon(Pharmacia社)という製品名で、やはりトサカから精製したOpegan(生化学工業)と同様に眼科及びその他の手術に広く使われている。またArtz(生化学工業)は、変形性関節症の関節腔内注入に使用する補充物として開発されたものである。Synvisc(Biomatrix社)も同じ目的で使われているが、こちらはより強い粘弾性をもった共有架橋結合型のHAを使っている。
「今日のヒアルロン酸科学」シリーズの第一回を飾るこの解説が、この後に紹介される多方面にわたるHA研究を理解する上での参考書となることを期待する。