 |
グリコサミノグリカンの一種であるケラタン硫酸(KS)は、ガラクトース(Gal)とN-アセチルグルコサミン(GlcNAc)の繰り返しによる直鎖状糖鎖であるポリN-アセチルラクトサミン(polyLacNAc)に硫酸修飾を受けた酸性高分子多糖である(構造については本シリーズの「ケラタン硫酸生合成およびその硫酸化制御」の項目を参照のこと)。ヒトにおいてKSの生合成には主にβ1,3-N-アセチルグルコサミン転移酵素7(β3GnT7)、β1,4-ガラクトース転移酵素4(β4GalT4)、糖質硫酸転移酵素6(CHST6)(別名N-アセチルグルコサミン6-O-硫酸転移酵素5:GlcNAc6ST5)および糖質硫酸転移酵素1(CHST1)(別名KSガラクトース6-O-硫酸転移酵素:KSGal6ST)の4種類の酵素により合成される(「ケラタン硫酸生合成およびその硫酸化制御」の項目を参照)。これらのKS合成酵素について、β4GalT4以外の酵素の遺伝子欠損マウスは作製され、その表現型について報告されている。これらの酵素遺伝子の欠損は長鎖状のKSのみならず短い硫酸化糖鎖の合成にも影響を与えるため、表現型は必ずしもKSの消失に起因しない場合があることに留意しておきたい。
マウスのCHST5はヒトのCHST6に相当する硫酸転移酵素であり、KSのGlcNAcの硫酸化を担う酵素である(本シリーズの「ケラタン硫酸生合成およびその硫酸化制御」の項目を参照のこと)。ヒトではCHST6の不活性型変異は斑状角膜ジストロフィーを引き起こすため(本シリーズの「ケラタン硫酸生合成酵素の欠損による遺伝病」の項目を参照のこと)、この酵素の遺伝子欠損マウスが作製され、その表現型が比較された。CHST5の遺伝子欠損ホモ接合体マウスは発生や生育、交配は野生型マウスと違いが見られなかった(1)。またマウス角膜の観察では顕微鏡下においても角膜の混濁は見られなかった。一方で角膜実質の厚さがホモ接合体マウスでは野生型やヘテロ接合体マウスよりも薄くなっていた。さらに電子顕微鏡やX線散乱による詳細な解析でCHST5の遺伝子欠損ホモ接合体マウスの角膜実質中のコラーゲン線維束は野生型やヘテロ接合体マウスよりも細く線維間距離が短く密集しており、また線維束の並びがより乱雑になっていることが明らかとなった(1)。ヒトの斑状角膜ジストロフィーでも角膜の混濁以外に角膜実質厚が減少およびコラーゲン線維束の乱雑化が報告されており(2)、この点においてCHST5遺伝子欠損マウスはヒトの斑状角膜ジストロフィーを再現していると考えられる。生化学的な解析では、CHST5遺伝子欠損のホモ接合体マウスの角膜にはKSに反応するモノクローナル抗体である5D4が反応せず、KSが合成されていないことが報告されている(1)。
KSのGalの硫酸化はCHST1により触媒される(3)。この酵素の遺伝子欠損マウスも作製されており、CHST5遺伝子欠損マウス同様、CHST1遺伝子ホモ接合体マウスでの発生や生育、交配異常は確認されなかった(4)。一方でマウス組織における高硫酸化KSの合成を確認したところ、CHST1遺伝子ホモ欠損マウスでは完全に消失していたことから、CHST1はKSのGalの硫酸化に必須の酵素であることが示された(4,5)。CHST1はリンパ節や肺で発現しており、KS以外にもシアリル6'-硫酸化ルイスX構造やシアリル6,6'-二硫酸化N-アセチルラクトサミン構造などの短い硫酸化糖鎖の合成にも関与すると考えられるため、これらの糖鎖構造のレセプターの可能性があるSiglec-FやL-selectinの組織への結合を確認したところ阻害されなかった(4,6)。したがって、マウス生体においてSiglec-FやL-selectinはGalの硫酸化の有無を認識しないと考えられた(4,6)。しかしながら抗原刺激による気道へのマクロファージやリンパ球の集積がCHST1遺伝子ホモ欠損マウスで増加していたことから、Galの硫酸化が免疫反応において何らかの関与があることを示唆している(7)。
β3GnT7はKSの糖鎖伸長に深く関わる糖転移酵素である。この酵素をコードする遺伝子の遺伝子欠損ホモ接合体マウスもCHST1やCHST5の遺伝子ホモ変異マウスと同様に発生や生育、交配は野生型マウスと違いが見られなかった(8)。角膜における表現型を調べたところ、CHST5遺伝子欠損マウスと同様にβ3GnT7遺伝子欠損ホモ接合体マウスでは角膜実質厚が有意に減少していた。また角膜KSプロテオグリカンのコアタンパク質の一つであるlumicanの抗体を用いてウエスタンブロット解析により糖鎖構造を調べたところ、KSの長さが著しく短くなっていたことから、β3GnT7が生体においてもKS伸長の主要な酵素であることが明らかとなった(8)。
KSは角膜や軟骨以外にも脳での存在が確認されているが、その合成機構は発生段階によって異なる。マウスの胎仔や新生仔の脳には角膜同様の高硫酸化KSの合成が見られるが、成体マウスではGlcNAcが硫酸化されている低硫酸化KSのみが合成されている。一方、成体マウスにおいても脊髄損傷など傷害を受けた際には損傷部位において高硫酸化KSが合成されることが報告されている(5,9)。正常の成体マウス脳では角膜と同様にβ3GnT7による糖鎖伸長とCHST5による硫酸化が進行していることが遺伝子欠損マウスの解析により明らかとなっている(10,11)。これとは別に正常の新生仔脳や傷害を受けた成体マウスの中枢神経ではCHST5に類縁の硫酸転移酵素であるCHST2(本シリーズの「ケラタン硫酸生合成およびその硫酸化制御」の項目を参照)がCHST5に代わってGlcNAcの硫酸化を担っていることがCHST2遺伝子欠損ホモ接合体マウスの解析にて示された(9)(図 1)。これらの遺伝子変異マウスでは脳におけるKSの消失が確認されているものの、明らかな発生異常や行動異常は認められていない。
成体マウスの損傷神経におけるKSの役割が遺伝子改変マウスを用いて調べられている。CHST2の遺伝子欠損ホモ接合体マウスにて脊髄損傷後の回復を調べたところ野生型に比べて回復が早かったことから、傷害部位でのKSの産生が神経再生に対して阻害的にはたらいている可能性が示唆された(9)。一方で 筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)モデルマウスとなるSOD1G93Aトランスジーンを有するCHST2遺伝子欠損ホモ接合体ではCHST2が正常であるマウスに比べ生存率が低下していることから、ALSによる神経障害に対してKSは保護的にはたらいていることが示唆されている(12)。その際、Galの硫酸化を行うCHST1遺伝子欠損ホモ接合体では生存率の低下は有意ではなかったので、KSの硫酸化はGlcNAcのみの低硫酸化KSであっても保護作用が見込まれるものと考えられる(13)。これとは逆にアルツハイマー病モデルであるJ20マウスと掛け合わせして生まれたCHST2遺伝子欠損ホモ接合体マウスはアミロイド-βの沈着が減少し、アルツハイマー病の病態を改善する傾向が見られていることから、KSの存在はアルツハイマー病においては増悪方向にはたらいている可能性がある(14)。神経免疫反応性が異なる神経変性疾患において、KSの病態進行への関与が異なることが報告されており、脳におけるKSの機能解明にはさらなる研究が必要と考えられる。
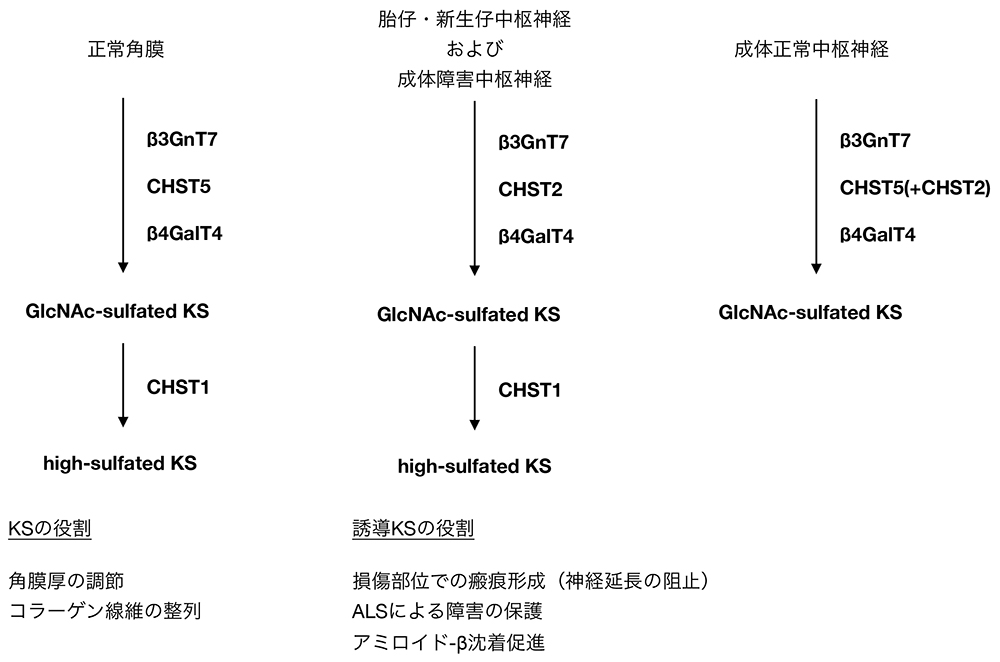
図 1. マウスにおけるKS生合成経路
マウス脳においてはKS合成は胎仔期や新生仔期では角膜と同様に高硫酸化KSが合成されているが、GlcNAcの硫酸化はCHST5ではなくCHST2により修飾されている。成体マウスの脳では角膜同様CHST5に触媒される硫酸化によって低硫酸化KSが合成されるが、CHST1による高硫酸化KS合成は見られない。しかし成体マウスにおいても損傷部位や傷害を受けた中枢神経組織では胎仔期と同様にCHST2とCHST1による高硫酸化KS合成が進行する。
|
赤間 智也(関西医科大学医学部薬理学講座)
| References |
| (1) |
Hayashida Y, Akama TO, Beecher N, Lewis P, Young RD, Meek KM, Kerr B, Hughes CE, Caterson B, Tanigami A, Nakayama J, Fukada MN, Tano Y, Nishida K, Quantock AJ: Matrix morphogenesis in cornea is mediated by the modification of keratan sulfate by GlcNAc 6-O-sulfotransferase. Proc. Natl. Acad. Sci. U. S. A. 103, 13333-13338, 2006 |
| (2) |
Quantock AJ, Meek KM, Ridgway AE, Bron AJ, Thonar EJ: Macular corneal dystrophy: reduction in both corneal thickness and collagen interfibrillar spacing. Curr. Eye Res. 9, 393-398, 1990 |
| (3) |
Fukuta M, Inazawa J, Torii T, Tsuzuki K, Shimada E, Habuchi O: Molecular cloning and characterization of human keratan sulfate Gal-6-sulfotransferase. J. Biol. Chem. 272, 32321-32328, 1997 |
| (4) |
Patnode ML, Yu SY, Cheng CW, Ho MY, Tegesjö L, Sakuma K, Uchimura K, Khoo KH, Kannagi R, Rosen SD: KSGal6ST generates galactose-6-O-sulfate in high endothelial venules but does not contribute to L-selectin-dependent lymphocyte homing. Glycobiology 23, 381-394, 2013 |
| (5) |
Hoshino H, Foyez T, Ohtake-Niimi S, Takeda-Uchimura Y, Michikawa M, Kadomatsu K, Uchimura K: KSGal6ST is essential for the 6-sulfation of galactose within keratan sulfate in early postnatal brain. J. Histochem. Cytochem. 62, 145-156, 2014 |
| (6) |
Patnode ML, Cheng CW, Chou CC, Singer MS, Elin MS, Uchimura K, Crocker PR, Khoo KH, Rosen SD: Galactose 6-O-sulfotransferases are not required for the generation of Siglec-F ligands in leukocytes or lung tissue. J. Biol. Chem. 288, 26533-26545, 2013 |
| (7) |
Kumagai T, Kiwamoto T, Brummet ME, Wu F, Aoki K, Zhu Z, Bochner BS, Tiemeyer M: Airway glycomic and allergic inflammatory consequences resulting from keratan sulfate galactose 6-O-sulfotransferase (CHST1) deficiency. Glycobiology 28, 406-417, 2018 |
| (8) |
Littlechild SL, Young RD, Caterson B, Yoshida H, Yamazaki M, Sakimura K, Quantock AJ, Akama TO: Keratan sulfate phenotype in the β-1,3-N-acetylglucosaminyltransferase-7-null mouse cornea. Invest. Ophthalmol. Vis. Sci. 59, 1641-1651, 2018 |
| (9) |
Zhang H, Muramatsu T, Murase A, Yuasa S, Uchimura K, Kadomatsu K: N-Acetylglucosamine 6-O-sulfotransferase-1 is required for brain keratan sulfate biosynthesis and glial scar formation after brain injury. Glycobiology 16, 702-710, 2006 |
| (10) |
Narentuya, Takeda-Uchimura Y, Foyez T, Zhang Z, Akama TO, Yagi H, Kato K, Komatsu Y, Kadomatsu K, Uchimura K: GlcNAc6ST3 is a keratan sulfate sulfotransferase for the protein-tyrosine phosphatase PTPRZ in the adult brain. Sci. Rep. 9, 4387, 2019 |
| (11) |
Takeda-Uchimura Y, Nishitsuji K, Ikezaki M, Akama TO, Ihara Y, Allain F, Uchimura K: Beta3Gn-T7 is a keratan sulfate β1,3 N-acetylglucosaminyltransferase in the adult brain. Front. Neuroanat. 16, 813841, 2022 |
| (12) |
Hirano K, Ohgomori T, Kobayashi K, Tanaka F, Matsumoto T, Natori T, Matsuyama Y, Uchimura K, Sakamoto K, Takeuchi H, Hirakawa A, Suzumura A, Sobue G, Ishiguro N, Imagama S, Kadomatsu K: Ablation of keratan sulfate accelerates early phase pathogenesis of ALS. PLoS One. 8, e66969, 2013 |
| (13) |
Foyez T, Takeda-Uchimura Y, Ishigaki S, Narentuya, Zhang Z, Sobue G, Kadomatsu K, Uchimura K: Microglial keratan sulfate epitope elicits in central nervous tissues of transgenic model mice and patients with amyotrophic lateral sclerosis. Am. J. Pathol. 185, 3053-3065, 2015 |
| (14) |
Zhang Z, Takeda-Uchimura Y, Foyez T, Ohtake-Niimi S, Narentuya, Akatsu H, Nishitsuji K, Michikawa M, Wyss-Coray T, Kadomatsu K, Uchimura K: Deficiency of a sulfotransferase for sialic acid-modified glycans mitigates Alzheimer's pathology. Proc. Natl. Acad. Sci. U. S. A. 114, E2947-E2954, 2017 |
2024年10月24日
|
|---|







