 |
ケラタン硫酸 (KS)プロテオグリカンはガラクトース(Gal)とN-アセチルグルコサミン(GlcNAc)の繰り返しによる直鎖状糖鎖であるポリN-アセチルラクトサミン(polyLacNAc)に硫酸修飾を受けた酸性高分子多糖を有する糖タンパク質である。タンパク質への結合様式はN型、O型、O-マンノース型に分類され、それぞれ角膜、軟骨、脳に主に分布することが知られている(1)。コアタンパク質は組織によって異なっており、角膜ではsmall leucine-rich repeat proteinであるlumican, keratocan, mimecan、軟骨ではaggrecan、脳ではprotein tyrosine phosphatase receptor zeta (phosphacan)が主要なコアタンパク質として報告されている(1, 2)。糖鎖部分の構造については角膜と軟骨について詳細に調べられており、角膜KSは軟骨のものに比べ鎖長が長く、また硫酸化の割合が高い。KSの硫酸化のパターンについては角膜由来の場合は非還元末端側に高硫酸化領域があり、コアタンパク質に近い側(還元末端側)に低硫酸化領域があることが報告されている(1)。非還元末端は角膜や軟骨のKSでは、多くはシアル酸によってキャッピングされている。マウスの脳にあるKSは胎児期および新生仔では高硫酸化KSが検出されているが(3)、成体では低硫酸化KSのみ検出される (4)。しかしながら損傷を受けた部位では高硫酸化KSが検出される(5)ことから、糖鎖合成系の酵素が発生期あるいは損傷のシグナルに応じて誘導されるものと考えられる。
KSの硫酸化はGlcNAc及びGalの6位のヒドロキシ基に生じ、低硫酸化領域ではGlcNAcのみに硫酸修飾が見られ、高硫酸化領域ではGlcNAcとGalの両方に硫酸化が生じていることがわかっている(1)。Galのみが硫酸化されているKSは報告されておらず、自然界に存在するかどうかは不明である。KSの還元末端側は一般的なN結合型、あるいはO結合型の結合様式となっており、この点で特殊な4糖構造を結合様式として必要とするコンドロイチン硫酸・デルマタン硫酸やヘパラン硫酸と異なる。つまりKSは特殊なグリコサミノグリカン鎖というよりは細胞に普遍的にみられるN型・O型糖鎖に硫酸修飾の入った硫酸化糖鎖の一つとして考えることができる。
KSの基本となるpolyLacNAcはGalがβ1-4の結合様式でGlcNAcに、GlcNAcがβ1-3の結合様式でGalに連結しており、それぞれβ1,4-ガラクトース転移酵素 (β4GalT)とβ1,3-N-アセチルグルコサミン転移酵素 (β3GnT)の2種類の酵素により合成される。ヒトやマウスにおいて、β4GalTは7つの酵素が、β3GnTは8つの酵素が見つかっている (図1a, b)。この中で、β4GalT4とβ3GnT7が主にKSの伸長に関わる酵素であるとして報告されている (6,7)。一方でin vitroでの酵素的KS合成実験ではβ4GalT1とβ3GnT7にて高硫酸化KSの合成に成功しており (8)、KS合成におけるβ4GalT1の寄与も無視できない可能性がある。
KSのGalの6位への硫酸転移酵素としては糖質硫酸転移酵素1 (CHST1) (KSガラクトース 6-O-硫酸転移酵素)が報告されている (9)。培養細胞の強制発現系ではコンドロイチン硫酸のGalNAcの6位に硫酸を転移する酵素であるCHST3(コンドロイチン硫酸 6-O-硫酸転移酵素)もKSの硫酸転移活性があると報告されている(10)が、生体で同様の活性があるかどうかは不明である。一方、GlcNAcの6位に硫酸を転移する酵素としてはヒトではCHST2 (GlcNAc 6-O-硫酸転移酵素1 (GlcNAc6ST1))、CHST4 (GlcNAc6ST2)、CHST5 (GlcNAc6ST3)、CHST6 (GlcNAc6ST5)、CHST7 (GlcNAc6ST4)の5種類の酵素があるが、マウスではCHST6が存在せず4種類のGlcNAc硫酸転移酵素となっている (図1c)。実はCHST5とCHST6の遺伝子(CHST5とCHST6)は霊長類以降で遺伝子重複の結果生じたものであるため、それ以前の哺乳動物やニワトリではChst5あるいはChst6のどちらか一方の遺伝子しかもたないのである(11)。この中でKSのGlcNAcの硫酸化に大きく寄与している硫酸転移酵素はヒトではCHST6であり、マウスではCHST5であることからマウスのChst5はヒトのCHST6に相当し、ヒトのCHST5はCHST6のパラログと考えられる。前述のマウス脳にて成体の低硫酸化KSの合成にはCHST5が関わっているが、胎児や新生仔、また損傷にて誘導される高硫酸化KSの合成にはCHST2が寄与していることがわかっている(5)。
ヒトのCHST6の酵素活性解析から、この酵素はpolyLacNAcを基質とした場合、非還元末端のGlcNAcにのみ硫酸化を行い、polyLacNAcの内側にあるGlcNAcには硫酸化しないことがわかった(12)。また、β4GalT4は6位に硫酸が付加されている非還元末端のGlcNAcに対してGalの転移を行うことが可能であり(6)、さらにβ3GnT7は非還元末端にあるGalβ1-4(SO3--6O)GlcNAc-のGalにGlcNAcを転移する活性を有している(7)。一方で、CHST1はpolyLacNAcの内側のGalにも非還元末端のGalにも硫酸化を行うことが可能であり、むしろシアル酸や硫酸などの陰性電荷をもつ基質に対して硫酸転移活性が強い(13)。また、β3GnT7は非還元末端のGalの6位に硫酸が入っている基質にもGlcNAcを転移することが可能であるが、その活性は硫酸化されていない非還元末端Galよりも弱い(7)。このことを考慮すると、KSの合成はβ3GnT7、CHST6、β4GalT4の三種の酵素が共役してはたらくことにより、まずGlcNAcに硫酸が転移されたKSが合成され、この糖鎖に対してCHST1が作用してGalに硫酸が転移され高硫酸化KSが合成されるものと考えられる (図2)。
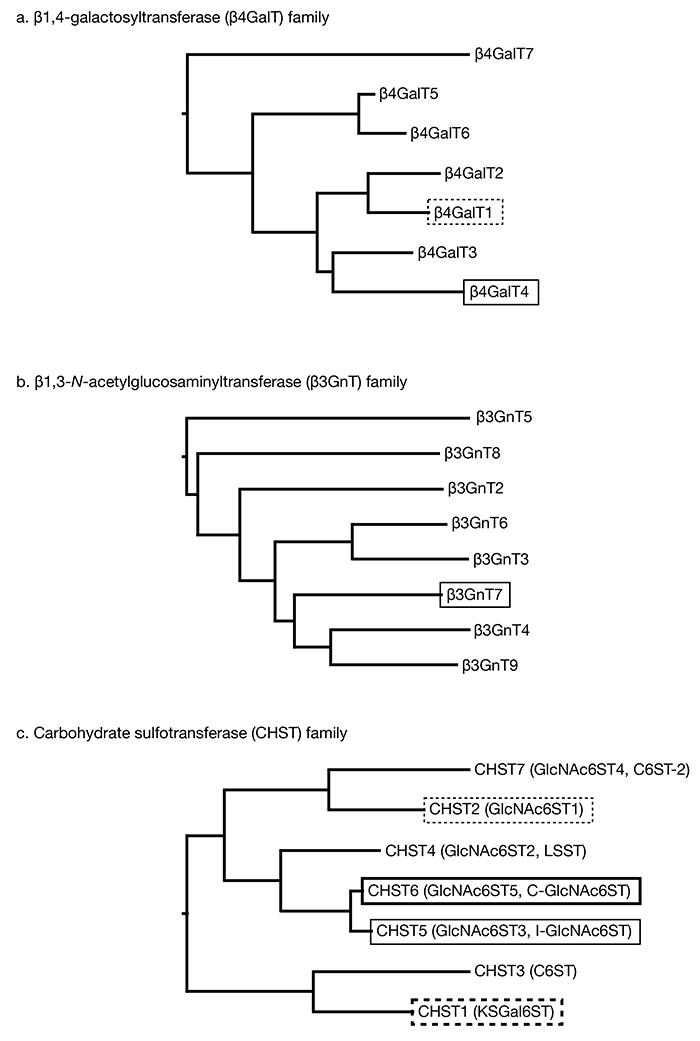
図 1. KS合成に関わる酵素の系統樹
それぞれの系統樹はヒトの酵素のアミノ酸配列を元にClustalW(京都大学バイオインフォマティックセンターGenomeNet)にて構築した。KS合成に関わる酵素を枠囲いにて示す。a. ヒトβ1,4-ガラクトース転移酵素ファミリー。KS合成には主にβ4GalT4(実線枠)が関わっていると考えられているが、in vitroでKS合成活性のあるβ4GalT1(破線枠)の関与も否定できない。b. β1,3-N-アセチルグルコサミン転移酵素ファミリー。β3GnT7(実線枠)が主なKS合成酵素であると考えられている。c. 糖質硫酸転移酵素ファミリー。糖鎖中のそれぞれの単糖の6位のヒドロキシ基に硫酸を転移する酵素のみを示す。遺伝子名をタンパク質名とし、それぞれのタンパク質の別名は括弧内に記した)。β3GnT1(iGnT)は現在ではα-ジストログリカンの糖鎖修飾に関わるβ1,4-グルクロン酸転移酵素1として分類されており、β3GnTL1はβ3GnT1に相同性があると報告されていることから、共にβ3GnTから除外した。CHST5(実線枠)とCHST6(太線枠)の二つの酵素は霊長類にのみ存在し、それ以外の動物にはどちらか一方の酵素しか存在しない。CHST2(破線枠)は発生期のマウス脳や損傷を受けた成体マウス脳での高硫酸化KSの合成に関わっている。CHST1(太破線枠)はGalの硫酸化を触媒する。
|
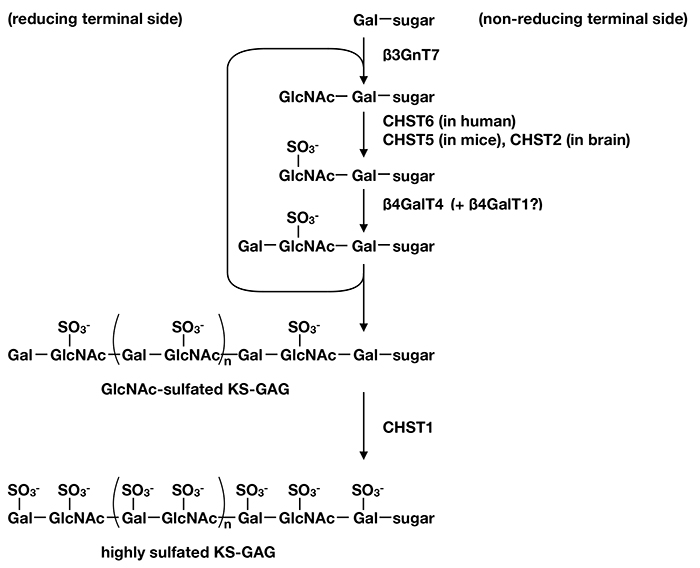
図 2. KS-GAG生合成経路
β3GnT7, CHST6およびβ4GalT4が共役してはたらき、GlcNAc硫酸化KSが合成される。その後CHST1にてGalの硫酸化が行われ、高硫酸化KSが合成される。ヒトではCHST6が主なGlcNAc硫酸転移酵素であるが、マウスにはCHST5が代替する。発生期のマウス脳や障害を受けた成体マウス脳ではCHST2がGlcNAcの硫酸化を行う。β4GalT1もKS伸長に関わっている可能性がある。
|
赤間 智也(関西医科大学医学部薬理学講座)
| References |
| (1) |
Funderburgh JL: Keratan sulfate biosynthesis. IUBMB Life 54, 187-194, 2002 |
| (2) |
Narentuya, Takeda-Uchimura Y, Foyez T, Zhang Z, Akama TO, Yagi H, Kato K, Komatsu Y, Kadomatsu K, Uchimura K: GlcNAc6ST3 is a keratan sulfate sulfotransferase for the protein-tyrosine phosphatase PTPRZ in the adult brain. Sci. Rep. 9, 4387, 2019 |
| (3) |
Hoshino H, Foyez T, Ohtake-Niimi S, Takeda-Uchimura Y, Michikawa M, Kadomatsu K, Uchimura K: KSGal6ST is essential for the 6-sulfation of galactose within keratan sulfate in early postnatal brain. J. Histochem. Cytochem. 62, 145-156, 2013 |
| (4) |
Takeda-Uchimura Y, Nishitsuji K, Ikezaki M, Akama TO, Ihara Y, Allain F, Uchimura K: Beta3Gn-T7 is a keratan sulfate β1,3 N-acetylglucosaminyltransferase in the adult brain. Front. Neuroanat. 16, 813841, 2022 |
| (5) |
Zhang H, Muramatsu T, Murase A, Yuasa S, Uchimura K, Kadomatsu K: N-Acetylglucosamine 6-O-sulfotransferase-1 is required for brain keratan sulfate biosynthesis and glial scar formation after brain injury. Glycobiology 16, 702-710, 2006 |
| (6) |
Seko A, Dohmae N, Takio K, Yamashita K: β1,4-Galactosyltransferase (β4GalT)-IV is specific for GlcNAc 6-O-sulfate: Beta 4GalT-IV acts on keratan sulfate-related glycans and a precursor glycan of 6-sulfosialyl-Lewis X. J. Biol. Chem. 278, 9150-9158, 2003 |
| (7) |
Seko A, Yamashita K: β1,3-N-Acetylglucosaminyltransferase-7 (β3Gn-T7) acts efficiently on keratan sulfate-related glycans. FEBS Lett. 556, 216-220, 2004 |
| (8) |
Kitayama K, Hayashida Y, Nishida K, Akama TO: Enzymes responsible for synthesis of corneal keratan sulfate glycosaminoglycans. J. Biol. Chem. 282, 30085-30096, 2007 |
| (9) |
Fukuta M, Inazawa J, Torii T, Tsuzuki K, Shimada E, Habuchi O: Molecular cloning and characterization of human keratan sulfate Gal-6-sulfotransferase. J. Biol. Chem. 272, 32321-32328, 1997 |
| (10) |
Fukuta M, Kobayashi Y, Uchimura K, Kimata K, Habuchi O: Molecular cloning and expression of human chondroitin 6-sulfotransferase. Biochim. Biophys. Acta 1399, 57-61, 1998 |
| (11) |
Akama TO, Fukuda MN: Carbohydrate (N-acetylglucosamine 6-O) sulfotransferase 5 and 6 (CHST5,6). In: Handbook of Glycosyltransferases and Related Genes. Taniguchi N, Honke K, Fukuda M, Narimatsu H, Yamaguchi Y, Angata T (editors), Springer Tokyo, Tokyo, Japan, 1005-1014, 2014 |
| (12) |
Akama TO, Misra AK, Hindsgaul O, Fukuda MN: Enzymatic synthesis in vitro of the disulfated disaccharide unit of corneal keratan sulfate. J. Biol. Chem. 277, 42505-42513, 2002 |
| (13) |
Torii T, Fukuta M, Habuchi O: Sulfation of sialyl N-acetyllactosamine oligosaccharides and fetuin oligosaccharides by keratan sulfate Gal-6-sulfotransferase. Glycobiology 10, 203-211, 2000 |
2023年 6月15日
|
|---|








