
氏名:三善 英知(みよしえいじ)
現職:大阪大学大学院医学系研究科 機能診断科学講座 教授
学位:医学博士
略歴:1986年大阪大学医学部を卒業。消化器内科(肝臓)を中心とした臨床研修後、大学院から糖鎖の研究を始める。2007年6月から現職。2014-5年医学部保健学科長。2015年〜保健学専攻ボーダレスデザイン医学研究センター長
研究テーマと抱負:糖鎖の病態生化学に関する研究で、多くの基礎・臨床の教室と共同研究を続けている。糖鎖研究の力で、難治性消化器疾患の治療法を開発することが大きな夢である。
肝臓は重量が約1500gの人体最大の臓器である。約2,500億個の細胞からなると言われているが、いわゆる肝細胞(Hepatocyte)と呼ばれる細胞は全体の約70-80%程度で、残りは非実質細胞である。肝細胞の働きとしては、血清タンパクを主体とした様々なタンパクの合成、脂質/糖質代謝、解毒、胆汁の生合成などがあげられる。一方、非実質細胞の中には肝臓に存在するマクロファージ様細胞としてのクッパー細胞、ビタミンA貯留細胞としての肝星細胞、その他胆管上皮細胞や血管内皮細胞が含まれる。肝臓は沈黙の臓器とも呼ばれ、全体の機能が70%ぐらいまで低下しても予備能力があり、あまり症状が出ない。しかし急性肝炎などで急激に肝臓が障害を受けると、強度の全身倦怠感や黄疸(眼が黄色くなること)が出現する。また慢性肝炎から肝硬変(炎症と再生を繰り返す間に肝臓が線維組織に置換された慢性肝疾患の終末像)になり、さらに病状が進んで非代償性肝硬変になると、黄疸、腹水、肝性脳症などの症状が出る。肝臓の病気の特徴としては、慢性肝炎、肝硬変、肝がんへと段階的に進展することである。一般の健常者から突然肝がんが見つかることは極めて稀だが、肝硬変患者の場合は年間5-8%ぐらいの確率で肝がんが見つかる。慢性肝炎の原因として、B型肝炎ウイルス(HBV)による慢性B型肝炎とC型肝炎ウイルス(HCV)による慢性C型肝炎があげられる。HBVはDNAウイルスでワクチンによる予防が可能であるが、RNAウイルスであるHCVはワクチンでは予防できない。近年HCVに対する画期的な治療としてDAA(direct acting antivirals)が開発され、ほぼ100%に近い確率で慢性C型肝炎が完全に治癒できるようになった。従来のインターフェロン治療に比較して、奏功率、副作用などの点からも、DAAは圧倒的に優れている。一方慢性B型肝炎に対する治療としては、インターフェロンと核酸アナログが主流である。しかしインターフェロン治療は奏功率があまり高くなく、核酸アナログは一生服用を続ける必要があるため、HBVに対する新しい治療薬の開発研究が行われている。ウイルス性以外の肝炎としては、アルコール性、薬剤性、自己免疫性などの原因があげられる。また生活習慣の欧米化に伴い従来は問題なしとされてきた脂肪肝の中にも、肝硬変・肝がんに進展する悪い脂肪肝が存在することがわかってきた。非アルコール性の脂肪肝はNAFLD(Nonalcoholic fatty liver disease)と呼ばれ、その中の約10-20%にNASH(Nonalcoholic steatohepatitis)が含まれ、肝硬変・肝がんに進展する危険性がある。NAFLDの中からNASHを鑑別診断する唯一の方法が肝生検(肝臓の組織を採取して、病理学的に診断する方法)である。しかし全国で約1000〜2000万人以上いるNAFLD患者に対して肝生検を行うことは実質的に不可能で、非侵襲的なバイオマーカーの開発が望まれている。
近年グライコミクスの研究手法が急速に進歩して、多くの糖鎖関連バイオマーカーが報告されてきた。血清の糖鎖を網羅的に解析すると、ほとんどの糖鎖は肝臓または免疫グロブリンに由来する。GlycosylationとbiomarkerでPubMedを検索すると約4000報の論文が見つかるが、その約1/4が肝疾患関連のバイオマーカーである。炎症やがん化に伴って糖鎖が変化することは古くから知られているので、肝炎や肝がんになると肝臓由来の糖タンパク質は大きく変化する。最も代表的な肝がんの糖鎖バイオマーカーは、フコシル化アルファフェトプロテイン(AFP-L3)で1, 2、日本発のバイオマーカーとして2000年にはFDA(アメリカ食品衛生局)でも承認された3。古くから肝がんの腫瘍マーカーとして臨床的に使われて来たAFPは肝硬変などの慢性肝疾患でも上昇するが、AFP-L3は肝がんに極めて特異性が高い。詳細は本サイトの里村氏が書かれたreviewを参考にしていただきたい。1990年代、私たちは大阪大学医学部生化学教室 谷口直之教授の下で、世界に先駆けN型糖鎖の分岐に関わる糖転移酵素のタンパク精製と遺伝子クローニングに成功した(図1)。不思議なことに、これらの糖転移酵素は正常の肝細胞ではほとんど発現せず、慢性肝炎、肝硬変、肝がんになると遺伝子発現が増加する4, 5。一般的にがん化に伴い変化する糖鎖修飾として、フコシル化、シアリル化、分岐構造の増加(枝分かれ)が言われている。図1に示すN-アセチルグルコサミン転移酵素V(GnT-V)は、N型糖鎖の分岐鎖に関わる重要な糖転移酵素で、分岐鎖構造が増加すると間接的に末端のフコシル化、シアリル化が増加することになる。GnT-Vは多くの糖転移酵素の中で、最もがんの転移と関連性が高い酵素として古くから注目されてきた6。何故、図1に示す糖転移酵素が正常の肝細胞では発現が低い理由として、肝細胞のほとんどがG0期にあって増殖しないためかもしれない。細胞が増殖する時にこれらの糖鎖が存在した方が、細胞にとってより効率的に増殖しやすいとも言える。実際に、ラット70%肝切除による肝再生のモデルでは、図1に示す糖転移酵素の遺伝子発現は著増する7。細胞表面に存在する多くの増殖因子の膜受容体に存在する糖鎖構造の変化が、そのシグナル伝達に変化を与えるのではないかと想定される。肝再生と糖鎖に関する詳細な検討は、本サイトの福田氏、顧氏が書かれたreviewを参考にしていただきたい。
2003-2007年のNEDOプロジェクト「MGプロジェクト」(代表者 産総研 成松 久教授)において、レクチンアレイを使ったグライコミクスの手法により、肝臓の線維化マーカーとしてM2BPGi (mac-2 binding protein糖鎖異性体)の開発がなされた8。WFAというレクチンと結合するMac2-binding proteinをM2BPGiと呼び、肝臓の綿維化マーカーとして実際に保険適応されている。本プロジェクトでは、培養細胞株とヒトがん患者血清を用いて新しいがん糖鎖バイオマーカーを開発することが大きなミッションであったが、結果的に最初に発見されたものは肝臓の線維化マーカーであった。肝臓の糖鎖研究を長く行っていると、肝疾患の進展過程で最も糖転移酵素の遺伝子発現がダイナミックに変化するのは、肝硬変の(つまり肝繊維化がおこる)時期であることがわかる9。その意味でM2BPGiが最初に見つかったことは、非常にreasonableであると思う。Mac-2 binding proteinは、がんやウイルス疾患で血中に増加するタンパクとして古くから知られており、ガレクチン3の結合タンパクである。肝臓の線維化マーカーとしてM2BPGiが保険適応された関係もあり、M2BPGiに関する多くの論文が公表されるようになった。M2BPGiは肝臓の線維化マーカーにとどまらず、他の疾患のバイオマーカーとしての有用性があるかもしれない。詳細は、本サイトの鎌田、三善によるreviewを参考にしていただきたい。血清糖鎖の網羅的な解析に行うと、健常人と肝がん患者を比較した場合、非常に多くの糖鎖が変化する10。特に肝がんの場合は、肝硬変や慢性肝炎がベースにあるので、その中で本当に肝がんの特性を示す糖鎖とそのキャリアタンパクの同定が重要となる。また血中に豊富なタンパクであるIgGの糖鎖は、慢性炎症や加齢に伴って変化するため、肝疾患にとどまらず多くの慢性炎症性疾患の病態を反映するものであり、今後どのようにそれを活用していくかは重要な課題と考えられる。IgGの糖鎖変化として最も有名なのがガラクトース欠損IgGで、慢性関節リウマチ患者を中心として自己免疫性疾患で検討されて来た11。私たちも炎症性腸疾患の患者で検討したところ、ガラクトース欠損IgGは疾患の活動性を反映するバイオマーカーであることがわかった12。また、レクチンを使った方法で間接的にIgGの糖鎖を調べたところ、その変化は肝臓の線維化とよく相関したという報告もある13。
一方、遺伝子からのアプローチから肝がんのバイオマーカーとして見つかったのがグリピカン3である。元々は腸管の分化にともなって発現が変化する遺伝子として、differential displayの方法を用いてFilmusらによって発見された14。グリピカン3は長いヘパラン硫酸をもつプロテオグリカンで、その遺伝子異常はヒトの先天性疾患を引き起こすことが知られている15。グリピカン3は肝硬変に較べて肝がんで遺伝子発現が上昇し、細胞表面に存在するグリピカン3が切断され細胞外に分泌される。このため肝がん患者の血中グリピカン3は肝硬変患者に較べて有意に上昇し、AFPに次ぐ新しい肝がんのバイオマーカーとして期待された16。また、グリピカン3は肝がんに対するワクチンとしても期待されており、詳細は本サイトの中面らの項を参考にしていただきたい。これまで書いてきたように、肝臓の糖鎖および糖鎖関連分子の発現は疾患発症で劇的に変化し、血中の糖タンパク質の糖鎖は大きく変化する。一般的に糖鎖の解析は難しく、糖鎖研究者以外の者にはできないものとして他の分野の研究者からは敬遠されてきた。しかし、近年微量解析技術の進歩とともに、臨床医学の研究室においても糖鎖研究が可能となってきた。多くの臨床の学会で糖鎖がトピックとして取り上げられ、そして大型研究費が出ている。その代表例として、本サイトの坂本、小川の項を参考しにしていただきたい。2018年の糖質学会シンポジウムで、「糖鎖関連大型研究の現状と将来展望」として、糖鎖研究の未来が議論された。その議論の中で、20年後は糖鎖生物学という名前そのものがなくなるのでは?という過激な意見が出された。つまり糖鎖解析が誰でもどこでも容易にできる時代になるのではということである。もし本当にそのような時代が来るとしたら、肝臓研究者にとって糖鎖は研究の宝庫と言えるだろう。
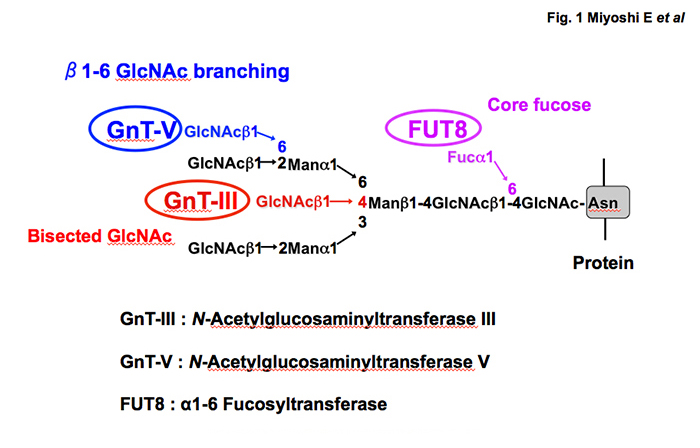
図 1 N型糖鎖の分岐鎖構造を決定する3つのメジャーな糖転移酵素とそれらが作る糖鎖構造
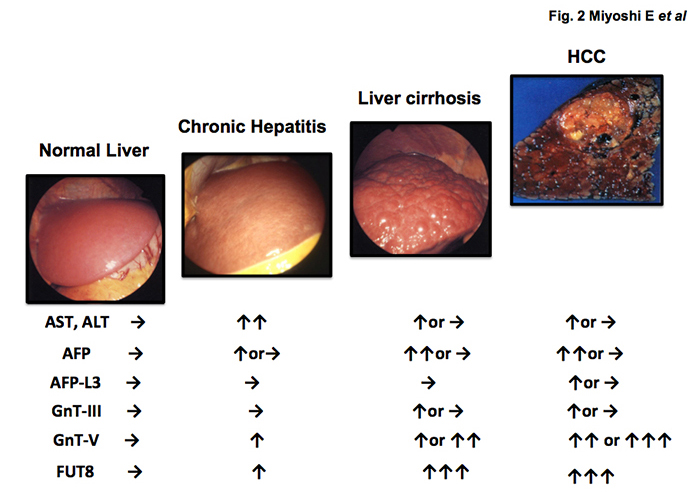
図 2 肝疾患が慢性肝炎、肝硬変、肝がんに進展するときの、肝臓の逸脱酵素(AST, ALT)、肝がんの腫瘍マーカー(AFP, AFP-L3)、およびFig.1に示す糖転移酵素GnT-III, GnT-V, FUT8の肝臓での発現