Mar. 15, 2010
ヒアルロン酸を合成する細胞膜突起とヒアルロン酸コートの謎(2010 Vol.14, A2)
Kirsi Rilla / Markku Tammi / Raija Tammi
氏名:Kirsi Rilla
Rilla博士はユヴェスキュレ大学で細胞生物学の修士号を取得した。クオピオ大学のTammi教授らの研究グループで行った博士課程の研究は、ヒアルロン酸(以下HAと略記する)合成酵素の細胞内移送とその細胞形態および細胞遊走に及ぼす影響に焦点をあてたものであった。この学位論文の研究が、細胞膜のHA合成酵素誘発突起の発見をもたらした。Rilla博士は現在、東フィンランド大学の生物医学研究所で講師として勤務している。博士の研究は生細胞の共焦点顕微鏡検査技術を軸にしており、研究テーマの中心はHA合成酵素の制御と移送、HA誘発微繊毛およびHAコートの生物学検討である。
氏名:Markku Tammi
Markku Tammi はフィンランドのTurku大学からMDとPhDをそれぞれ1975年と1979年に授与された。1979年にKuopio大学解剖学科へ移り、現在は解剖学の准教授である。1984-86年、博士はCalifornia大学Berkeley校の生物化学科でポストドクとして過ごし、 1994-96年にはCleveland Clinic Research Instituteで研究員としてサバティカル休暇を過ごした。博士は関節軟骨のグリコサミノグリカンを研究してきたが、最近のテーマは表皮におけるヒアルロン酸の代謝である。
氏名:Raija Tammi
Raija Tammi はフィンランドのTurku大学から、1975年にMDを、1981年にPhDを授与された。その後彼女は同国Kuopio大学へ移り、解剖学科の助教授として勤務している。博士は1984-86年、California大学San Francisco校の皮膚科学教室でポストドクとして過ごし、1994-96年にはCleveland Clinic Research Instituteで研究員としてサバティカル休暇を過ごした。博士は上皮組織のHA代謝を研究してきたが、現在は角化細胞(ケラチノサイト)分化におけるHAの役割に焦点を当てている。
1. はじめに
HAは細胞外マトリクスおよび体液の重要な構成要素であり、プロテオグリカンをはじめ他のマトリクス分子と結合することによって軟骨などの組織2の構造を形成し、機械的特性を制御することが知られている1。HAは、細胞および組織が活発に成長し、運動し、再生4するのに適した強い水和環境をもたらす3。細胞内の多くのシグナル伝達事象の引き金となり、増殖、遊走、接着、アポトーシス、細胞形態の変化、多剤耐性獲得などの過程に影響を及ぼしている5-8。
HAは、いわゆる細胞外マトリクスのほかに、細胞に近接した糖衣と呼ばれる細胞周囲コートにもみられる。滑膜細胞9および中皮細胞10などの摩擦軽減表面を形成する細胞のほか、結合組織の柔軟性を保つ繊維芽細胞や平滑筋細胞などにも大規模なHAコートがみられる。さらに、損傷した皮膚上皮の角化細胞のように、傷害を受けて炎症が惹起された組織の細胞上にはHAの細胞周囲コートが大きく広がり11、創傷治癒に必要な角化細胞の増殖と再構成とを促進する11-14。また、HAコートは動脈平滑筋細胞の遊走と増殖を刺激する15。
HAの細胞周囲コートの重要性は明白であるが、その構造、形成過程、HA合成との関係について、メカニズムをはっきりと見通せるまでには至っていない。 HA合成酵素(HASs)の追跡16,17や生細胞のHAコートの直接検出18を可能にするツールを使うことでこれらの過程が明らかになりつつある。
2. ヒアルロン酸合成酵素(HASs)
脊椎動物のHASファミリーにはHAS1、HAS2、HAS3の3種類がある。いずれも7つの膜会合ドメインを有する細胞膜タンパクであり19、中心の細胞質ドメインに酵素活性部位がある20。HASはUDP-グルクロン酸およびUDP-N-アセチルグルコサミンという2つの糖を基質とし、アンカー残基のUDPを遊離させながら、対応するUDP糖をHA鎖の還元末端に交互に付加する21。伸展するHA鎖は合成と同時に細胞膜を通過し、細胞膜外の領域に移動する22。HAの移送に際して、細胞膜内に孔を形成するためにHAS以外のタンパクが必要になるとは考えにくい。
いくつかの成長因子とサイトカインが、それぞれの細胞膜受容体26,27から発せられるシグナルを介してHASアイソザイムの発現を制御している12,23-25。さらに、HA合成は、転写後に生じるHASのリン酸化28,29およびユビキチン化や酵素二量体形成(Heldinら、未発表)などの事象のほか、細胞質でのUDP糖基質調達の可否によって制御されていると思われる30,31。急性創傷が起きてわずか2〜3分の間に観察されるHA分泌の迅速な変化を可能にしているという点からみて、後者の機構が重要であるといえる32。
3. 細胞膜上でのHASの移送と活性化
Fig.1Aは、細胞膜上と細胞内小胞オルガネラにGFP-HAS3融合タンパクを発現しているMCF-7細胞を示したものである17。GFP-HASを発現している細胞内小胞の一部は58KタンパクとTGN38タンパクを内包しており、ゴルジ小胞体であることを示唆している17。ブレフェルディンA(Brefeldin A)によって細胞膜輸送を阻害するとGFP-HASが細胞膜から消失し(Fig.1C)、ノコダゾール(no codazole)によってゴルジ装置を破壊するとGFP-HASが細胞内小胞体に再配分されたことから(データは示していない)、HASsが膜貫通タンパクの通常のER(小胞体)-ゴルジ経路を介して細胞膜へ輸送されているという仮説がさらに裏付けられたといえる16,17。免疫染色により、内在性のHASがゴルジ体およびERのマーカーと局在することが示されている(Rilla、未発表)。
HASの細胞膜への進入とHA合成に向けた活性化の間には、強い結びつきがあるように思われる17。GFP-HASを過剰発現している細胞には通常の条件下でも、ブレフェルディンAによって細胞膜へのHASの輸送を阻害した場合でも、細胞内HAの蓄積増が認められなかった17。GFP-HASのC末端の16個(Fig.1E)または45個(Fig.1F)までのアミノ酸が欠失していると細胞膜への進入が阻害され、ER-ゴルジ体区画に蓄積する17。このような変異体ではHAの細胞外分泌も細胞内蓄積もみられなかった。正しく折りたたまれているとしても、GFP-HAS3複合体の活性ドメインがポイントミューテーションによって不活化していると、細胞膜に到達することができない(Fig.1D)17。さらに、4-メチルウンベリフェロン(4-MU)(Fig.1B)17またはマンノース30によってUDP-糖前駆体の細胞内プールを枯渇させると、細胞膜へのGFP-HASの移送が阻害される。この遮断は可逆的なものであり、4-MUを除去すると1時間以内にGFP-HASが細胞膜内に進入し、HA合成が開始される17。以上のように、HASが細胞膜内に進入してHA合成を開始するためには、 正しく折りたたまれて酵素活性を発揮し、十分な量のUDP-糖基質の供給を受けていることが必要である17。
細菌の細胞膜では、HASは活性に不可欠なカルジオリピンと共存している21。カルジオリピンは哺乳類の細胞膜には認められないが、クラスIのHASはいずれも活性を発揮するために何らかの脂質成分を必要とすると考えられる21。GFP-HAS3の一部はHAS誘発突起のコレステロールに富む脂質ラフトの近傍に局在し、β-メチルシクロデキストリンによって細胞膜のコレステロール含量を減少させるとHA合成および突起形成が阻害される(Kulttiら、未発表)34。膜の脂質環境の変化によってHASの酵素活性が直接影響を受けている可能性があるが、ほかにもβ-メチルシクロデキストリンによる脂質ラフトの破壊によってPI3K-AKT経路の阻害などの一連のシグナル伝達が変化している(Kulttiら、 投稿中)。このようなシグナルが、HASの発現レベルと活性の転写修飾および転写後修飾に寄与していると考えられる。
ここでみられたGFP-HASの大量のプールはこの融合タンパクの過剰発現によるものであるかもしれない。ただし、内在性HAS の免疫染色で 同様のパターンがみられることから(Rilla、未発表)、細胞内にはHASの潜在プールがあり、リン酸化28やそれ以外のタンパク修飾によっていつでも必要に応じて活性化することが示唆される。オートファジー(自食反応)を開始することがわかっている35高ブドウ糖培地で 細胞分裂を誘導されたラットのメサンギウム細胞で、細胞内のHASプールに不適切な早期活性化が起こすことができる。
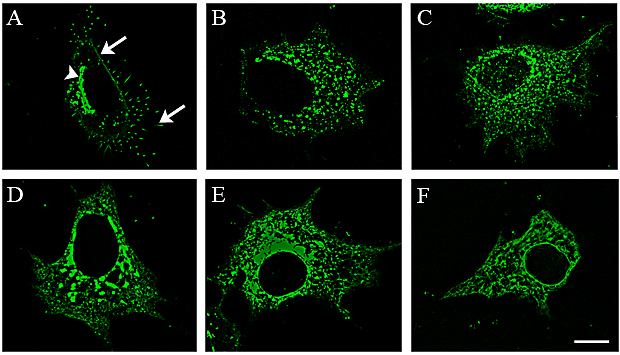
Fig. 1 HAS 活性と細胞膜上局在が連結している。
(A)では、明瞭な標識色によりゴルジ体内(先頭)、細胞膜および突起(矢印)のGFP-HAS3の正常な局在が認められる。GFP-HAS3の活性を4-MUにより阻害すると、HASが細胞内に取り込まれる(B)。HASの細胞膜への進入と微繊毛の形成がブレフェルディンA(C)、酵素活性部位のポイントミューテーション(D)、16個のアミノ酸(E)または45個のアミノ酸除去(F)により阻害される。倍率バーは10 µm。
4. HAS誘発性細胞膜突起
ラット表皮角化細胞(Fig.2A、B)およびMCF-7乳癌細胞に活性型HAS2(Fig.2A、C)およびHAS3(Fig.2B、D)をトランスフェクトすると、20μmに及ぶ微繊毛型の細胞突起が誘導される33。この突起は「触手」のように細長く、培地内で細胞の表層側に突出してくる。このような構造が時に数百は認められ、GFP-HAS3をトランスフェクトした中皮細胞の顕微鏡像が示すように、細胞がハリネズミのような外観を呈する(Fig.2E〜G)。電子顕微鏡下の観察によれば突起の直径は約100nmで、位相差顕微鏡では検出がほぼ不可能であり、固定すると切れたり潰れたりしやすくなる(Fig.3)。このような突起を生成して維持できるかどうかは、HASへの結合を保った継続するHA合成にかかっている。突起の長さの平均値は細胞のタイプによってさまざまである(Fig.2B、D、E)。ブレフェルディンAによって細胞膜へのHASの移送を止めてHA合成を阻害するか、4-MU36またはマンノース30によってUDP糖基質のプールを枯渇させると、突起の新生が阻害され、既存の突起が退縮を来す18,33。細胞をヒアルロニダーゼにさらすと、この突起は数分で退縮し(Fig.4)、培地からブレフェルディンAを除去して細胞膜にHASが回復すると、3〜4時間で再び形成される(Fig.5)。突起上でCD44はHASと共局在するが、突起の形成に不可欠なものではない33。この突起はRHAMMも、12糖以下のサイズのHAオリゴマーとの競合に感受性を示すその他の受容体も必要としない33。
このHAS誘発突起にはアクチンミクロフィラメントが含まれ、アクチンフィラメントを阻害すると突起が収縮することから、アクチンが突起を支えていることがわかる33。しかし、直接的であれ間接的であれ、HASとアクチン細胞骨格との相互作用を示すデータはない。アクチンは突起の伸展を開始しているのか、微繊毛が成長するにしたがって現れるにすぎないのか、現時点ではわかっていない。アクチンミクロフィラメントとは異なり、HAS誘発突起には微小管が存在せず、突起形成にも必要とされない33。
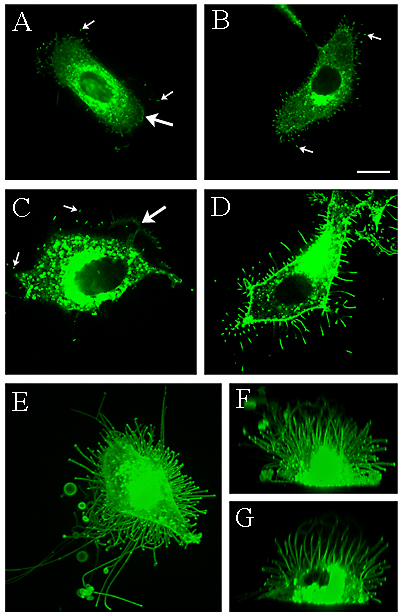
Fig. 2 HAS の過剰発現により微繊毛様突起の形成が誘発される。
GFP-HASのトランスフェクションにより微繊毛様の細長い細胞膜突起の形成が誘発される。ラットの表皮角化細胞にGFP-HAS2(A)またはGFP-HAS3(B)をトランスフェクト、MCF-7乳癌細胞にGFP-HAS2(C)またはGFP-HAS3(D)をトランスフェクトした。GFP-HAS3をトランスフェクトした中皮細胞LP-9の3次元構造を上から(E)および横から(F)撮影した映像と、垂直方向にスライスした5μmの切片(G)の映像を示す。AおよびCの大きな矢印が層状足の縁を示しており、A、B、Cの小さな矢印が微繊毛の先端を示している。倍率バーは10 µm 。
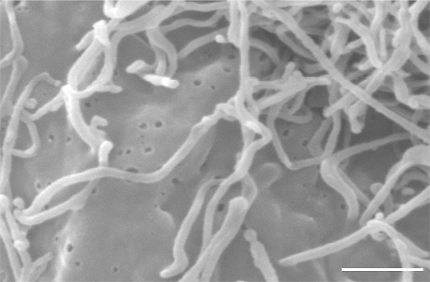
Fig. 3 走査型電子顕微鏡による微繊毛の構造。
走査型電子顕微鏡によりHAS3をトランスフェクトしたMCF-7細胞の表面に張り付いた微繊毛の構造を示した。各微繊毛の直径は約130nmである。倍率バーは1 µm。
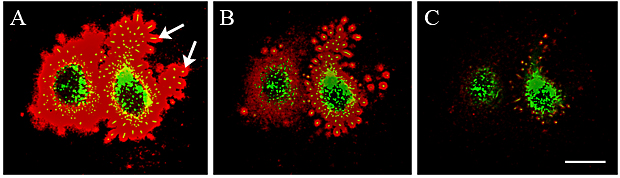
Fig. 4 HA合成酵素誘発微繊毛は細胞周囲HAに依存性を示す。
GFP-HAS3をトランスフェクトしたMCF-7細胞に、Streptomycesのヒアルロニダーゼ(5 TRU/mL)を添加したときの添加前(A)、10分後(B)、20分後(C)の光学切片による同一の生細胞の共焦点像である。蛍光ラベルしたHA結合プローブ(赤色)により可視化されたHAコートが各微繊毛を覆っているのがわかる(写真Aの矢印は一本の微繊毛およびコートを示す)。写真BおよびCでは、コートが徐々に消化され、GFP-HAS3を発現する微繊毛は縮小している。倍率バーは10 µm。

Fig. 5 細胞膜にHASが回復すると、再び微繊毛の成長が始まる。
GFP-HAS3をトランスフェクトしたMCF-7細胞をブレフェルディンAと2.5時間インキュベートして細胞膜へのHASの輸送を遮断し(0 h)、その後ブレフェルディンAを除去した培地に移し、指定時間ごとに映像化して微繊毛の再生を追跡した。下の写真が同一細胞の突起の列を上からおよび横から見た生細胞の共焦点3次元顕微鏡像で、突起が徐々に成長しているのがわかる。倍率バーは10 µm。
Fig.6に、微繊毛のHASと生成したHAとの関係を示す3D画像と、GFP-HAS3をトランスフェクトしたMCF-7の生細胞のシングルスライス画像を示した。微繊毛の横断面から見てもわかるように、HAコートは微繊毛をなぞるようにして、2mm以下の厚さで微繊毛の周囲に均一に層化している(Fig.6F、H)。
軟骨細胞37,38、中皮細胞10、滑膜細胞39のようにもともとHAを高度に産生している細胞では、細胞周囲のHAコートが大きく発達しており、従来からFig.7のBおよびCに示すように赤血球排除試験により可視化されている。HA(赤色)およびMCF-7の生細胞上のGFP-HAS3を示す蛍光プローブにより、細胞膜上に薄く微繊毛の突起(黄色)が見える(Fig.7A、B)。ここに示すHAを伴う突起は赤血球を排除し、細胞周囲コートの存在を明らかにしている(Fig.7B)18。トランスフェクトされていない中皮細胞の生細胞のHAを染めた(赤色)場合でも、突起が自然に形成され、HASのトランスフェクションによって誘導された場合と同じく、厚さ0.5-2.0μmのHAの層(Fig.7C)によって覆われているのがわかる18。この突起は明らかに細胞周囲コートのための足場となっており、突起に沿ってHA鎖の単層を形成する場合よりも排除空間の厚みが大幅に増大している(厚さ最大約2 µm)。
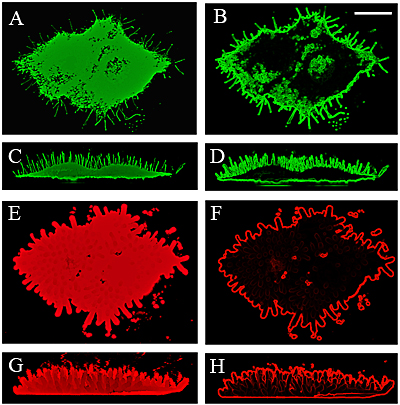
Fig. 6 微繊毛はいずれもHAコートで覆われている。
GFP-HAS3をトランスフェクトしたMCF-7の生細胞中をHA結合プローブ(赤色)および微繊毛(緑色)により、HAコートの3次元構造を可視化した。写真B、D、FおよびHでは、元の画像(それぞれA、C、EおよびG)を処理して微繊毛の端を可視化し、GFP-HASを発現している微繊毛(緑色、B、D)およびHAコート(赤色、F、H)を示している。倍率バーは10 µm。
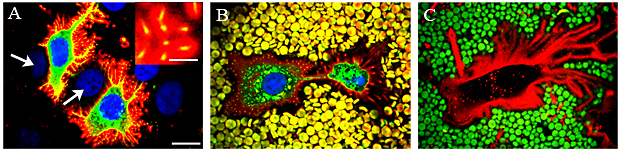
Fig. 7 HAコートは微繊毛の足場になっている。
HA結合蛍光プローブにより、GFP-HAS3を発現しているMCF-7の生細胞の細胞周囲HAコートを可視化した(A, B)。HAS3が緑色、 核が青色、HAが赤色である。写真Aおよびその挿入画像のなかで、HAコート内の黄色い点は微繊毛の断面である。トランスフェクトされていない細胞(写真Aの矢印、青色の核)の一部はトランスフェクトされた細胞に囲まれている。写真Bでは、さらに固定赤血球(黄色)を加え、細胞周囲の排除空間を可視化している。この空間内にHAコートで覆われた微繊毛が足場を築いている(赤色にラベルされたHAが囲んでいる小さな黄色い点)。HA結合蛍光プローブ(赤色)および排除された赤血球(緑色)により、トランスフェクトされていない中皮細胞周囲のHAコートを可視化している(写真C)。画像はどれも単一の光学切片の共焦点像である。倍率バーは10 µmで、写真Aの挿入画像の倍率バーは2 µm。
5. ヒアルロン酸を合成する細胞小器官としての微繊毛と糸状仮足
HAを活発に合成している細胞には糸状仮足40、葉状仮足41、膜ラッフル42といったようにさまざまな細胞膜突起が存在する。これらの突起は表層側の微繊毛のように33、HASにつながったHAの高密度層に覆われている18。HA合成が成長因子によって誘導されると、微繊毛が増加する23。その結果、伸展した細胞表面がHA合成には格好の場を提供している可能性が高い。このHA合成の場についてひとつ考えられることは、表面の伸展によって細胞膜の占める領域が大幅に増大し、細胞表面にHAが蓄積する空間が提供されるということである。
HA合成のためには大量の糖ヌクレオチドが消費されるので、突起中では当然ながら能動輸送や局所的生合成が行われる必要がある。脂肪細胞の分化にはそのエネルギー代謝を支える微繊毛の誘導が必要となる43。この場合の細胞膜にはHASとHAの複合体が高い粘弾性を付与しているため、グルコース輸送体タンパクおよびインスリン受容体などのタンパクが側方拡散を妨げられ、繊毛内に濃縮することになる43。この現象によってグルコース取り込みが加速され、HA合成に必要なエネルギーおよび前駆体の産生を促すと考えられる。微繊毛のアクチン核は拡散を防ぐバリアとして作用し43、繊毛の先端に前駆体を濃縮させ、HA産生を増大させるポジティブフィードバックのループを形成する役割を果たしている。
軟骨のように細胞数が少なく細胞外の空間が大きい結合組織では、長い突起においてHA合成は特に重要な意味を持つと思われる。この種の組織では、遠く離れた細胞体からマトリックスにHAを運ぶ拡散輸送がきわめてゆるやかなものにならざるを得ない。微繊毛や糸状仮足を利用し て、必要とする部分にHAを直接届けることにより、この問題を解決していると考えられる。
6. ヒアルロン酸コートと細胞間相互作用
細胞同士が固く結ばれている上皮組織では通常、境界面のHAコートが大きな効果を発揮している。HAコートはどちらかといえば上皮のバリア機能を乱す方向に働き24,44、上皮細胞間での細胞や分子の移動を促進している。いわゆる表皮のような重層表皮では、角化細胞表面のHAは細胞接着(デスモソーム)を弱め45、細胞の移動能を高める。その結果、栄養の拡散経路が拡大し、増殖速度が高まる23,24。このような効果は創傷治癒に際して細胞の再組織化を助け、炎症応答を促進するものである11,14。
粒子がなく移動が制限されるアルロン酸コート内の水は、細胞にとっての専有空間であるほか、他の細胞や高分子および病原体に対する防護壁になっている。癌細胞上のHAは、細胞障害性白血球に対する機械的防護壁として作用する47だけでなく、白血球の免疫学的活性 に影響を与えると考えられる48。このほかHAコートは、乳癌細胞および前立腺癌細胞と上皮細胞との間や49、単球と間質線維芽細胞との間の細胞間相互作用を促進すると考えられる50。炎症によって誘導された角化細胞のHAコートでは、HA依存的な単球同士の結合が認められており30、皮膚の創傷治癒の過程で重要な役割を果たしていると考えられる51。
7. 細胞の遊走および浸潤に果たす微繊毛およびヒアルロン酸コートの役割
HAを大量に合成している上皮細胞は、間葉系の特徴を獲得(上皮間葉移行、EMT) して細胞遊走能が亢進しており52、増大したHAコートは中皮腫細胞53および角化細胞 で刺激に反応する遊走と関連すると考えられる12。細胞遊走の一部分はHA受容体のCD44および RHAMMを介したものであるが5、HAS2によるHA合成のみによってもRac1活性、糸状仮足および層状足の生成が制御され、細胞遊走が亢進する41。このため、siRNA54あるいは化学物質の阻害剤を使用した13,36 HAS2発現の下方調節で遊走が抑制される。HAのシグナルとアクチン機構の間を仲介するメカニズムは未だ明らかにされていないが、HAコートの水を引き込む作用に起因する機械的な力が細胞膜に働き、このメカニズムを動かしていると考えられる。
微繊毛のような突起は通常、悪性形質転換55、癌細胞および間質細胞の浸潤性に関係があるものである56。乳癌および前立腺癌の移植腫瘍細胞で、HAS2またはHAS3の発現を強制的に高めると腫瘍の成長が促進され、発現を抑制すると腫瘍の成長が抑えられる59,60。ただし、HAの濃度が過度に高い場合には癌細胞の増殖、遊走、浸潤が阻害されることは明白である61-63。HAS3誘発突起が細胞膜の表層側全体を覆うのに対して、HAS2は細胞の辺縁部に突起を誘発し、特に遊走の開始点となる層状足に誘発する頻度が高いのは興味深いことである(Fig.2のBおよびCの矢印部分)。
HAコートによって癌細胞の周りの膨潤圧が高まり、HAの合成が活発でない周囲の細胞や繊維状ECMとの間の空隙が縮まるため(Fig.7Aの矢印部分を参照)、癌細胞の増殖および浸潤が容易になり、腫瘍の成長と浸潤が促進される。同じメカニズムにより、HAでコートされた突起を持つ腫瘍繊維芽細胞も癌細胞の浸潤を助長している(Rilla、未発表)。
8. シグナル伝達の基盤としてのヒアルロン酸誘発突起
細胞周囲のHA濃度の増大と相関してEGFR64、Erb26,29、PDGFR65などの成長因子受容体を介するシグナル伝達が亢進する。このシグナル伝達に占めるHAの重要性はErbB2を過剰発現した乳癌細胞にみられ、この細胞ではHAを除去するとトラスツズマブ治療の効果が増強される66。このようなHAの作用はHA受容体の活性化を介したものであると一般に考えられているが、HAはさまざまな成長因子やシグナル伝達分子に富む細胞突起を生み出すことにより、 シグナル伝達経路全般を強化していると思われる。このことは既に他の微繊毛で明らかになっている67。著者らの未発表データでは、HAS誘発突起はEGFRおよびErbB2にも富んだものであることが示されている(Rilla、未発表データ)。以上のことから、HA誘発微繊毛は、細胞膜上に脂質ラフトと同じようなシグナル伝達の基盤を築いていると考えられる。
9. 結語
細胞内小胞にGFP-HASの多くが存在し、ブレフェルディンAによる遮断を解除すると反跳効果がみられたことは、ER-ゴルジ経路に潜在的なHASのプールが存在することを示唆している。この不活性酵素のプールは迅速に移動し、細胞膜上で活性化することができるものであり17、組織損傷などの状況で素早く効果的にHA合成を開始させるように制御するという点からみて重要なものである。さらに、HASの活性化が必ず細胞膜に限局して起きることによって、HA合成が細胞内の区画に向って起こるような不都合を防いでいる16。
自然な速度上昇の場合でもHASのトランスフェクションよる場合でも、HA合成の速度が上がると糸状仮足または微繊毛様の膜突起が誘導される。HA合成によって突起が維持される一方、それと 逆に、おそらくは細胞膜の領域が拡大して基質とエネルギーの供給が増加することにより、突起の形成がHA合成を 促進 することになる。突起は典型的なHAコートにとっての足場として働くことにより、他の細胞、粒子、高分子のタンパク複合体が入れない排除空間の体積を著明に増大させる。HA誘発膜突起は多くの成長因子受容体が多く発現する部位となり、シグナル伝達を増強しているのではないかと思われる。このような突起が細胞の中心から遠く離れたマトリクスへHAを送り込み、細胞の遊走に備えて環境を探る役割を果たしている可能性が考えられる。
この分泌機構は、再生、治癒、新生物組織などにかかわる生体機能を制御するために必要な細胞外マトリクスの生成と、炎症反応を惹起するさまざまな有害物質に対する応答の、いずれにとっても重要なものである。
謝辞
Riikka Kärnä、Sari Maljanen、Eija Kettunen、Arja Venäläinen、Virpi Miettinen、 Sunna Lappalainenの皆さんにはその専門技術による支援に対して、Kari Törrönenには画像処理に関する支援に対して、特別な感謝を捧げる。GFP-Has3融合体を調製していただいたAndrew P. Spicer博士に感謝する。本研究に共同で取り組んでいただいたJuha Hyttinen、Hannu Karjalainen、Ville Koistinen、 Anne Kultti 、Hanna Siiskonenの皆さんに感謝する。本研究は、フィンランドアカデミー(M.T.)の支援のほか、フィンランド文化財団(K.R.)、クオピオ大学財団(K.R.)、北サヴォ癌財団(K.R.)、パーヴォ・コイスティネン財団(K.R.)、エミール・アールトネン財団(K.R.)、ヴェーネ ネンファミリー協会(K.R.)、フィンランド癌財団(R.T.)、フィンランド科学技術センターTEKES(M.T.)、クオピオ大学病院EVO助成金(M.T.)による助成を受けて実施したものである。
References
- Laurent, T. C., Laurent, U. B., Fraser, J. R. The structure and function of hyaluronan: An overview. Immunol. Cell Biol. 74, A1-7, 1996.
- Hardingham, T. E., Muir, H. The specific interaction of hyaluronic acid with cartilage proteoglycans. Biochim. Biophys. Acta 279, 401-405, 1972.
- Laurent, T. C, Fraser, J. R. Hyaluronan. FASEB J. 6, 2397-2404, 1992.
- Toole, B. P. Developmental role of hyaluronate. Connect. Tissue Res. 10, 93-100, 1982.
- Thorne, R. F., Legg, J. W., Isacke, C. M. The role of the CD44 transmembrane and cytoplasmic domains in co-ordinating adhesive and signalling events. J. Cell. Sci. 117, 373-380, 2004.
- Misra, S.Obeid, L.M., Hannun, Y.A., Minamisawa, S., Berger, F.G., Markwald, R.R., Toole, B.P., Ghatak, S. Hyaluronan constitutively regulates activation of COX-2-mediated cell survival activity in intestinal epithelial and colon carcinoma cells. J. Biol. Chem. 283, 14335-14344, 2008.
- Toole, B. P., Slomiany, M. G. Hyaluronan: a constitutive regulator of chemoresistance and malignancy in cancer cells. Semin. Cancer Biol. 18, 244-250, 2008.
- Turley, E. A., Noble, P. W., Bourguignon, L. Y. Signaling properties of hyaluronan receptors. J. Biol. Chem. 277, 4589-4592, 2002.
- Clarris, B. J., Fraser, J. R. On the pericellular zone of some mammalian cells in vitro. Exp. Cell Res. 49, 181-193, 1968.
- Heldin, P., Pertoft, H. Synthesis and assembly of the hyaluronan-containing coats around normal human mesothelial cells. Exp. Cell Res. 208, 422-429, 1993.
- Tammi, R., Pasonen-Seppänen, S., Kolehmainen, E., Tammi, M. Hyaluronan synthase induction and hyaluronan accumulation in mouse epidermis following skin injury. J. Invest. Dermatol. 124, 898-905, 2005.
- Pienimäki, J. P., Rilla, K., Fulop, C., Sironen, R.K., Karvinen, S., Pasonen, S., Lammi, M.J., Tammi, R., Hascall, V.C., Tammi, M.I. Epidermal growth factor activates hyaluronan synthase 2 in epidermal keratinocytes and increases pericellular and intracellular hyaluronan. J. Biol. Chem. 276, 20428-20435, 2001.
- Rilla, K., Pasonen-Seppänen, S., Rieppo, J., Tammi, M., Tammi, R. The hyaluronan synthesis inhibitor 4-methylumbelliferone prevents keratinocyte activation and epidermal hyperproliferation induced by epidermal growth factor. J. Invest. Dermatol. 123, 708-714, 2004.
- Tammi, R. H. , Tammi, M. I. Hyaluronan accumulation in wounded epidermis: a mediator of keratinocyte activation. J. Invest. Dermatol. 129, 1858-1860, 2009.
- Evanko, S. P., Angello, J. C., Wight, T. N. Formation of hyaluronan- and versican-rich pericellular matrix is required for proliferation and migration of vascular smooth muscle cells. Arterioscler. Thromb. Vasc. Biol. 19, 1004-1013, 1999.
- Müllegger, J., Rustom, A., Kreil, G., Gerdes, H. H., Lepperdinger, G. 'Piggy-back' transport of Xenopus hyaluronan synthase (XHAS1) via the secretory pathway to the plasma membrane. Biol. Chem. 384, 175-182, 2003.
- Rilla, K., Siiskonen, H., Spicer, A.P., Hyttinen, J.M., Tammi, M.I., Tammi, R.H. Plasma membrane residence of hyaluronan synthase is coupled to its enzymatic activity. J. Biol. Chem. 280, 31890-31897, 2005.
- Rilla, K., Tiihonen, R., Kultti, A., Tammi, M., Tammi, R. Pericellular hyaluronan coat visualized in live cells with a fluorescent probe is scaffolded by plasma membrane protrusions. J. Histochem. Cytochem. 56, 901-910, 2008.
- Weigel, P. H., Hascall, V. C., Tammi, M. Hyaluronan synthases. J. Biol. Chem. 272, 13997-14000, 1997.
- Heldermon, C., DeAngelis, P. L., Weigel, P. H. Topological organization of the hyaluronan synthase from Streptococcus pyogenes. J. Biol. Chem. 276, 2037-2046, 2001.
- Weigel, P. H., DeAngelis, P. L. Hyaluronan synthases: a decade-plus of novel glycosyltransferases. J. Biol. Chem. 282, 36777-36781, 2007.
- Yoshida, M., Itano, N., Yamada, Y., Kimata, K. In vitro synthesis of hyaluronan by a single protein derived from mouse HAS1 gene and characterization of amino acid residues essential for the activity. J. Biol. Chem. 275, 497-506, 2000.
- Karvinen, S., Pasonen-Seppänen, S., Hyttinen, J.M., Pienimäki, J.P., Törrönen, K., Jokela, T.A., Tammi, M.I., Tammi, R. Keratinocyte growth factor stimulates migration and hyaluronan synthesis in the epidermis by activation of keratinocyte hyaluronan synthases 2 and 3. J. Biol. Chem. 278, 49495-49504, 2003.
- Pasonen-Seppänen, S.,Karvinen, S., Törrönen, K., Hyttinen, J.M., Jokela, T., Lammi, M.J., Tammi, M.I., Tammi, R. EGF upregulates, whereas TGF-beta downregulates, the hyaluronan synthases Has2 and Has3 in organotypic keratinocyte cultures: correlations with epidermal proliferation and differentiation. J. Invest. Dermatol. 120, 1038-1044, 2003.
- Jacobson, A., Brinck, J., Briskin, M. J., Spicer, A. P., Heldin, P. Expression of human hyaluronan synthases in response to external stimuli. Biochem. J. 348 Pt 1, 29-35, 2000.
- Wang, H. S.,Tung, W.H., Tang, K.T., Wong, Y.K., Huang, G.J., Wu, J.C., Guo, Y.J., Chen, C.C. TGF-beta induced hyaluronan synthesis in orbital fibroblasts involves protein kinase C betaII activation in vitro. J. Cell. Biochem. 95, 256-267, 2005.
- Saavalainen, K.,Pasonen-Seppänen, S., Dunlop, T.W., Tammi, R., Tammi, M.I., Carlberg, C. The human hyaluronan synthase 2 gene is a primary retinoic acid and epidermal growth factor responding gene. J. Biol. Chem., 280, 14636-14644, 2005.
- Goentzel, B. J., Weigel, P. H., Steinberg, R. A. Recombinant human hyaluronan synthase 3 is phosphorylated in mammalian cells. Biochem. J., 396, 347-354, 2006.
- Bourguignon, L. Y., Gilad, E., Peyrollier, K. Heregulin-mediated ErbB2-ERK signaling activates hyaluronan synthases leading to CD44-dependent ovarian tumor cell growth and migration. J. Biol. Chem. 282, 19426-19441, 2007.
- Jokela, T. A.,Lindgren, A., Rilla, K., Maytin, E., Hascall, V.C., Tammi, R.H., Tammi, M.I. Induction of hyaluronan cables and monocyte adherence in epidermal keratinocytes. Connect. Tissue Res. 49, 115-119, 2008.
- Kultti, A.,Pasonen-Seppänen, S., Jauhiainen, M., Rilla, K.J., Kärnä, R., Pyöriä, E., Tammi, R.H., Tammi, M.I.. 4-Methylumbelliferone inhibits hyaluronan synthesis by depletion of cellular UDP-glucuronic acid and downregulation of hyaluronan synthase 2 and 3. Exp. Cell Res., 315, 1914-1923, 2009.
- Monslow, J., Sato, N., Mack, J. A., Maytin, E. V. Wounding-induced synthesis of hyaluronic acid in organotypic epidermal cultures requires the release of heparin-binding egf and activation of the EGFR. J. Invest. Dermatol. 129, 2046-2058, 2009.
- Kultti, A.Rilla, K., Tiihonen, R., Spicer, A.P., Tammi, R.H., Tammi, M.I.. Hyaluronan synthesis induces microvillus-like cell surface protrusions. J. Biol. Chem. 281, 15821-15828, 2006.
- Sakr, S. W.,Potter-Perigo, S., Kinsella, M.G., Johnson, P.Y., Braun, K.R., Goueffic, Y., Rosenfeld, M.E., Wight, T.N. Hyaluronan accumulation is elevated in cultures of low density lipoprotein receptor-deficient cells and is altered by manipulation of cell cholesterol content. J. Biol. Chem. 283, 36195-36204, 2008.
- Ren, J., Hascall, V. C., Wang, A. Cyclin D3 mediates synthesis of a hyaluronan matrix that is adhesive for monocytes in mesangial cells stimulated to divide in hyperglycemic medium. J. Biol. Chem. 284, 16621-16632, 2009.
- Goldberg, R. L., Toole, B. P. Pericellular coat of chick embryo chondrocytes: structural role of hyaluronate. J. Cell Biol. 99, 2114-2122, 1984.
- Knudson, C. B. Hyaluronan receptor-directed assembly of chondrocyte pericellular matrix. J. Cell Biol. 120, 825-834, 1993.
- Lukoschek, M., Addicks, K. Histologic, morphometric study of the human synovial membrane. Z. Orthop. Ihre. Grenzgeb. 129, 136-140, 1991.
- Bernanke, D. H., Markwald, R. R. Effects of hyaluronic acid on cardiac cushion tissue cells in collagen matrix cultures. Tex. Rep. Biol. Med. 39, 271-285, 1979.
- Bakkers, J.,Kramer, C., Pothof, J., Quaedvlieg, N.E., Spaink, H.P., Hammerschmidt, M. Has2 is required upstream of Rac1 to govern dorsal migration of lateral cells during zebrafish gastrulation. Development 131, 525-537, 2004.
- Bono, P.,Cordero, E., Johnson, K., Borowsky, M., Ramesh, V., Jacks, T., Hynes, R.O. Layilin, a cell surface hyaluronan receptor, interacts with merlin and radixin. Exp. Cell Res. 308, 177-187, 2005.
- Lange, K. Role of microvillar cell surfaces in the regulation of glucose uptake and organization of energy metabolism. Am. J. Physiol., Cell Physiol. 282, C1-26, 2002.
- Kemppainen, T.Tammi, R., Tammi, M., Agren, U., Julkunen, R., Böhm, J., Uusitupa, M., Kosma, V.M. Elevated expression of hyaluronan and its CD44 receptor in the duodenal mucosa of coeliac patients. Histopathology 46, 64-72, 2005.
- Tammi, R., Ripellino, J. A., Margolis, R. U., Maibach, H. I., Tammi, M. Hyaluronate accumulation in human epidermis treated with retinoic acid in skin organ culture. J. Invest. Dermatol. 92, 326-332, 1989.
- Zheng, J. M., Chin, W. C., Khijniak, E., Khijniak, E., Jr , Pollack, G. H. Surfaces and interfacial water: evidence that hydrophilic surfaces have long-range impact. Adv. Colloid Interface Sci. 127, 19-27, 2006.
- McBride, W. H., Bard, J. B. Hyaluronidase-sensitive halos around adherent cells. Their role in blocking lymphocyte-mediated cytolysis. J. Exp. Med. 149, 507-515, 1979.
- Mytar, B.Wołoszyn, M., Szatanek, R., Baj-Krzyworzeka, M., Siedlar, M., Ruggiero, I., Wieckiewicz, J., Zembala, M. Tumor cell-induced deactivation of human monocytes. J. Leukoc. Biol. 74, 1094-1101, 2003.
- Draffin, J. E., McFarlane, S., Hill, A., Johnston, P. G., Waugh, D. J. CD44 potentiates the adherence of metastatic prostate and breast cancer cells to bone marrow endothelial cells. Cancer Res. 64, 5702-5711, 2004.
- Day, A. J., de la Motte, C. A. Hyaluronan cross-linking: a protective mechanism in inflammation? Trends Immunol. 26, 637-643, 2005.
- Jameson, J. M., Cauvi, G., Sharp, L. L., Witherden, D. A., Havran, W. L. Gammadelta T cell-induced hyaluronan production by epithelial cells regulates inflammation. J. Exp. Med. 201, 1269-1279, 2005.
- Zoltan-Jones, A., Huang, L., Ghatak, S., Toole, B. P. Elevated hyaluronan production induces mesenchymal and transformed properties in epithelial cells. J. Biol. Chem. 278, 45801-45810, 2003.
- Li, Y., Heldin, P. Hyaluronan production increases the malignant properties of mesothelioma cells. Br. J. Cancer 85, 600-67, 2001.
- Li, Y., Li, L., Brown, T. J., Heldin, P. Silencing of hyaluronan synthase 2 suppresses the malignant phenotype of invasive breast cancer cells. Int. J. Cancer 120, 2557-2567, 2007.
- Hamada, J., Ren, J., Hosokawa, M. Malignant progression of a weakly malignant rat mammary tumor cell line, ER-1, by tumor microenvironmental factors. Med. Electron. Microsc. 32, 87-93, 1999.
- Zu, Y., Sidhu, G. S., Wieczorek, R., Cassai, N. D. Ultrastructurally "invasive" microvilli in an aggressively metastasizing biphasic malignant mesothelioma. Ultrastruct. Pathol. 26, 403-409, 2002.
- Koyama, H., Hibi, T., Isogai, Z., Yoneda, M., Fujimori, M., Amano, J., Kawakubo, M., Kannagi, R., Kimata, K., Taniguchi, S., Itano, N.Hyperproduction of hyaluronan in neu-induced mammary tumor accelerates angiogenesis through stromal cell recruitment: possible involvement of versican/PG-M. Am. J. Pathol. 170, 1086-1099, 2007.
- Liu, N., Gao, F., Han, Z., Xu, X., Underhill, C.B., Zhang, L. Hyaluronan synthase 3 overexpression promotes the growth of TSU prostate cancer cells. Cancer Res. 61, 5207-5214, 2001.
- Udabage, L.,Brownlee, G.R., Waltham, M., Blick, T., Walker, E.C., Heldin, P., Nilsson, S.K., Thompson, E.W., Brown, T.J. Antisense-mediated suppression of hyaluronan synthase 2 inhibits the tumorigenesis and progression of breast cancer. Cancer Res. 65, 6139-6150, 2005.
- Simpson, M. A., Wilson, C. M., McCarthy, J. B. Inhibition of prostate tumor cell hyaluronan synthesis impairs subcutaneous growth and vascularization in immunocompromised mice. Am. J. Pathol. 161, 849-857, 2002.
- Dube, B., Lüke, H. J., Aumailley, M., Prehm, P. Hyaluronan reduces migration and proliferation in CHO cells. Biochim. Biophys. Acta 1538, 283-289, 2001.
- Brinck, J., Heldin, P. Expression of recombinant hyaluronan synthase, (HAS) isoforms in CHO cells reduces cell migration and cell surface CD44. Exp. Cell Res. 252, 342-351, 1999.
- Itano, N.,Sawai, T., Atsumi, F., Miyaishi, O., Taniguchi, S., Kannagi, R., Hamaguchi, M., Kimata, K. Selective expression and functional characteristics of three mammalian hyaluronan synthases in oncogenic malignant transformation. J. Biol. Chem. 279, 18679-18687, 2004.
- Kim, Y.,Lee, Y.S., Choe, J., Lee, H., Kim, Y.M., Jeoung, D. CD44-epidermal growth factor receptor interaction mediates hyaluronic acid-promoted cell motility by activating protein kinase C signaling involving Akt, Rac1, Phox, reactive oxygen species, focal adhesion kinase, and MMP-2. J. Biol. Chem. 283, 22513-22528, 2008.
- Li, L., Heldin, C. H., Heldin, P. Inhibition of platelet-derived growth factor-BB-induced receptor activation and fibroblast migration by hyaluronan activation of CD44. J. Biol. Chem. 281, 26512-26519, 2006.
- Palyi-Krekk, Z., Barok, M., Kovács, T., Saya, H., Nagano, O., Szöllosi, J., Nagy, P. EGFR and ErbB2 are functionally coupled to CD44 and regulate shedding, internalization and motogenic effect of CD44. Cancer Lett. 263, 231-242, 2008.
- Lange, K., Gartzke, J. Microvillar cell surface as a natural defense system against xenobiotics: a new interpretation of multidrug resistance. Am. J. Physiol., Cell Physiol. 281, C369-85, 2001.









