
氏名:Paraskevi Heldin
Heldin博士は、Uppsala 大学において、1979年に理学士号を、そして1987年にはタンパク質のリン酸化調節に関する研究で医学及び生理化学のPh.D.を取得した。学位取得後は、研究の方向を転換し、Uppsala 大学のProfessor T. C. Laurent の指導の下でヒアルロン酸の生物学に取り組むようになった。1987年から2000年までは、Department of Medical and Physiological Chemistry の様々な役職を経験し、2001年からは、Department of Medical Biochemistry and Microbiologyの非常勤准教授、そしてスウェーデンUppsala、Ludwig Institute for Cancer Research のMatrix Biology Group のグループ長および准研究員として研究を続けている。Heldin博士の研究は、いかにしてヒアルロン酸-CD44複合体が、悪性細胞の増殖および侵入行動を調整する上で、PDGFと TGFβ増殖因子の受容体と相互作用するかの機序の解明が中心となっている。
ヒアルロン酸は、組織と体液にみられるグリコサミノグリカンの1種で、組織の形成と恒常性に重要な役割を担っている。自然界においてもっとも吸湿性の高い分子の一つであり、絡み合って粘弾性網目構造を形成し、間質を水性および粘性区画へと配分することができる。ヒアルロン酸は、間葉系幹細胞や造血系幹細胞のみならず間葉系細胞、内皮細胞および免疫細胞によって合成される 1-3。その存在量と分子サイズは、ヒアルロン酸を合成 (HAS1、2および 3)および分解(HYAL1、2 および 3; PH-20)する酵素の活性の変化によって違ってくる(このシリーズのほかの論文および 4-7を参照)。ヒアルロン酸はまた、CD44とRHAMMなどのヒアルロン酸結合タンパクであるヒアルアドヘリンによって捕捉および細胞内移行される(このシリーズのほかの論文および 8を参照)。ヒアルロン酸分子は、その合成と共に、細胞外マトリックス(ECM)へと押し出されるが、同時に細胞内にも存在する 9 (Fig. 1A)。
ヒアルロン酸分子は、ヒアルロン酸分子同士、もしくはヒアルアドヘリンと相互作用することで、細胞の運動、増殖、接着および/あるいは活性化を促す刺激としての機能を果たすことができるさまざまな構造を形成する(HA Todayの論文および 10)。細胞外と細胞内のヒアルロン酸のバランスを制御する機序や細胞内ヒアルロン酸の機能は不明である。胚の発生過程や炎症・癌化などのある種の病態における急速な組織修復において放出される増殖因子やサイトカイン活性の亢進にともなってヒアルロン酸の生合成レベルが上昇していることがしばしば認められる。ヒアルロン酸レベルは、中皮腫や乳癌のような侵襲性の高い癌や関節リウマチなどの慢性炎症において診断上あるいは予後を判断する上でも重要な因子である。
本総説では、増殖因子によるヒアルロン酸生合成の制御とその生理学的および病態生理学的意義に関する最近の研究成果を中心に述べたい。
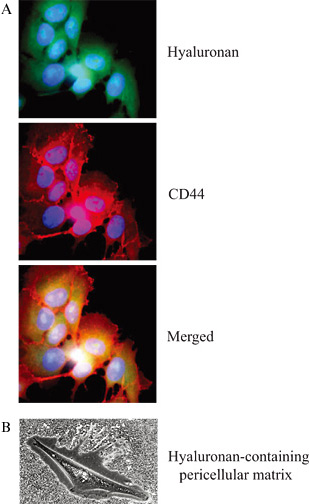
Fig. 1 ヒアルロン酸およびCD44局在化の検知
(A) ビオチン化ヒアルロン酸結合プローブを使った乳癌細胞の染色による、細胞内ヒアルロン酸(緑)の検出。細胞膜のCD44染色は、Hermes-3抗体で行った(赤);写真提供:Angelos Heldin。(B)ホルマリン固定赤血球による、正常なヒト中皮細胞を囲む、細胞周囲ヒアルロン酸の検出。
慢性炎症が細胞の癌化を促進させ、腫瘍及び宿主からなる微小環境が腫瘍の進行に関与していることは多くの研究で示唆されている 11。腫瘍形成のすべての段階において、内皮細胞、周皮細胞、線維芽細胞、中皮細胞、免疫細胞などの間質細胞が「活性化」され、増殖因子や細胞外マトリックス(ECM)成分を放出する。こうしたすべての局面において、高分子や中分子のヒアルロン酸のみならず低分子のヒアルロン酸の含量が増加する。ヒアルロン酸は、そのサイズと結合タンパク質の性質に依存して異なる機能を発揮することも明確になってきた(HA Todayの論文および 12 )。起源も悪性度も異なる腫瘍組織サンプルを用いた免疫組織学的研究において、間質組織中のヒアルロン酸レベルが腫瘍の侵襲性と相関することが明らかになっている 13, 14。腫瘍の悪性化過程における間質組織中ヒアルロン酸の機能的な重要性に関しては、Koyamaらが、ヒアルロン酸がHAS2の過剰発現により蓄積することが知られている乳癌の組織特異的遺伝子導入マウスを用いて研究している。このモデルでは、ヒアルロン酸の過剰発現が、腫瘍悪性化の加速、血管新生とリンパ管形成の促進そして間質細胞の動員を招いた 15, 16。
おそらく、乳癌細胞で合成されたヒアルロン酸は、CD44などの腫瘍細胞に発現したヒアルアドヘリンと相互作用することで細胞内シグナル伝達現象を引き起こし、乳癌細胞の悪性度に影響を及ぼしたと考えられる。また、微小環境のヒアルロン酸は、細胞遊走が可能な粘弾性多孔質の網目構造を作り出す能力と間質細胞に発現したヒアルアドヘリンとの相互作用の両方を通じて、間葉系幹細胞、内皮細胞、免疫細胞といった様々なタイプの細胞の動員と活性化を仲介している可能性がある。また、動員された間質細胞は、増殖因子やサイトカインを分泌すると考えられ、分泌された増殖因子やサイトカインがオートクラインおよび/もしくはパラクライン様式で、間質細胞と腫瘍細胞のヒアルロン酸合成を増加させ、その結果として細胞の増殖、遊走、分化そして転写活性化に影響を及ぼすようなシグナル伝達現象を誘発すると思われる。
中皮細胞などの間質細胞周囲のヒアルロン酸を含有する細胞周囲マトリックス(被膜とも言う) (Fig. 1B)は、血小板由来増殖因子(PDGF)-BB や上皮細胞増殖因子(EGF)といった、増殖因子に反応して形成される。しかしながら、TGF-βはそれほど効率的に被膜の形成を惹起しないことから、被膜形成に関して、増殖因子は異なる調節的役割を担っていると考えられる。この被膜は、新たに合成され細胞外領域へと押し出されたヒアルロン酸から成っているが、このヒアルロン酸は中皮細胞 17の場合にはシンターゼを介して細胞にまだ繋留されており、また、軟骨細胞の場合には細胞表面のCD44に結合している(本シリーズKnudson W./ Knudson C.による総説および 18)。こうしたヒアルロニダーゼ感受性マトリックスは、正常細胞 19や腫瘍細胞 20の周囲で防護壁としての機能を果たすと考えられる。
ここで興味深い点は、このような被膜がin vivoで存在するのかどうかである。もし存在するとすれば、これらの被膜が腫瘍形成の過程で、どのように“ニッチ”を形成、促進あるいは保護して癌化に貢献するのかである。 ここで注目すべきは、上皮間質転換(EMT)を促すことで知られる肝細胞増殖因子(HGF)とβ-カテニンが、ヒアルロン酸生成と細胞周囲マトリックスの形成を促進することである 21。接着分子の除去、細胞の分離、増殖そして遊走を引き起こすことにより、ヒアルロン酸含有の細胞周囲マトリックスの形成がEMTの誘導に関与しているかどうかを検討することは興味深い。被膜形成の機序とその機能的意義に関するさらなる研究が求められる。B. Toole や共同研究者たちは1970年代から胚発生や腫瘍形成といった生理的および病的な状態における細胞および/もしくは組織のヒアルロン酸の重要性( 22-25 および本稿参考文献)に関する研究を実施し、膨大なデータを蓄積しており、細胞挙動におけるヒアルロン酸の複雑な生物学的役割を徐々に明らかにしつつある。
間質組織や隣接した癌細胞が自身の受容体活性化を介して遊離するPDGFや腫瘍増殖因子(TGF)-βのような増殖因子は、マトリックス分子の産生を増大させ、このことが細胞表面接着受容体の活性化を通して情報伝達を増強することにつながる。増殖因子に反応した間質組織中のヒアルロン酸の蓄積が、CD44などの細胞表面ヒアルアドヘリンとの結合を通して増殖因子受容体の活性化状態を調節しているように見える 8, 26-28。たとえば、ヒアルロン酸で活性化されたCD44は、PDGF-BBが誘導したPDGF β-受容体の活性化やPDGF-BB-が仲介した線維芽細胞の遊走を抑制することを我々は見出した。CD44-ヒアルロン酸複合体が、PDGFβ-受容体にチロシンホスファターゼを動員することで、その活性を抑制するという可能性が高い 28。ヒアルロン酸活性化CD44、PDGFβ受容体そしてPDGF-BBとの間のこのような相互関係は、ヒアルロン酸とPDGFがin vivoで共存し、線維芽細胞の運動性を制御するために緊密に共同する創傷治癒の過程において、生理学的に適切であるかもしれない。重要な点としては、CD44が条件的に抑制されている皮膚を持ったマウスには、ヒアルロン酸代謝障害と、創傷治癒の遅延がみられる 29。
また、不死化した腎近位尿細管内皮細胞(HK-2)へのヒアルロン酸による刺激は、TGF- β情報伝達を弱める 30。この他にも、受容体チロシンキナーゼの活性を抑制することのできる細胞外分子の受容体が挙げられる。例えば、インテグリンα1β1は、T細胞タンパク質チロシンホスファターゼTC-PTPの活性化を通して、EGF受容体の活性を低下させる 31。CD44は細胞外からの刺激に反応し、腫瘍抑制因子として機能することもできるが、増殖および侵襲促進分子としての役割を果たすことの方が多い。CD44の作用の中でいくつかはヒアルロン酸依存であるが、ヒアルロン酸非依存のものもある 26-28, 32。内因的に産生されたヒアルロン酸は、ErbB2やPDGF受容体など異なる増殖因子の受容体を活性化させ、それによって癌細胞の増殖と多剤耐性に寄与する 24, 33, 34。このように、増殖因子受容体へリガンドが結合するだけで細胞機能を制御するという考え方は単純すぎると思われる。より多くの場合には、増殖因子受容体はCD44もしくは他の細胞表面接着分子受容体と協調して相乗的に働き、個々の細胞タイプに応じて細胞の運命を制御している。
血管新生とは、既存の脈管構造から新しい血管が形成されることである。生理的な血管新生は胚発生、創傷治癒や女性生殖周期の過程に不可欠であり、正常な血管が新たに形成されるのが特徴である。しかしながら、癌や糖尿病性網膜症などといった、いくつかの病態では、膨大な量の血管が体系化されずに形成される。こうした非常に複雑な過程は、線維芽細胞増殖因子(FGF)-2、血管内皮増殖因子(VEGF)そしてPDGFなどいくつかの因子の調和によって制御されている 35-37。また、血管新生の過程では、基底膜とECM構成成分あるいはその断片が重要な役割を果たしている 38, 39。
炎症反応時には、TGF-βあるいは酸化反応やニトロ化反応を誘導する分子などに反応してHYALの活性が上昇しさまざまなサイズのヒアルロン酸の蓄積が見られる 1, 40。これまでの研究で短いヒアルロン酸断片がCD44やRHAMMに結合することにより血管新生を促すことが明らかになっている 39, 41-43。ヒアルロン酸断片とCD44あるいはRHAMMの複合体がどのように情報を伝達して血管新生を誘導するのかあまりよくわかっていないが、おそらく様々な増殖因子の受容体が関連していると思われる。
ヒアルロン酸12糖(HA12)あるいは既知の血管新生因子であるFGF-2でマウスの脳微小血管内皮細胞を刺激後の遺伝子発現プロファイルの比較が、マイクロアレイを用いて最近実施された 44。その解析の結果、HA12あるいはFGF-2による刺激後には、37の共通遺伝子がこれら2つの因子により亢進されたことが明らかになった。HA12によってのみ亢進された遺伝子は56、FGF-2よってのみ亢進された遺伝子は83あった。HA12とEGF-2の両方で亢進された遺伝子の中には、オルニチンデカルボキシラーゼ(Odc)とオルニチンデカルボキシラーゼ・アンチザイム阻害タンパク(Oazi)があった。この協調的誘導は、おそらく活性化Odcタンパク質維持を通してポリアミン誘導内皮細胞増殖とエンドスタチン抑制が起こることから、血管新生制御の中心であると言える。ヒアルロン酸オリゴ糖によって単独亢進される遺伝子の中には、増殖制御癌遺伝子1(Gro1)(ケモカインリガンド1、CXCL1)もあった。Gro1/CXCL1は、血管新生を促すケモカイン受容体CXCR2を活性化する。
HA12のCD44への結合は、CXCR2の活性化とそれに続く内皮細胞分化を引き起こすために不可欠であった。興味深いことに、FGF-2とHA12のどちらも内皮細胞培養で管形成が活発に行われている間HAS2の転写発現を誘導する。つまり、局所ヒアルロニダーゼの作用によるヒアルロン酸の分解で、活性化した内皮細胞がオートクライン様式で分化するように働くと考えられる。このような状況においては、Neu-起因乳癌におけるHAS2の過剰発現が、おそらくは血管新生促進因子であるFGF-2そして間質由来因子(SDF)-1α/ CXCL12を誘導することにより、腫瘍の血管新生を促すということを指摘しておきたい 15。したがって、腫瘍の血管新生の増加には、おそらく血管新生促進因子とヒアルロン酸断片などのマトリックス分子の両方が関与すると考えられる。
哺乳類HASとHYALは、1990年代にクローン化されたが、その制御や機能そして生化学については、ほとんどわかっていない(HA Todayの関連論文および本稿参考文献を参照)。ヒアルロン酸が色々な面で炎症や腫瘍形成に関与しているとすると、細胞ヒアルロン酸レベルを制御するためにHASあるいはHYALの発現を変えるのは疾患の進展を制御する一つの手段となる。我々を含め、いくつかの研究室が、正常および変異細胞株や動物モデルを用いてHASやHYALの発現を変えた時の影響を研究している。
形質移入して安定化したCHO細胞 45とCOS-1あるいは3Y1細胞 46を用いて、3種類のHASアイソフォームの間の違いと、これらの細胞挙動を変える能力が研究されている。我々のCHO細胞研究では、3つのHAS形質移入体の触媒作用の違いが明らかになった;HAS1を形質移入したCHOクローンは、HAS2とHAS3形質移入体よりも4分の1と10分の1のヒアルロン酸合成能をそれぞれ示した。おそらくHAS1転写物が短命か、低レベルで発現するのではないか。そう考えると、検知できるHAS1形質移入細胞が少ないことの説明がつく。しかし、HAS1 mRNAはいくつかの(正常なヒト中皮細胞を除く 47)正常な細胞と乳癌細胞(HAS2やHAS3遺伝子の10分の1の発現レベル 48)にわずかにしか発現しないものの、HAS1の過剰発現とそのスプライシングバリアントは、予後不良の多発性骨髄腫患者に検出されている 49。特筆すべきは、癌遺伝子v-srcおよび/もしくはv-fosに変異をもつ悪性の3Y1線維芽細胞においてHAS1の転写が増大していることである 50。
HAS1プロモーターには、CREB、NFκB、IRF-1とp53といった、その部位に突然変異や異常発現があると腫瘍細胞の悪性形質を増加させる転写制御因子に対する結合部位が存在する。これらの結果や上述の発見は、HAS1遺伝子が細胞増殖に関与しており、その発現が細胞型と生理的状態によっては変異により亢進するという仮説を支持するものである。ここで注目すべきは、HAS1Vaバリアントは細胞外ヒアルロン酸生成と、そしてHAS1Vbは細胞内ヒアルロン酸生成とがそれぞれ相関していることである 49。最近ではRilla等 51が、GFP-HAS2とHAS3の細胞膜局在が、その酵素活性と関連しており、HAS2とHAS3が表皮角化細胞株REKの細胞質内に大量に蓄積していること見出した。我々も、COS-1細胞においてFlag-HAS2の過剰発現が細胞内および細胞膜に分布しているのを発見した(Fig. 2);この分布様式は、0.5〜 4 μgの移入転写物の範囲内で起こることがわかった(未発表データ)。HAS2とHAS3の細胞内プールがこれらの細胞になぜ存在するのかはまだわかっていない。しかし、HASの安定性、細胞内移動、および細胞膜への移動は外部シグナルで制御される可能性がある。
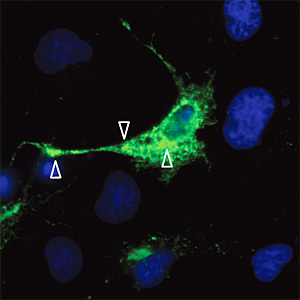
Fig. 2 一過性に形質移入したCOS細胞内のFlag標識HAS2タンパク質の局在
Flag-HAS2形質移入細胞。矢印は、細胞内および細胞膜突出におけるFlag-HAS2の局在を示している;写真提供:Aino Ruusula。
遺伝子導入CHO細胞に関するさらなる研究で、1μgヒアルロン酸/1x105細胞/24hの体内生産が、プロテオグリカンが存在しない条件でヒアルロン酸リッチマトリックスが形成される上での最低限度であることが判明した 45。ヒアルロン酸の生産量が4分の1である形質移入細胞では、ヒアルロン酸被膜を形成するために、アグリカンを加えて安定化させる必要があった。もっとも興味深かったのは、新たに生成されたヒアルロン酸のより高い濃度において、ヒアルロン酸産生と細胞遊走あるいはCD44発現の間に逆相関が見られたことであった。また、3種類のHASタンパク質のそれぞれが細胞内で高分子ヒアルロン酸分子(3.9 x 106 Daより大きい)を生成したことも興味深い。しかしながら、無細胞系では、HAS2タンパク質は長鎖を生成 (3.9 x 106 Da以上)する一方、HAS3は色々なサイズのヒアルロン酸鎖(0.12 - 1x106 Da)を、HAS1にいたっては、さらに小さいヒアルロン酸鎖(平均0.12 x 106 Da)を生成した。つまり、膜画分には、インタクトな細胞に存在する補助的調節成分が含まれていないことが示唆される 45。これについて板野らは、HAS3タンパク質は、HAS1とHAS2よりも短いヒアルロン酸鎖を生成すると報告しているが52、これらの研究は異なる種類の細胞を使用していることを頭に入れておきたい。従って、ヒアルロン酸鎖の長さは、HASの触媒活性に影響を及ぼしてヒアルロン酸の鎖長停止を決定するかも知れない調節たんぱく質の存在の違いによる細胞および生理条件に、特異的な様式で制御されていることが考えられる。
ある種の上皮性悪性腫瘍ではヒアルロン酸が増加しており、腫瘍細胞自身あるいは間質細胞でHASの活性が亢進していることが示唆される。しかしながら、ある種の腫瘍細胞株をin vitroで培養した時の培地中やその細胞層においてヒアルロン酸レベルが低下していることも見出されている。例えば、中皮細胞は大量のヒアルロン酸を合成し、高レベルで3つのHASアイソフォームのすべてを発現する一方で、中皮腫細胞株のいくつかは、微量のヒアルロン酸しか産生しないうえに、HASアイソフォームの全部は発現しない。例としてあげると、Mero-14中皮腫細胞株は、検知できる量のヒアルロン酸を生成しないHAS3転写体を発現する 47, 53。中皮細胞の変異においてどのような機序でヒアルロン酸の生成が消失するのかは解明されていない;細胞形質転換におけるHAS遺伝子の突然変異の機序も同様に不明である。上皮系中皮腫の約20%がヒアルロン酸を生成すること、腫瘍量に相関して血清ヒアルロン酸レベルが上昇することから、中皮腫細胞の悪性度に対するヒアルロン酸の産生量の影響を研究してみた。そこからわかったのは、HAS2 cDNAの形質移入後のヒアルロン酸過剰産生によって、その中皮細胞の悪性度が高まることであった。HAS2形質移入細胞は、対照とした類上皮形質移入細胞と比較して、線維芽細胞様の遊走性表現型を獲得し、ヒアルロン酸リッチ細胞周囲マトリックスに囲まれた。
さらに、ヒアルロン酸を産生しない中皮腫に比べ、ヒアルロン酸を産生する中皮腫では、CD44の発現が上昇し、固体の基質なしに増殖する能力が高まっている 54。これらの研究の結果では、中皮腫の局所浸潤行動が、そのヒアルロン酸産生能力と相関していることが示唆される。腫瘍進展におけるHAS2とHYAL1の重要性は、in vitro と in vivo両方で結腸癌、乳癌、前立腺癌のモデルを使って研究された 55-57。ここで浮かび上がってきたのは、HAS2が過剰発現している場合、対照に比べ、近交系ラットで継代可能な腫瘍がより早く形成されることであった。これとは対照的に、HYAL1が過剰発現した場合、in vitro と in vivoにおいて結腸腫瘍細胞の増殖速度が抑制される 55。これはヒアルロン酸量が高い結腸直腸癌の患者が予後不良であることと一致している。乳癌を移植した動物(異種移植モデル)にヒアルロニダーゼを静脈内注射すると腫瘍サイズ、ヒアルロン酸量、CD44バリアント発現が低下したことから、ヒアルロニダーゼが腫瘍抑制作用を持つことが示された 56。重要なことは、HAS2単独の過剰発現と比較して、HAS2とHYAL1の両方を同時に過剰発現した場合、増殖と転移の両方を亢進して前立腺腫瘍細胞の腫瘍形成能を高めたことである 57, 58。
この結果から、細胞の種類と濃度に依存しているであろうHYAL1の腫瘍促進作用と腫瘍抑制作用がより一層説明できるようになると思われる 59。腫瘍形成時にHASとHYALの両方が協調する機序を調節するシグナルを明らかにできる可能性が高まるはずである。
さらに、乳癌細胞の悪性形質を維持するためのHAS2作用の重要性については、アンチセンス阻害もしくは特異的なsiRNAを用いてHAS2タンパク質だけを発現停止させる方法で検討されている。乳癌細胞のHAS2発現を抑制した場合、その運動性と悪性形質が大きく低下することから、通常のHAS2発現レベルで乳癌の悪性度が亢進していると思われる 48, 60。注目すべきは、ヒアルロン酸を細胞に添加してもHAS2の発現停止で見られる表現型が回復しなかったことから、腫瘍が生成したヒアルロン酸は細胞内で作用するか、あるいは他の機能を持っていることが示唆される 24。しかしながら、他の腫瘍細胞を培養して培地にヒアルロン酸を添加するとヒアルロン酸受容体であるCD44を介して細胞内情報伝達が活性化された 27。外因性および内因性のヒアルロン酸が細胞の機能にどのような影響を及ぼすかは依然として不明であり、この点を解明することが今後の課題である。
いつ、どこでヒアルロン酸が生成されるかに関する知識は増えているものの、その詳細な制御機序はまだ解明されていない。ヒアルロン酸の生成およびプロセッシングに関与する酵素は、間葉系由来の様々なタイプの正常細胞の間、正常細胞とその変異細胞の間、あるいは悪性度が異なる腫瘍細胞の間で様々な発現パターンを示す。生理機能を調整する不可欠な構成要素としてアイソフォームが存在し、各アイソフォームは様々な細胞タイプで特徴的なヒアルロン酸のパターン決定に関わっていると思われる。ヒト包皮線維芽細胞や中皮細胞といった間葉細胞は、ヒアルロン酸の産生量に関してPDGF-BB、ホルボール12ミリステート13アセテート(PMA)、TGF-βなどの細胞外調節シグナルに対する反応性に違いを示す;ヒアルロン酸の生成を誘導するPMAの作用はPDGF-BBよりも強く、TGF-βはやや効率悪くヒアルロン酸の産生を誘導する 47, 61。PMAとPDGF-BBは主としてHAS2遺伝子の誘導を介して、中皮細胞によるヒアルロン酸生成に対して促進作用を発揮する 47。
PDGF-BBもしくはTGF-βの刺激活性が高分子量ヒアルロン酸鎖の生成を誘導する一方で、PMAは様々なサイズのヒアルロン酸の産生を誘導する 47。HAS2アイソフォームが高分子量のヒアルロン酸を生成し 45、PMAとPDGF-BBの作用発揮においてPKCが重要な役割を担っているということから 62、異なった外部からのシグナルが、ヒアルロン酸の量とサイズの両方をの制御することが示唆される。これはおそらく既存のHAS分子の活性化を介して起こると考えられ、新しい酵素分子の誘導に加えて制御のための直接的なリン酸化あるいは2次的にHASたんぱく質を活性化する他の成分のリン酸化に関与していると思われる。最近の研究では、HAS3がリン酸化され、ヘレグリンによる刺激が3つのHASアイソフォームのそれぞれのリン酸化を誘発することがわかっている 63, 64。リン酸化とユビキチン化といったHASアイソフォームの翻訳後の修飾が基礎にある生理学的重要性と制御機序、そして安定性と活性に対するこれらの影響の解明は今始まったばかりだ。
脊椎動物のHAS遺伝子のプロモーター領域を分析した結果、HAS1とHAS3遺伝子に対するよりも、HAS2に対してより厳しい制御領域の管理をしていることが明らかになった;HAS2の近位プロモーターがNF- κB、STATそして CREBのための転写因子結合部位を所有しているためである 65, 66。我々をはじめとするいくつかの研究室は、HASとHYAL遺伝子それぞれの発現制御に関わる機序を研究した。実験システムと、使用した細胞型、増殖因子そしてサイトカインも含めた条件がそれぞれ異なっているため、各研究を比較するのは難しい。しかし、一般的な見解として浮かび上がってきたのは、異なる細胞型は、HASとHYAL遺伝子それぞれがさまざまなレベルであり、増殖因子とサイトカインに対して違った反応をするということである。間葉由来の細胞におけるヒアルロン酸合成の制御の概要はTable 1にまとめた。ヒト胸膜の正常中皮細胞は3種類のHAS転写物すべてを、高レベルで恒常的に発現する 47。他の細胞型ではHAS1転写物が恒常的に検知されることはほとんどないものの、研究対象となったほとんどの細胞においては、刺激に対して強く亢進された。
また、滑膜から分離された細胞の研究からは、HAS1遺伝子には関節リウマチにおけるヒアルロン酸の異常蓄積の要因となる責任作用を持っていることが明らかになった。これは、いくつかの炎症促進性の刺激に強く反応する唯一のHAS遺伝子であり、薬物治療によって遮断されるからである 67, 68。研究対象となったすべての細胞には、HAS2 mRNAの高いレベルでの恒常的発現が見られた。成長因子によるHAS2遺伝子の発現誘導には大きなバラツキがみられた。PDGF-BBは、皮膚および肺の両方の線維芽細胞そして中皮細胞におけるmRNAレベルを上げる。それに対しTGF-βは、中皮細胞のHAS2発現を抑制するが、滑膜細胞での発現にはほとんど影響を及ぼさない 1, 47, 69, 70。注目すべきは、HAS2転写体が皮膚線維芽細胞、骨芽細胞そして中皮細胞のヒドロコルチゾンとデキサメタゾンに反応して、著しく抑制されることである 47, 70。角膜実質細胞、平滑筋細胞、口腔線維芽細胞、軟骨細胞そして微小血管内皮細胞を含めた、いくつかの細胞において、HAS2 mRNAはPDGF-BBとTGF-βだけでなく、IL-1と腫瘍壊死因子(TNF)-γにも直ちに反応する。非増殖細胞においては、HAS3 mRNAのレベルは、細胞型によって大きな違いを見せたものの、刺激への反応は中等度であった(Table 1)。刺激なしあるいは刺激後の発現レベルにバラツキがあるが、皮膚の線維芽細胞ではHAS2遺伝子の発現が他のHAS分子に比べて約900倍高く、線維芽細胞のヒアルロン酸分泌の大部分はHAS2が産生していることが示唆される。
表 1 PDGF-BBとTFGβは間葉由来の細胞におけるHASおよびHYAL遺伝子を制御する

ヒアルロニダーゼは腫瘍の進展や炎症において重要であるにも関わらず、その発現と活性を調節する機序はほとんどわかっていない。いくつかの研究では、正常および腫瘍細胞においてヒアルロニダーゼは転写レベルで制御されていることが示されている 1, 69, 71, 72。ヒト皮膚線維芽細胞を用いた研究で、PDGF-BBはHYAL1のmRNAを誘導するが、通常のHYAL2 mRNAの発現やHYAL様活性には影響を及ぼさなかった 1 (Table 1)。特にTGF-βで刺激した皮膚線維芽細胞ではHYAL様活性が高まることから、TGF-βは転写レベルではなく翻訳後の段階で調節作用を発揮していることが示唆される 1。マウス肺線維芽細胞を使った研究でも、PDGF-BB には、HYAL様活性に対して刺激効果がないとしている。だが、TGF-βはこれらの細胞においてHYAL2発現を亢進するものの、HYAL1遺伝子発現には作用を示さない(Table 1) 69。その上、TNF-αや IL-1βなどの炎症促進性サイトカインは、HYAL遺伝子発現とHYAL様活性を相乗的に誘導する 71。正常及び病的な状態において、どの細胞因子および環境因子がそれぞれHYALの発現と活性を調節するのか明らかにするためにさらなる研究が必要である。
PDGFとTGF-βがHAS発現とヒアルロン酸産生を制御するための細胞内情報伝達経路についていくつかの研究がある。PDGF-BBが皮膚線維芽細胞でヒアルロン酸産生を推進する機序は、下流情報伝達分子に対する特異的阻害剤を用いて研究された。その結果、PDGF-BB依存的なヒアルロン酸生成を誘導する上で、Erk MAPキナーゼ経路とホスファチジルイノシトール-3-キナーゼ(PI3K)経路が重要だということがわかった。さらに、活性のあるNF-kB複合体が核に移動するのを抑制すると、ヒアルロン酸の生成が抑制されることから、この経路もまた重要であることが推測できる。注目すべきはPDGF-BBが誘発するヒアルロン酸生成の亢進にはSrcとp38 MAPK情報伝達経路を必要としなかった点である 1。HAS2の近位プロモーターの配列にErk MAPKとPI3Kの情報伝達の下流に位置するCREBとNF-kBの両方に共通である推定転写因子結合部位があるということも、我々の結果を裏付けている。
Smad複合体の活性化と同様に、TGF-βはErk MAPK経路の誘導により、情報を伝達する。興味深いことに、TGF-βが滑膜細胞のHAS1遺伝子の発現を惹起する主要経路としてp38 MAPK情報伝達が同定されたのに対し、ErkとJNK MPAK経路はそれほどの働きをみせなかった 67。
Fig.3は、HAS遺伝子制御に関わる増殖因子受容体の下流への情報伝達をあらわしたモデルである。最近になって、培養した線維肉腫細胞を用いて細胞自身が産生する増殖因子に反応してヒアルロン酸がどのように制御されるのか研究されている 73。PDGF-BBとTGF-βからの刺激に対し、HAS1とHAS2 mRNAの転写が最も大きく亢進したことから、腫瘍細胞と間質細胞によるヒアルロン酸の生成と間質でのヒアルロン酸沈着にこれらが深く関与していると思われる。こうした経路のさらなる分析により、疾病における内因性ヒアルロン酸の生成をコントロールし、組織恒常性と細胞機能における不可欠な役割を明らかにすることができるかもしれない。
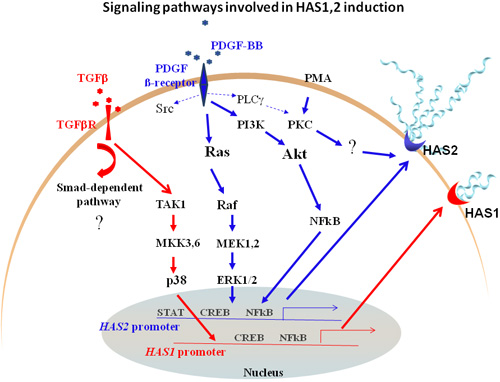
Fig. 3 HAS1およびHAS2遺伝子制御を促すPDGF β受容体とTGFβRの下流情報伝達経路
太い矢印はPDGF(青)とTGF-β(赤)がHAS1とHAS2の転写発現を調節する主要な経路を示す。ヒアルロン酸合成を媒介する次要経路は点線で示している。
近年になって、正常および病的な状態におけるヒアルロン酸の役割に関する知識は向上した。しかし、HASとHYALの産生と分解を制御する機序についてはまだわからないことが多い。こうした研究を推進できるかどうかは、遺伝子とタンパク質レベルの両方における、一つ一つのHASそしてHYALの明確な特徴づけのためのツールの開発次第である。これらの酵素は組織内のヒアルロン酸の量と大きさの制御に関連していると思われる。さらにいえば、増殖因子がヒアルロン酸合成を刺激する機序、そして増殖因子受容体との相互作用におけるCD44とRHAMMの役割も解明しなくてはならない。また最近の研究でもっとも注目すべきは、CD44 とRHAMMどちらの発現をもp53が抑制することを立証したものである 74, 75。つまり、ヒアルロン酸は、腫瘍進行の過程で異常蓄積し、受容体であるCD44とRHAMMは、p53変異体をもった腫瘍中で亢進される。ヒアルロン酸により活性化されたCD44とRHAMM複合体が、腫瘍形成において協同している可能性に追究の価値は十分にある。
謝辞
この研究に対する計り知れない貢献をしてくれた、研究室の現在そして過去のメンバーに感謝すると同時に、Carl-Henrik Heldinにはフィードバックと議論を活性化してくれたことに謝意を表したい。また、この論文を執筆するにあたり、建設的な意見を寄せてくれたBryan TooleおよびVincent Hascall両博士にも感謝の意を表したい。この研究は、Ludwig Institute for Cancer Research、The Swedish Cancer Foundation、Uppsala University、Wenner-Gren Foundation、King Gustav V:s 80-years Foundation、Q-Medそして水谷糖質科学振興財団からの助成を受けて実施した。
最後に、スペースの都合上、多くのすばらしい研究を参照できなかったことをお詫びしたい。