Mar. 2, 2009
免疫系におけるCD44・ヒアルロン酸結合の制御と機能(2009 Vol.13, A1)
Brian Ruffell / Pauline Johnson
氏名:Brian Ruffell
Brian Ruffellは、コンドロイチン硫酸付加のCD44の機能を研究するため、2002年に大学院生としてDr. Johnsonの研究室の一員に加わった。彼はマクロファージとT細胞におけるこの翻訳後修飾の機能を調べ、そこでコンドロイチン硫酸がCD44とヒアルロン酸結合の制御において重要な役割を果たすことを発見した。Dr. Ruffellは現在University of California, San Franciscoに在籍し、癌の進行と転移における炎症の役割についての研究を続けている。
氏名:Pauline Johnson
Dr. Johnsonは、University of Dundeeで、Dr. Peter Garland とDr. Roger Cleggの指導の下で生化学博士号の取得に励んでいた頃に、表面細胞分子の機能に興味を抱くようになった。博士課程修了後の1983年、彼女はUniversity of OxfordのDr. Alan William研究室において免疫学の分野に足を踏み入れ、そこでリンパ球細胞表面抗原であるCD8の解析、クローン化を行った。1987年に白血球特異抗原CD45の機能の研究のため、Salk InstituteのDr. Ian Trowbridge研究室へと移った。ここで彼女は隣の研究室のDr. Jayne LesleyとDr. Bob Hymanの研究に影響され、細胞接着分子であるCD44に魅了されたのである。1991年、バンクーバーのUniversity of British Columbia (UBC)で自身の研究室を開設し、当初はTリンパ球CD44とCD45の分子機能の研究をしていた。Dr. Johnsonは現在UBCの教授およびInfection, Inflammation and Immunity (I3) リサーチグループのco-directorを務めており、以下のような研究を行っている:CD45による自然免疫および獲得免疫応答の制御;CD4とヒアルロン酸の相互作用が、いかに免疫応答を制御するか;CD44による白血球の接着および遊走の制御;炎症過程へのCD44の影響。
1. 緒言
1.1 ヒアルロン酸とヒアルロン酸結合タンパク質
細胞外マトリックスグリコサミノグリカンであるヒアルロン酸(以下HA)は、グルクロン酸とN-アセチルグルコサミン二糖単位の反復からなる非分岐ポリマーである。プロテオグリカンとして生成される他のグリコサミノグリカンとは異なり、HAはタンパクコアとは結合しないかわりに、細胞膜に存在する3種類のヒアルロン酸合成酵素によって合成される。合成時の細胞表面へのHA輸送は、最高約25,000までの二糖同士の結合を可能にし、通常106から107 Daにわたる分子量を持つ多糖を形成する。HA合成酵素-2ノックアウトマウスの胎生致死が示すように、HAは細胞外マトリックス(ECM)の重要な構成要素である1。HAは多くのECMおよび細胞表面タンパク質と結合している。これらHA結合性タンパク質はヒアルアドヘリンと呼ばれ、リンクタンパク質と相同性を持つHA結合領域(「リンク相同ドメイン」と呼ばれる2)を共有する。代表的なものとしてアグリカン、バーシカンそしてtumor necrosis factor alpha-stimulated gene 6 (TSG-6, 3)などがあげられる。
肝臓、脾臓そしてリンパ節には、HAエンドサイトーシス受容体(HARE)が存在するが4、これはリンク相同ドメインは有していない。リンク相同ドメインは、HAに共有結合できる血清タンパク質であるSHAP (inter alpha trypsin inhibitor heavy chain)にも存在していない5。現時点では2つの膜貫通ヒアルアドヘリンが確認されているが、その1つであるlymphatic vessel endothelial receptor-1 (LYVE-1)は、主にリンパ管内皮によって発現される6。もう1つの、より広く発現している分子であるCD44は、様々なプロセスへの関与が示唆されており、それはCD44の持つ、HA結合タンパク質としての機能に大きく依存しているといえよう7。
1.2 CD44
HAの主要な細胞表面受容体であるCD44は、免疫系内にあるほとんどの細胞に、様々な量存在している8。こうした細胞は標準型(CD44s)もしくは造血系型(CD44H)のCD44を主に発現する。他のCD44のイソ型の発現は、可変的に発現された10個のエクソンの選択的スプライシングにより可能だが、白血球に発現するCD44の総量と比較すると一般的に微量成分なので、本稿ではこれ以上言及しない。これらイソ型が存在しなくても、翻訳後修飾によりCD44の構造は高度な不均一性をもつ。CD44は、NおよびO結合型グリコシル化9およびグリコサミノグリカン付加9-11によって修飾が可能であり、これらの付加と成分は細胞によって動的に制御される12-15。CD44の糖鎖部分は赤血球の血液型抗原として16、また好中球のE-セレクチン17およびヒトの造血前駆細胞のE -およびL-セレクチンに対するリガンドとして単独で機能することができる18,19。
1.3 CD44のHAとの相互作用
CD44は、アミノ末端付近にHAと結合するリンク相同ドメインを持っている。HAとCD44のN-末端領域の共結晶のX線結晶解析では、水素結合とファン・デル・ワールス力が主である相互作用によって、リンク相同ドメインの浅溝とHAの結合が見られる20。ここで注目したいのは、CD44が2つの構造状態下で結晶化した点である:HA結合のあるものと、ないもの、である。くわえて、HAオリゴ糖の構造は、CD44に結合するとわずかに変化することである。HAが結合した状態のCD44構造では、いくつかの残基がわずかな変化をみせた、つまり、重要なアルギニン残基がHAとより密接な相互作用をするために移動した20。このことはCD44が細胞で2つの立体構造 (高および低親和状態)として存在するかもしれないという興味深い可能性をもたらし、これからリンパ系細胞にみられる、CD44の異なったHA結合状態が説明できるかもしれない21。しかしながら、現時点では、細胞でCD44の異なる立体構造が存在するのかどうかは不明であり、仮に存在したとしてもHAそのもの、もしくはCD44の翻訳後修飾といった他の要因が、CD44の特定の構造を誘発したり安定化させたりするのかも不明である。
CD44とHAの相互作用は、流体条件下では一時的ローリング相互作用、もしくは静的条件下では安定的な細胞 - 細胞、あるいは細胞 - 基質相互作用へとつながる可能性がある。白血球とHAの結合度は、CD44とHA間の複雑な多価相互作用により決定される。これは細胞表面におけるCD44 の量と密度、そして細胞に特異的な因子に規定される活性状態に依存している22。これらについては次の項に詳しく述べる。
2. 免疫系におけるCD44とHAの結合制御
HA結合に関して言えば、CD44はリンパ系細胞で3つの状態をとることができる:非結合的、誘発的(CD44 IRAW14 mAbによって)、そして構成的である23。この3つの状態は、CD44が特異的糖鎖付加もしくはグリコサミノグリカンの付加を受けることによって惹起される12。CD44の発現が一定の閾値を越えるとHA結合を一層強める。CD44の翻訳後修飾に加え、HAの提示のされかたもまた、これらの2分子がいかに相互に作用するかに影響を与える。
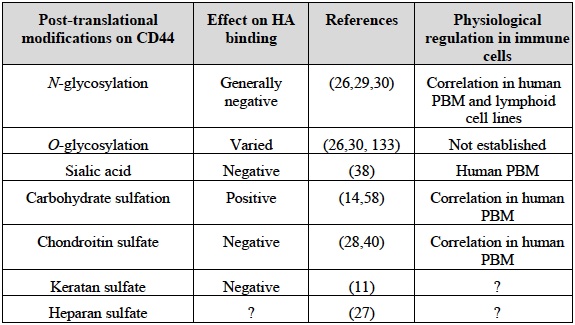
Table 1 CD44の翻訳後修飾と、そのHA結合への影響
2.1 HA結合に影響するCD44の分子変化
グリコサミノグリカンの付加を受けたCD44と同様に、N-およびO-結合型糖鎖もHA結合能力に影響力を持つ12(総説あり24-26)。グリコシル化の種類と細胞の種類により、これら修飾はプラスにもマイナスにも働く (Table 1)。CD44の5つのN-グリコシル化可能部位すべてが、アミノ末端付近のリンク相同ドメインに存在するが、O-結合型糖鎖の大半は、コンドロイチン硫酸付加が起こる27,28 CD44の膜近位幹様領域に付加されると考えられている26。細胞の種類にもよるが、一般的にN-グリコシル化の減少に伴ってHA結合は増加する。たとえば、N1およびN5グリコシル化部位に突然変異を導入すると、誘導型細胞株ではHAが常時結合するようになるが、他の細胞株では同じ部位に糖質付加を受けても、構成的HA結合を妨げられなかった12,13,29。つまり他の制御機序が、Nグリコシル化のマイナス制御作用に打ち勝つことができるということである。糖鎖末端シアル酸残基を除去するとHA結合が促進されることから13,30、CD44に及ぼすN-グリコシル化のマイナス効果の少なくとも一部は、末端シアル酸残基の存在に起因していると考えられる。いくつかのN-グリコシル化部位はHA結合溝に近接していることから、これら部位でのグリコシル化は、立体障害もしくは電荷反発によって直接HA結合を妨げるか、もしくはHA結合溝に近接しているアミノ酸残基と相互作用して、CD44のHAへの親和性を下げると考えられる。
あるいは、結合溝から離れたところに位置している糖質が、CD44と相互作用してCD44のHA結合性をさまたげる立体構造を安定化させることで、HA結合に間接的影響を及ぼす可能性もある。コンドロイチン硫酸の付加を受けたCD44もまた、HA結合にマイナス影響を及ぼすこともありうる28。ヒトCD44ではセリン180 (CD44のHA結合領域外28)に、コンドロイチン硫酸の付加が起こる。CD44立体構造に影響することで間接的に、もしくはHA結合と競合することによって(コンドロイチン硫酸修飾を受けたCD44はHA結合部位に結合することができる)直接的にHA結合を負に調節する可能性がある31,32。
CD44にHA結合性があり、そして閾値以上の濃度がある条件では、CD44発現が増加するとHA結合も増加する29。単球および活性化T細胞35でのアクチン重合をさまたげる34とHA結合が抑制されることから考えると、アクチン細胞骨格とCD44細胞質ドメインの会合により21,33、HA結合を増やす可能性がある。リン酸化ERMタンパク質との相互作用36を介して、CD44が細胞骨格と結合することがあり、これが少なくともいくつかの細胞型においてはHA結合に影響を及ぼす可能性がある34。CD44とリン酸化ERMタンパク質は、TNFαに刺激された単球では共局在し、キナーゼ抑制物質によりERMのリン酸化を防止するとHA結合を減少させる。CD44が細胞骨格と相互作用すると、クラスター化が容易になりCD44のHA結合力を高めるか、あるいはHAへの親和性を高めるCD44の立体構造の変化を誘発する可能性もある。いくつかの細胞系においてはCD44 IRAW14 mAbがHA結合を誘発することができ(これはFabフラグメントでは見られないことから)、二量化あるいは抗体に誘発された構造変化がHA結合を容易にすることを示唆している。Fig. 1は、HAへのCD44の結合を制御している可能性のある様々な機序を例示している。これらの機序は単独あるいは組み合わせでおこり、細胞あるいは細胞系の活性状態にも依存する。次の課題は、生理学的条件下では、どの機序が惹起されているかを特定することである。
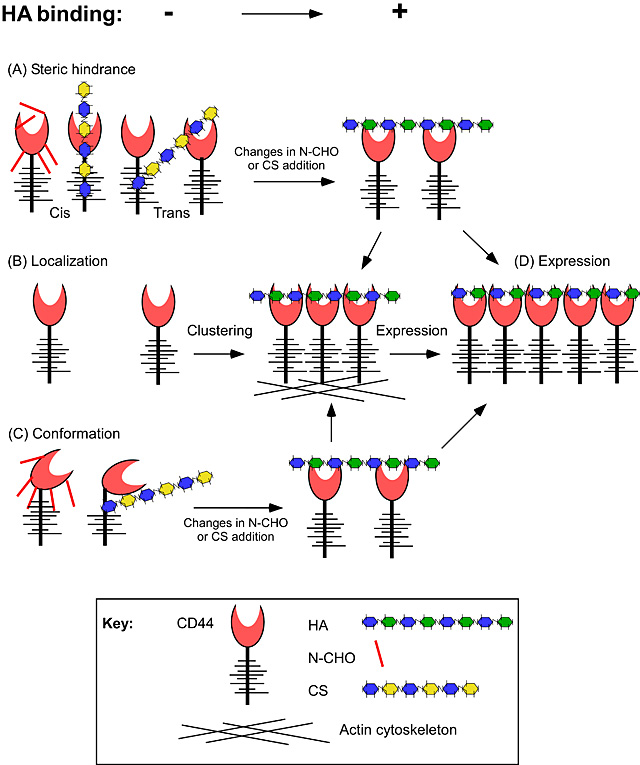
Fig. 1
CD44によるHA結合を制御する機序の可能性。(A) N-グリコシル化(N-CHO) もしくは コンドロイチン硫酸(CS)といった翻訳後修飾のCD44への付加による立体障害は、HA結合を妨ぐか、HAのためのCD44の親和性を弱める可能性がある。(B) クラスター化の引き起こす局所的なCD44発現の増加は、相互作用の結合力を強化すると考えられる。(C) N-CHOあるいはCSのような翻訳後修飾は、HAへの異なる結合親和性のある構造変化を起こす可能性がある。(D) CD44発現の増加は、CD44が閾値濃度以上に存在し、かつHA結合の負の調節因子が相互作用を妨げていなければ、結合力を増強することによってHA結合を増加させる可能性がある。
2.2 CD44 - HA結合の生理学的調節因子
ヒト末梢血単球(PBM)では、シアル酸残基はHA結合を負に制御する38。これはLPS誘発HA結合時に、シアリダーゼ活性が増加し、そしてシアリダーゼ阻害剤を加えるとHA結合を減少させたことで立証された38。TNFαもヒト単球系細胞でHA結合を誘発し14,39、これはCD44の糖鎖硫酸化の増加と相関するが15、HA結合の誘発の直接な原因であるとはまだ立証されていない。同様にN-グリコシル化の変化がTNFαに誘発されたHA結合に関係しているかどうかもまだ確認されていない。しかしながら、コンドロイチン硫酸付加がHA結合の制御に生理学的役割を果たしているという証拠が集まりつつあることも確かである。TNFαは、CD44へのコンドロイチン硫酸付加を低減し、マウス骨髄由来マクロファージにおけるHA結合を減少させた(未発表データ)、またマウス骨髄由来マクロファージとヒト単球系細胞の両方においてグリコサミノグリカン付加を抑制するか40、もしくはヒトJurkat T細胞においてCD44の突然変異を使用してコンドロイチン硫酸付加を特異的に抑制するとHA結合が増す41。したがって、シアル酸とコンドロイチン硫酸は、単球/マクロファージにおいてHA結合を調節する2つの生理学的調節因子なのである。他の白血球系細胞における生理学的調節因子に関しては、まだ何も立証されていない。
2.3 HA結合タンパク質によるCD44とHAの相互作用制御
炎症性刺激は、内皮細胞におけるHA発現を亢進し42、炎症部位でのCD44依存白血球相互作用を亢進させる1つの機序である。炎症状態はTSG-6もまた亢進させることがある3。TSG-6はHAと結合でき、かつCD44 とHA間の相互作用を増強することできるが、これはおそらくHAを架橋結合させることでその相互作用の結合力を強めることによると思われる43。血清中に存在するタンパク質であるSHAPはHAと共有結合できCD44との結合を強めることができる44。これは生理学的影響をもつかもしれない。というのは、通常は可溶性の蛍光ラベルしたHA (Fl-HA)の有意水準とは結合しないU937単球細胞や末梢血単球が、poly I:C刺激を受けた平滑筋細胞が生成するSHAP会合のHAケーブルと結合することができるためである45,46 。さらに、LPS誘発肝損傷の際のSHAP発現の増加は、CD44 - HA結合に依存すると考えられてきた。これによりHA量も増加せず、またHA結合を増すようなCD44の増加も見られない47 好中球の肝類洞細胞への結合を説明できると考えられている。
これら研究が指摘するのは、HA結合タンパク質が、HAがどのようにCD44に提示されるかに影響を与え、親和性や結合力の強さに影響を与えているということを示唆している。これらデータを総合すると、CD44とHAの相互作用はCD44とHA両方の修飾によって制御されているといえる。
3. 免疫系におけるCD44発現とHA結合
3.1 免疫細胞の発生と免疫監視にCD44は重要ではない
CD44は、初期造血前駆細胞(造血幹細胞も含む)に発現し、骨髄移植後の造血幹細胞のホーミングに関与するといわれてきた48,49。この事実と、HAが骨髄の幹細胞ニッチの構成要素であることが立証されているにもかかわらず50、CD44欠損マウスは正常に発生するように見える51,52。CD44は胸腺の初期胸腺前駆細胞に発現し、胸腺細胞の発生の間に抑制される。初期の抗CD44 mAbsによるブロッキング実験では、胸腺前駆細胞のホーミングにCD44がなにかしらの働きをしているのではないかと示唆されたが53、CD44欠損マウスではっきりしなかったため51、初期T前駆細胞に対するCD44の機能的重要性は解明されないままであった。マウス系統によって発現レベルに差はあるものの、C57Bl/6マウスの胸腺からでていくナイーブT細胞にCD44は低レベルで発現する(総説あり8)。ここでもまた、ヒトでの初期の研究で指摘されたリンパ球ホーミングにおけるCD44の役割は54、欠損マウスを使った実験では証明されず51、野生型とCD44欠損リンパ球を使った比較実験でも、ナイーブ宿主は同じような輸送パターンを見せた55。つまり、マウスの正常な免疫細胞の発生と恒常性にCD44は無くてもよいようではあるが、過去に示唆されてきたように他の接着分子あるいはRHAMMによってCD44欠損マウスのCD44が代償されていると考えることはできる56。免疫系のほとんどの細胞にCD44は様々な度合いで発現するが、通常の恒常的条件下では、細胞の大半は検出可能なレベルのFl-HAを結合しない。CD44のレベルは、単球では炎症性物質への曝露によって39、そしてT細胞ではC57Bl/6マウスでの抗原誘発性活性化によって上昇し、したがって高レベルCD44は活性化T細胞および記憶T細胞のマーカーとなる57。Fl-HAを結合するためには、免疫細胞は活性化している必要があることから、免疫反応が始まるまでHA結合の機能的重要性が明らかにならなかったのは、驚くべきことではなかった。
3.2 免疫反応の活性化に伴うHA結合の誘発
主に初代白血球ex-vivoにおけるHA結合を誘発する要因をTable 2にまとめた。
Table 2 一次免疫細胞によるHA結合を増強する要因
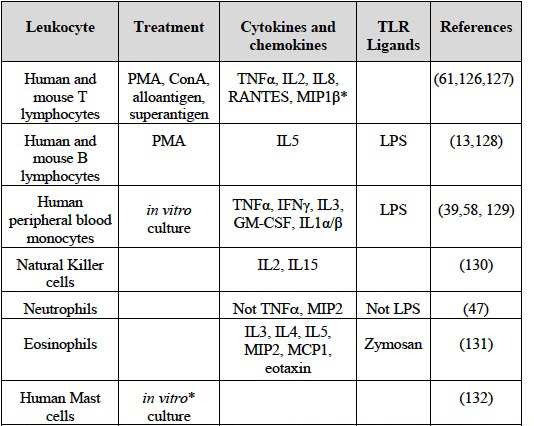
データは初代免疫細胞ex vivoに限定されており、細胞株のデータは含まない。HA結合は可溶性Fl-HAとフローサイトメトリーで計測した。Pep-1で検知したように、樹枝状細胞はその表面にHAを発現する72
* Fl-HAを結合するのではなく、固定HAへの接着を示す。
3.2.1 単球/マクロファージ
SLPS、IFNγ 、IL-1、TNFαおよび GM-CSFによるヒト末梢血単球の刺激は、すべてCD44の発現を亢進し、HA結合を誘発するが39,58、これらの場合実際にHA結合を誘発したのは、IL-1とGM-CSFに反応して産成されたTNFαである。IL-4とIL-13はTNFα誘発性HA結合を抑制し、N-グルコシル化とコンドロイチン硫酸付加の抑制がIL-4依存性HA結合の抑制を阻害する40。IL-10は抗炎症性サイトカインと考えられているが、ヒト単球におけるHA結合を誘発する40。
3.2.2 好中球
好中球は、炎症性刺激への曝露後検出可能なレベルの可溶性Fl-HAと結合せず、in vitroではHA依存性ローリングを示さないものの59、CD44もしくはHAの欠如は、ケモカイン誘発白血球動員モデルにおいて好中球の接着と遊出を抑制した59。LPS誘発肝損傷を受けたCD44欠損マウスの肝類洞内でも、好中球の接着は抑えられた47。可溶性F1-HAを用いて検出されるにはHA結合が低すぎるか、あるいはin vivo でのHA結合がin vitroでの可溶性Fl-HAとの結合が異なっているとすれば、この明白な矛盾を説明することができるかもしれない。前者の裏づけとしては、ほとんど検知可能なFl-HA結合を持っていないTh1とTh2エフェクター細胞は、HA依存的にローリングできると考えられる60。後者への支持として、SHAPやTSG-6といった他のHA結合タンパク質が存在すると、CD44発現細胞はより多くのHAを結合するという研究結果が2つ報告されている43,44。
3.2.3 T細胞におけるHA結合の誘発
免疫反応の活性化に伴い、in vivo でCD4+およびCD8+ 両方のT細胞集団に、ある割合でCD44発現の増加とHA結合の一時的な誘発が観察された61,62。しかし、なぜ一定の割合の活性化T細胞でのみ誘発されるのか、結合が一時的なのかはまだ解明されていない。HA結合集団にすべてのCD8+エフェクター細胞傷害性T細胞が存在していたにもかかわらず、HAあるいはCD44 mAbsのいずれによるブロッキングも細胞溶解を防ぐことはできなかった61。しかし、ヒト傷害性T細胞、NK細胞そしてNKT細胞での研究では、CD44との結合が、それぞれのエフェクター機能を高め63-65、CD44とLFA-1両方を欠損したマウスを使用した研究では、IL2活性化NK細胞においては結合減少のデータがえられた66。HA結合はまた、最も機能的に活発な制御性T細胞にあらわれ67、高分子HAはこれら細胞の抑制能力を高めることができる68。
CD44の抗体結合は、T細胞活性化の間に共刺激活性をもたらすが8、ヒト末梢T細胞による研究で、HAがCD3媒介T細胞の活性化の増強にかかわっていると報告したのは1件のみであった69。HAは樹枝状細胞によって合成・発現され72、またCD44欠損T細胞が成熟樹枝状細胞と混在したときには、in vitroで結合形成の抑制がみられるため70,71、CD44とHAの結合は樹枝状細胞とT細胞の間の相互作用の仲介を手助けすると考えられる70,71。しかし、ナイーブT細胞は検出可能なレベルのFl-HAを結合しないことから、ナイーブT細胞活性化にとってこの相互作用がどの程度まで重要なのかはまだ不明である。HAとHAオリゴ糖は樹枝状細胞の成熟を誘発することもできるが、これはCD44非依存性、Toll様受容体4依存性におこる73。現時点で最も明確になっている活性化T細胞におけるCD44の役割は、流動条件下における活性化内皮細胞とHA上でのローリングを媒介することと言えよう74。これについての詳細は次章で述べる。
4. 免疫応答におけるCD44とHAの相互作用の機能
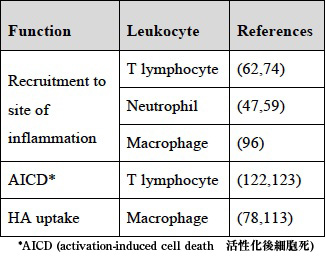
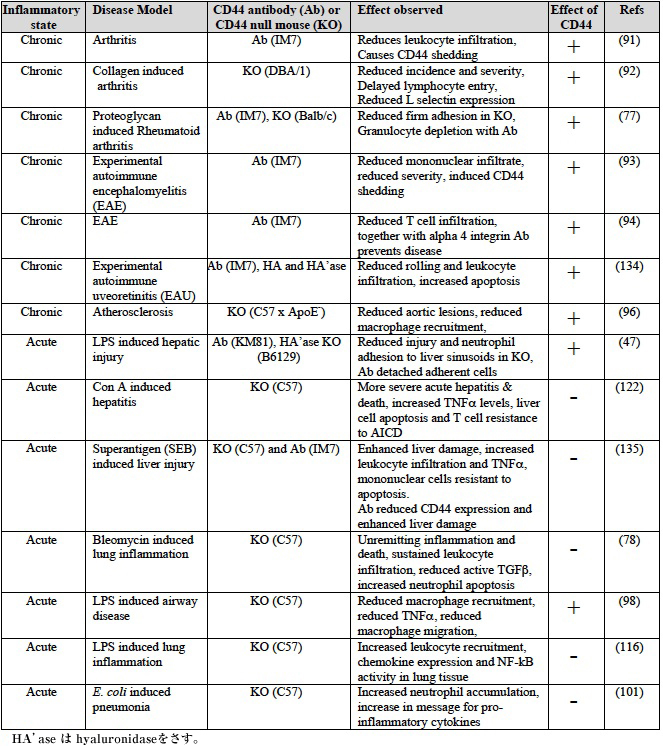
CD44の免疫反応における機能は、CD44抗体もしくはCD44欠損マウスのいずれかを用いた疾患モデルマウスの研究から浮上した(総説あり75,76)。どのアプローチにも限界があり、CD44 mAbであるIM7を使用すれば循環血液中からの好中球の急減を誘発することができる一方77、CD44欠損マウスには代償効果の可能性がある56。いずれにしても、どちらのアプローチも免疫反応におけるCD44とHAのin vivo機能に関する貴重な洞察を提供したことにかわりはない。大半の証拠がCD44の炎症を誘発する役割を指摘するが59,62、逆にCD44が炎症終息に一役買っているとする病態モデルもいくつかある78。ここで我々は、免疫炎症性反応の発症と終息におけるCD44の機能を説明したい。これらはTable 3にまとめてある。
Table 3 一次免疫細胞によるHA結合を増強する要因
4.1 白血球接着の制御と炎症性部位への動員
炎症部位への白血球血管外遊走は、一連の個別の段階を伴う:連結とローリング、接着、血管外遊出と遊走である(総説あり79-82)。まずはじめに、連結とローリング作用によって、白血球は血液中から捕らえられる。これによって細胞の速度が抑えられるため、さらに内皮細胞上のケモカインとの相互作用により大きな機会が与えられ、それがローリング相互作用と共にインテグリン機能を亢進するようシグナルを発する。これが強固な接着と細胞停止へとつながり、それに続けて炎症組織への血管外遊出と遊走が起こる。セレクチンとそのリガンドは、CD44とHA同様にインテグリンを介する接着につながり、初期のローリング相互作用に関与していると考えられた(総説83,84とFig. 2参照)。内皮細胞におけるセレクチンの発現は炎症性刺激から数時間以内に、そしてケモカインシグナルによるインテグリンの活性化は数分以内に惹起されるのに比べ、T細胞と単球におけるCD44によるHA結合の誘発は一般的にそれよりも時間のかかるプロセスを経る。タンパク質の合成のほかに、大半の細胞においてHA最大結合を達成するのに最長3日を要するためである。エフェクターT細胞になる前に増殖して、感染部位へ移動するためにリンパ節で一番最初に活性化するT細胞にとって、このゆっくりとした亢進は、道理にかなっているが、単球の緩慢な動態の重要性はまだわかっていない。とはいえ、単球の最適なHA結合は血液中ではなく、組織内で生じると予測できるはずである。
4.2 CD44を介したHA結合の炎症促進的役割
白血球を炎症部位に動員する際に使われる機序と分子は、臓器と動員される白血球の種類によって異なる85,86。臓器によっては、CD44とHAが炎症部位へ白血球動員を促すことにより炎症促進的な働きをし、慢性炎症性疾患を促進しているのではないかと指摘する証拠がある。
4.2.1 炎症部位へのTリンパ球の動員
Siegelmanの研究グループが最初にT細胞はCD44およびHA依存的様式で内皮細胞にローリングすることができるという、重要な発見をしたことは、この領域に大きく貢献した74,87。炎症起因物質が、微小血管内皮細胞の表面上のCD44およびHAの発現を亢進してHA結合を誘発することで、内皮細胞CD44がHAをT細胞に提示し、CD44依存性ローリングを媒介することを可能にする42,88。これと前述のデータ14が「サンドウィッチ」相互作用モデル:CD44 - HA - CD44の提案に結びついた(Fig. 3)。
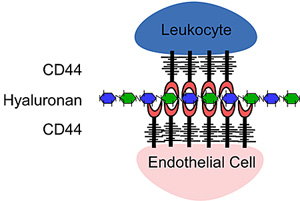
Fig. 3
サンドウィッチ・モデル。CD44:HA:CD44に仲介された細胞 - 細胞相互作用。活性化T細胞に発現したCD44は、ここでCD44によって内皮細胞の表面に提示されたHAと結合する。内皮細胞が発現したHAのレベルは、炎症状態に応じて上昇する。
Siegelmanの研究グループは、さらにスーパー抗原によって活性化されたT細胞の腹膜へのin vivo での血管外遊走に対するCD44とHAの影響を実証するに至った62。CD44はその後のα4β1インテグリン (VLA-4)を介する強固な接着にも不可欠であり、そしてこれはCD44の細胞質ドメインを要した89。この研究は、活性化T細胞は、炎症部位への血管外遊出を円滑にするため、炎症内皮細胞に誘起したHAにローリングすることができることを示した。TNFαにより活性化された内皮細胞モデルマウスでのTh1およびTh2細胞の、in vivo CD44およびHA依存的ローリングと接着を最初に提示したのは、Kubesの研究グループであった60。CD44が、内皮細胞とT細胞の両方に不可欠であることは、サンドウィッチモデルと一致している。
白血球血管外遊走におけるCD44とHAの役割は、CD44欠損マウスの分析とCD44抗体を使った慢性炎症性疾患のいくつかのモデルでも示唆されている(総説あり75)。CD44 mAbであるIM7は、CD44のHA結合部位に直接結合はしないものの90、この抗体はin vivoでは劇的効果がある。in vivoでのIM7投与は白血球除去につながるという最近の知見から判断すると77、この抗体を用いての研究の解釈には慎重を期すべきである。しかし、慢性炎症モデルマウスのいくつかは、CD44欠損マウスとCD44抗体研究の両方で慢性炎症部位へのT細胞動員における、CD44に炎症促進機能があることを裏付けている(Table 4)。Mikeczとその研究仲間たちの初期の研究では、関節リウマチモデルマウスの白血球浸潤におけるIM7の阻害機能を確認し91、コラーゲン誘導関節炎のモデルマウスを使ったその後の研究で、CD44欠損マウスでは疾患の発症率および重篤度の両方において著しい減少を確認した92。養子的移植実験(adoptive transfer)を用いてT細胞輸送パターンを分析した結果、CD44陰性T細胞は、関節炎マウスの関節に遅発侵入することが判明し、CD44が炎症部位に白血球輸送を促進することで関節炎に影響を及ぼすと示唆した55,92。
実験的自己免疫脳脊髄炎(EAE)モデルの場合、抗CD44抗体と抗VLA-4インテグリン抗体の投与は、脊髄93と脳94へのT細胞輸送を抑え、EAEの発生を防いだ。興味深いことに、スーパー抗原誘導腹膜炎へのCD44依存性の血管外遊走はVLA-4を介した強固な接着を要するため89,95、CD44とVLA-4間の協力的相互作用が中枢神経系へのT細胞の動員に関与している可能性が浮上する。
4.2.2 好中球とマクロファージの炎症部位への動員
炎症部位に他の白血球を動員するうえでもCD44は重要である可能性がある59,96,97。組織中の好中球蓄積は、CD44欠損マウスを使った59ケモカインによる動員モデルとエンドキシン血症モデルマウスの肝類洞47で減少する。アテローム性動脈硬化96およびLPS吸入後の炎症を起こした肺98へのCD44欠損マクロファージ動員の減少もまた観察され、HAは損傷を受けた部位にマクロファージを動員することができる99。しかし、好中球もしくはマクロファージの動員障害は、ブレオマイシンが誘発した肺炎症を起こしたCD44欠損マウスには観察されず78、ヒト結核菌に感染後100もしくは大腸菌により誘発された肺炎101の肺には好中球の持続的な動員の増加がみられる。
炎症部位への好中球の動員にCD44とHAがどのように影響するかは、T細胞のそれとは異なると考えられる。T細胞とは違い、好中球とマクロファージは組織中で活性化され、血液中の非刺激好中球および単球は、検出可能なレベルの可溶Fl-HAと結合しないため、初期動員にはCD44とHAは関与しないと考えられる。接着異常に加え、in vitro でのCD44欠損好中球59,102およびマクロファージ98 において、in vivoでは好中球ではなく59、マクロファージ98 において、それぞれ遊走不全が報告された。つまり、遊走不全が動員減少に関与しているといえよう。他の可能性としては、おそらくそのVLA-4への影響を介して白血球CD44は強固な接着に不可欠であること、もしくは、ケモカイン固定化に内皮細胞CD44が一役買うことによって接着を引き起こし、その後の遊走へとつながると考えられる。プロテオグリカンで修飾されているCD44もしくは内皮細胞上でHAと結合しているプロテオグリカンは、ケモカインを固定化する可能性があり、その結果白血球接着とインテグリン活性化を促進する103。例えばMIP-1βは、プロテオグリカン型CD44および内皮細胞と結合することができ、これがT細胞接着をうながす。104
Table 4 CD44が炎症疾患モデルマウスにもたらす影響
4.3 CD44媒介HA結合の抗炎症的役割
ほとんどの疾病の慢性炎症モデルがCD44とHAの炎症促進的役割を指摘しているが、組織損傷をきたす急性炎症モデルのほとんどは、CD44の炎症終息へのかかわりを示している (Table 4).
4.3.1 炎症反応の終息
急性炎症のブレオマイシン肺障害モデルでは、マウスは通常回復するものの、CD44欠損マウスの75%は2週間以内に死亡する78。死亡数増加の原因は、トランスフォーミング成長因子-β1(TGF-β1)の低活性、アポトーシス好中球の除去障害そして高および低分子量両方のヒアルロン酸蓄積などを特徴とする炎症終息の失敗である。肺障害を含む106多くの実験システムにおける免疫反応の抑制と組織の修復の促進に、活性TGF-β1は重要である105。TGF-β1は不活性型として分泌され107、タンパク質分解によって活性化される。ケラチノサイトの場合には、細胞表面へのMMP-9局在はCD44依存性で、TGF-β1の活性化につながる可能性があるため108、CD44がTGF-β1活性化に一役買っているという可能性が考えられる。実際にCD44は、TGF-β1活性化109と、線維芽細胞の方向性のある遊走を促進し、どちらも創傷治癒を促進させる。
HAはヒアルロニダーゼと活性酸素/窒素種によって分解され、これと同時にヒアルロン酸合成が増加すると、炎症部位でのHAと低分子HAの蓄積に結びつく(総説あり110,111)。HAの大半は、リンパ系の除去を介して組織内で代謝される。しかし、HAの局所的代謝は、HA分解の25%以上を占めることもある112。肺胞マクロファージによるCD44発現は、肺におけるHAの局所的代謝に関わっていると報告された113,114。これと一貫して、ブレオマイシンを投与されたCD44欠損マウスの肺におけるHAの蓄積はCD44+ の骨髄で再構築したキメラCD44欠損マウスでは減少がみられた78。HAの小断片がTLR-2および-4を介して細胞を活性化することができるため115、これらの研究はCD44が炎症性低分子HAの除去とHAの恒常性の復元に重要な役割を担っていると示唆している。CD44はまたTLR-4シグナルを負に制御することができるが116,117、これは炎症を抑制する手段が別にあることを示唆している。
CD44はCD44抗体を塗布したビーズに対する食細胞レセプターであると考えられているが118、その後の研究では、CD44 mAbsには、補体レセプター-3駆動の食細胞経路を活性化させることで食細胞に間接的な影響力を持っているのではないかと推測された119。
他の研究では、抗CD44 mAbと共にインキュベートされたマクロファージが、アポトーシス好中球の食作用を高めることが報告されている120。つまり、炎症の終息に必要な手順である、アポトーシス好中球の効果的な除去に、CD44は間接的影響力がある可能性を提起する。
4.3.2 活性化後T細胞死
CD44が活性化後細胞死(AICD)に関与しているという証拠もある。AICDは、活性化T細胞の除去と免疫恒常性の復元に関与している121。高分子HAはin vitro活性化T細胞の部分集団に対してAICDを引き起こす場合がある41。in vivoでは、CD44依存性AICDの欠如はCD44ノックアウトマウスにおける遅延型過敏反応およびコンカナバリンA誘導肝炎の重症化に関連がある122,123。CD44の欠如はまた、AICDの主たる原因である受容体Fasを発現しないマウスに見られるリンパ球増殖の症状を増悪させる124。つまり、FasがAICDに大きな役割を果たし、そしてCD44結合が初代ヒトT細胞におけるFasの表面発現を増長させるという報告があるにも関わらず125、初代マウスT細胞124およびヒトJurkat T細胞から得られたデータ41は、CD44媒介のAICDはFas非依存性機序に惹起されることを示している。
HAはin vitroで活性化されたCD44+T細胞のAICDを増加させるが、CD44陰性T細胞のAICDを増加させることはできない41。さらに、ヒトJurkat T細胞におけるHAに依存した細胞死の程度は、HA結合の程度に依存する、すなわちHAとの結合性の高い細胞のほうが、低い細胞よりも細胞死に感受性が高く、低分子ではなく高分子HAがAICDをうながす。つまり、CD44によるHA結合の強さもしくは程度が生物学的結果を左右することを示唆している。高分子HAは正常の、無傷、そして非感染の組織の特性であるから、組織の恒常性をうながすために活性化T細胞死の誘因となるのは理にかなっている。
5. 結語
CD44とその多価リガンドHA間の相互作用は独特であり、低親和性、低結合力相互作用から高親和性、高結合力相互作用にまでわたることもある。相互作用の強さが生物学的結果を左右すると示唆する証拠もいくつか報告されている。たとえば、HAとの結合力が低いTh1およびTh2細胞はHA上でローリングできる一方で、活性化T細胞における高HA結合は細胞死を招くこともありえる。CD44とHAが免疫細胞の発生と恒常性に関与しないと断言はできないが、現在までに報告されている証拠を総合すると、免疫反応を制御する上で相互作用が重要であることを指摘している。このことは、免疫細胞が抗原あるいは炎症起因物質によって活性化されるまでは、HAと結合しないという事実に裏付けされている。T細胞と好中球とでは、機序に違いはあるだろうが、白血球を炎症部位に円滑に動員する上で、CD44とHAには炎症促進的な働きをしているという証拠がでている。このプロセスでどのくらいCD44とHAが重要であるかは、臓器と疾病によって異なる。CD44は、炎症の終息とHAと組織の恒常性の復元にも関与している可能性がある。活性化マクロファージにおけるCD44は、炎症性低分子HAの除去を補助し、高分子HAの活性化T細胞への結合は、それらの除去と組織の恒常性の復元を容易にするのではないだろうか。
謝辞
CD44に関する我々の研究は、B.C and YukonのHeart and Stroke Foundation 、Canadian Institutes of Health ResearchそしてNational Science and Engineering Council of Canada からの助成を受けて実施した。Brian Ruffell はHeart and Stroke Foundationから奨学金を受けた。
References
- Camenisch, T. D., Spicer, A. P., Brehm-Gibson, T., Biesterfeldt, J., Augustine, M. L., Calabro, A., Jr., Kubalak, S., Klewer, S. E., McDonald, J. A. Disruption of hyaluronan synthase-2 abrogates normal cardiac morphogenesis and hyaluronan-mediated transformation of epithelium to mesenchyme. J Clin Invest 106, 349-360, 2000.
- Toole, B. P. Hyaluronan and its binding proteins, the hyaladherins. Curr. Opin. Cell Biol. 2, 839-844, 1990.
- Milner, C. M., Day, A. J. TSG-6: a multifunctional protein associated with inflammation. J Cell Sci 116, 1863-1873, 2003.
- Zhou, B., Weigel, J. A., Saxena, A., Weigel, P. H. Molecular cloning and functional expression of the rat 175-kDa hyaluronan receptor for endocytosis. Mol Biol Cell 13, 2853-2868, 2002.
- Huang, L., Yoneda, M., Kimata, K. A Serum-Derived Hyaluronan-Associated Protein (SHAP) Is the Heavy Chain of the Inter alpha-trypsin Inhibitor. J Biol Chem 268, 26725-26730, 1993.
- Jackson, D. G. Biology of the lymphatic marker LYVE-1 and applications in research into lymphatic trafficking and lymphangiogenesis. Apmis 112, 526-538, 2004.
- Ponta, H., Sherman, L., Herrlich, P. A. CD44: from adhesion molecules to signalling regulators. Nat. Rev. Mol. Cell. Biol. 4, 33-45, 2003.
- Lesley, J., Hyman, R., and Kincade, P. W. CD44 and its interaction with extracellular matrix. Adv Immunol 54, 271-335, 1993.
- Jalkanen, S., Jalkanen, M., Bargatze, R., Tammi, M., Butcher, E. C. Biochemical properties of glycoproteins involved in lymphocyte recognition of high endothelial venules in man. J. Immunol. 141, 1615-1623, 1988.
- Brown, T. A., Bouchard, T., St. John, T., Wayner, E., and Carter, W. G. Human keratinocytes express a new CD44 core protein (CD44E) as a heparan-sulfate intrinsic membrane proteoglycan with additional exons. J. Cell Biol. 113, 207-221, 1991.
- Takahashi, K., Stamenkovic, I., Cutler, M., Dasgupta, A., Tanabe, K. K. Keratan sulfate modification of CD44 modulates adhesion to hyaluronate. J. Biol. Chem. 271, 9490-9496, 1996.
- Lesley, J., English, N., Perschl, A., Gregoroff, J., Hyman, R. Variant cell lines selected for alterations in the function of the hyaluronan receptor CD44 show differences in glycosylation. J Exp Med 182, 431-437, 1995.
- Katoh, S., Zheng, Z., Oritani, K., Shimozato, T., Kincade, P. W. Glycosylation of CD44 negatively regulates its recognition of hyaluronan. J. Exp. Med. 182, 419-429, 1995.
- Maiti, A., Maki, G., Johnson, P. TNF-alpha induction of CD44-mediated leukocyte adhesion by sulfation. Science 282, 941-943, 1998.
- Delcommenne, M., Kannagi, R., and Johnson, P. TNF-alpha increases the carbohydrate sulfation of CD44: induction of 6-sulfo N-acetyl lactosamine on N- and O-linked glycans. Glycobiology 12, 613-622, 2002.
- Spring, F. A., Dalchau, R., Daniels, G. L., Mallinson, G., Judson, P. A., Parsons, S. F., Fabre, J. W., Anstee, D. J. The Ina and Inb blood group antigens are located on a glycoprotein of 80,000 MW (the CDw44 glycoprotein) whose expression is influenced by the In(Lu) gene. Immunology 64, 37-43, 1988.
- Katayama, Y., Hidalgo, A., Chang, J., Peired, A., Frenette, P. S. CD44 is a physiological E-selectin ligand on neutrophils. J Exp Med 201:1183-1189, 2005.
- Dimitroff, C. J., Lee, J. Y., Fuhlbrigge, R. C., Sackstein, R. A distinct glycoform of CD44 is an L-selectin ligand on human hematopoietic cells. Proc. Natl. Acad. Sci. USA 97, 13841-13846 , 2000.
- Dimitroff, C. J., Lee, J. Y., Rafii, S., Fuhlbrigge, R. C., Sackstein, R. CD44 is a major E-selectin ligand on human hematopoietic progenitor cells. J. Cell Biol. 153, 1277-1286, 2001.
- Banerji, S., Wright, A. J., Noble, M., Mahoney, D. J., Campbell, I. D., Day, A. J., Jackson, D. G. Structures of the CD44-hyaluronan complex provide insight into a fundamental carbohydrate-protein interaction. Nat Struct Mol Biol 14, 234-239, 2007.
- Lesley, J., He, Q., Miyake, K., Hamann, A., Hyman, R., Kincade, P. W. Requirements for hyaluronic acid binding by CD44: a role for the cytoplasmic domain and activation by antibody. J Exp Med 175, 257-266, 1992.
- Lesley, J., Hascall, V. C., Tammi, M., Hyman, R. Hyaluronan binding by cell surface CD44. J Biol Chem 275, 26967-26975, 2000.
- Lesley, J., Hyman, R. CD44 can be activated to function as an hyaluronic acid receptor in normal murine T cells. Eur J Immunol 22, 2719-2723, 1992.
- Kincade, P. W., Zheng, Z., Katoh, S., Hanson, L. The importance of cellular environment to function of the CD44 matrix receptor. Curr. Opin. Cell Biol. 9, 635-642, 1997.
- Lesley, J., Hyman, R., English, N., Catterall, J. B., Turner, G. A. CD44 in inflammation and metastasis. Glycoconj J 14, 611-622, 1997.
- Lesley, J., Hyman, R. CD44 structure and function. Front Biosci 3, 616-630, 1998.
- Greenfield, B., Wang, W. C., Marquardt, H., Piepkorn, M., Wolff, E. A., Aruffo, A., Bennett, K. L. Characterization of the heparan sulfate and chondroitin sulfate assembly sites in CD44. J. Biol. Chem. 274, 2511-2517, 1999.
- Ruffell, B., Johnson, P. Chondroitin sulfate addition to CD44H negatively regulates hyaluronan binding. Biochem Biophys Res Commun 334, 306-312, 2005.
- English, N. M., Lesley, J. F., Hyman, R. Site-specific de-N-glycosylation of CD44 can activate hyaluronan binding, and CD44 activation states show distinct threshold densities for hyaluronan binding. Cancer Research 58, 3736-3742, 1998.
- Skelton, T. P., Zeng, C. X., Nocks, A., Stamenkovic, I. Glycosylation provides both stimulatory and inhibitory effects on cell surface and soluble CD44 binding to hyaluronan. J. Cell Biol. 140, 431-446, 1998.
- Toyama-Sorimachi, N., Sorimachi, H., Tobita, Y., Kitamura, F., Yagita, H., Suzuki, K., Miyasaka, M. A novel ligand for CD44 is serglycin, a hematopoietic cell lineage-specific proteoglycan. J. Biol. Chem. 270, 7437-7444, 1995.
- Naujokas, M. F., Morin, M., Anderson, M. S., Peterson, M., Miller, J. The chondroitin sulfate form of invariant chain can enhance stimulation of T cell responses through interaction with CD44. Cell 74, 257-268, 1993.
- Bourguignon, L. Y. W., Lokeshwar, V. B., Chen, X., Kerrick, W. G. L. Hyaluronic acid-induced lymphocyte signal transduction and HA receptor (GP85/CD44)-cytoskeleton interaction. J. Immunol. 151, 6634-6644, 1993.
- Brown, K. L., Birkenhead, D., Lai, J. C., Li, L., Li, R., Johnson, P. Regulation of hyaluronan binding by F-actin and colocalization of CD44 and phosphorylated ezrin/radixin/moesin (ERM) proteins in myeloid cells. Exp. Cell Res. 303, 400-414, 2005.
- Liu, D., Zhang, D., Mori, H., Sy, M.-S. Binding of CD44 to hyaluronic acid can be induced by multiple signals and requires the CD44 cytoplasmic domain. Cell. Immunol. 174, 73-83, 1996.
- Tsukita, S., Oishi, K., Sato, N., Sagara, J., Kawai, A., Tsukita, S. ERM family members as molecular linkers between the cell surface glycoprotein CD44 and actin-based cytoskeletons. J. Cell Biol. 126, 391-401, 1994.
- Lesley, J., Kincade, P. W., Hyman, R. Antibody-induced activation of the hyaluronan receptor function of CD44 requires multivalent binding by antibody. Eur J Immunol 23, 1902-1909, 1993.
- Katoh, S., Miyagi, T., Taniguchi, H., Matsubara, Y., Kadota, J., Tominaga, A., Kincade, P. W., Matsukura, S., Kohno, S. Cutting edge: An inducible sialidase regulates the hyaluronic acid binding ability of CD44-bearing human monocytes. J. Immunol. 162, 5058-5061, 1999.
- Levesque, M. C., Haynes, B. F. Cytokine induction of the ability of human monocyte CD44 to bind hyaluronan is mediated primarily by TNF-alpha and is inhibited by IL-4 and IL-13. J. Immunol. 159, 6184-6194, 1997.
- Levesque, M. C., Haynes, B. F. TNF alpha and IL-4 regulation of hyaluronan binding to monocyte CD44 involves posttranslational modification of CD44. Cell. Immunol. 193, 209-218, 1999.
- Ruffell, B., Johnson, P. Hyaluronan induces cell death in activated T cells through CD44. J. Immunol. 181: 7044-7054, 2008.
- Mohamadzadeh, M., Degrendele, H., Arizpe, H., Estess, P., Siegelman, M. Proinflammatory stimuli regulate endothelial hyaluronan expression and CD44/HA-dependent primary adhesion. J. Clin. Invest. 101, 97-108, 1998.
- Lesley, J., Gal, I., Mahoney, D. J., Cordell, M. R., Rugg, M. S., Hyman, R., Day, A. J., Mikecz, K. TSG-6 modulates the interaction between hyaluronan and cell surface CD44. J Biol Chem 279, 25745-25754, 2004.
- Zhuo, L., Kanamori, A., Kannagi, R., Itano, N., Wu, J., Hamaguchi, M., Ishiguro, N., Kimata, K. SHAP potentiates the CD44-mediated leukocyte adhesion to the hyaluronan substratum. J Biol Chem 281:20303-20314, 2006.
- de La Motte, C. A., Hascall, V. C., Calabro, A., Yen-Lieberman, B., Strong, S. A. Mononuclear leukocytes preferentially bind via CD44 to hyaluronan on human intestinal mucosal smooth muscle cells after virus infection or treatment with poly(I.C). J Biol Chem 274, 30747-30755, 1999.
- de la Motte, C. A., Hascall, V. C., Drazba, J., Bandyopadhyay, S. K., Strong, S. A. Mononuclear leukocytes bind to specific hyaluronan structures on colon mucosal smooth muscle cells treated with polyinosinic acid:polycytidylic acid: inter-alpha-trypsin inhibitor is crucial to structure and function. Am J Pathol 163, 121-133, 2003.
- McDonald, B., McAvoy, E. F., Lam, F., Gill, V., de la Motte, C., Savani, R. C., Kubes, P. Interaction of CD44 and hyaluronan is the dominant mechanism for neutrophil sequestration in inflamed liver sinusoids. J Exp Med 205, 915-927, 2008.
- Sackstein, R. The bone marrow is akin to skin: HCELL and the biology of hematopoietic stem cell homing. J Investig Dermatol Symp Proc 9, 215-223, 2004.
- Avigdor, A., Goichberg, P., Shivtiel, S., Dar, A., Peled, A., Samira, S., Kollet, O., Hershkoviz, R., Alon, R., Hardan, I., Ben-Hur, H., Naor, D., Nagler, A., Lapidot, T. CD44 and hyaluronic acid cooperate with SDF-1 in the trafficking of human CD34+ stem/progenitor cells to bone marrow. Blood 103, 2981-2989, 2004.
- Haylock, D. N., Nilsson, S. K. The role of hyaluronic acid in hemopoietic stem cell biology. Regen Med 1, 437-445, 2006.
- Schmits, R., Filmus, J., Gerwin, N., Senaldi, G., Kiefer, F., Kundig, T., Wakeham, A., Shahinian, A., Catzavelos, C., Rak, J., Furlonger, C., Zakarian, A., Simard, J. J. L., Ohashi, P. S., Paige, C. J., Gutierrezramos, J. C., Mak, T. W. CD44 regulates hematopoietic progenitor distribution, granuloma formation and tumorigenicity. Blood 90, 2217-2233, 1997.
- Protin, U., Schweighoffer, T., Jochum, W., Hilberg, F. CD44-deficient mice develop normally with changes in subpopulations and recirculation of lymphocytes subsets. J. Immunol. 163, 4917-4923, 1999.
- Wu, L., Kincade, P. W., Shortman, K. The CD44 expressed on the earliest intrathymic precursor population functions as a thymus homing molecule but does not bind to hyaluronate. Immunol Lett 38, 69-75, 1993.
- Jalkanen, S. T., Bargatze, R. F., de los Toyos, J., Butcher, E. C. Lymphocyte recognition of high endothelium: antibodies to distinct epitopes of an 85-95 kD glycoprotein antigen differentially inhibit lymphocyte binding to lymph node, mucosal or synovial endothelial cells. J. Cell Biol. 105, 983-990, 1987.
- Stoop, R., Gal, I., Glant, T. T., McNeish, J. D., Mikecz, K. Trafficking of CD44-deficient murine lymphocytes under normal and inflammatory conditions. Eur J Immunol 32, 2532-2542, 2002.
- Nedvetzki, S., Gonen, E., Assayag, N., Reich, R., Williams, R. O., Thurmond, R. L., Huang, J. F., Neudecker, B. A., Wang, F. S., Turley, E. A., Naor, D. RHAMM, a receptor for hyaluronan-mediated motility, compensates for CD44 in inflamed CD44-knockout mice: a different interpretation of redundancy. Proc Natl Acad Sci USA 101, 18081-18086, 2004.
- Budd, R. C., Cerottini, J. C., Horvath, C., Bron, C., Pedrazzini, T., Howe, R. C., MacDonald, H. R. Distinction of virgin and memory T lymphocytes. Stable acquisition of the Pgp-1 glycoprotein concomitant with antigenic stimulation. J Immunol 138, 3120-3129, 1987.
- Brown, K. L., Maiti, A., Johnson, P. Role of sulfation in CD44-mediated hyaluronan binding induced by inflammatory mediators in human CD14+ peripheral blood monocytes. J. Immunol. 167, 5367-5374, 2001.
- Khan, A. I., Kerfoot, S. M., Heit, B., Liu, L., Andonegui, G., Ruffell, B., Johnson, P., Kubes, P. Role of CD44 and hyaluronan in neutrophil recruitment. J Immunol 173, 7594-7601, 2004.
- Bonder, C. S., Clark, S. R., Norman, M. U., Johnson, P., Kubes, P. Use of CD44 by CD4+ Th1 and Th2 lymphocytes to roll and adhere. Blood 107, 4798-4806, 2006.
- Lesley, J., Howes, N., Perschl, A., Hyman, R. Hyaluronan binding function of CD44 is transiently activated on T cells during an in vivo immune response. J Exp Med 180, 383-387, 1994.
- DeGrendele, H. C., Estess, P., Siegelman, M. H. Requirement for CD44 in activated T cell extravasation into an inflammatory site. Science 278, 672-675, 1997.
- Seth, A., Gote, L., Nagarkatti, M., Nagarkatti, P. S. T-cell-receptor-independent activation of cytolytic activity of cytotoxic T lymphocytes mediated through CD44 and gp90MEL-14. Proc Natl Acad Sci USA 88, 7877-7881, 1991.
- Sconocchia, G., Titus, J. A., Segal, D. M. CD44 is a cytotoxic triggering molecule in human peripheral blood NK cells. J Immunol 153, 5473-5481, 1994.
- Larkin, J., Renukaradhya, G. J., Sriram, V., Du, W., Gervay-Hague, J., Brutkiewicz, R. R. CD44 differentially activates mouse NK T cells and conventional T cells. J Immunol 177, 268-279, 2006.
- Matsumoto, G., Nghiem, M. P., Nozaki, N., Schmits, R., Penninger, J. M. Cooperation between CD44 and LFA-1/CD11a adhesion receptors in lymphokine-activated killer cell cytotoxicity. J Immunol 160, 5781-5789, 1998.
- Firan, M., Dhillon, S., Estess, P., and Siegelman, M. H. Suppressor activity and potency among regulatory T cells is discriminated by functionally active CD44. Blood 107, 619-627, 2006.
- Bollyky, P. L., Lord, J. D., Masewicz, S. A., Evanko, S. P., Buckner, J. H., Wight, T. N., Nepom, G. T. Cutting Edge: High Molecular Weight Hyaluronan Promotes the Suppressive Effects of CD4+CD25+ Regulatory T Cells. J Immunol 179, 744-747, 2007.
- Galandrini, R., Galluzzo, E., Albi, N., Grossi, C. E., Velardi, A. Hyaluronate is costimulatory for human T cell effector functions and binds to CD44 on activated T cells. J. Immunol. 153, 21-31, 1994.
- Do, Y., Nagarkatti, P. S., Nagarkatti, M. Role of CD44 and hyaluronic acid (HA) in activation of alloreactive and antigen-specific T cells by bone marrow-derived dendritic cells. J Immunother 27, 1-12, 2004.
- Hegde, V. L., Singh, N. P., Nagarkatti, P. S., and Nagarkatti, M. CD44 mobilization in allogeneic dendritic cell-T cell immunological synapse plays a key role in T cell activation. J Leukoc Biol 84:134-142, 2008.
- Mummert, M. E., Mummert, D., Edelbaum, D., Hui, F., Matsue, H., Takashima, A. Synthesis and surface expression of hyaluronan by dendritic cells and its potential role in antigen presentation. J Immunol 169, 4322-4331, 2002.
- Termeer, C., Benedix, F., Sleeman, J., Fieber, C., Voith, U., Ahrens, T., Miyake, K., Freudenberg, M., Galanos, C., Simon, J. C. Oligosaccharides of Hyaluronan activate dendritic cells via toll-like receptor 4. J Exp Med 195, 99-111, 2002.
- DeGrendele, H. C., Estess, P., Picker, L. J., Siegelman, M. H. CD44 and its ligand hyaluronate mediate rolling under physiologic flow - a novel lymphocyte-endothelial cell primary adhesion pathway. J. Exp. Med. 183, 1119-1130, 1996.
- Pure, E., Cuff, C. A. A crucial role for CD44 in inflammation. Trends Mol. Med. 7, 213-221, 2001.
- Naor, D., Nedvetzki, S., Walmsley, M., Yayon, A., Turley, E. A., Golan, I., Caspi, D., Sebban, L. E., Zick, Y., Garin, T., Karussis, D., Assayag-Asherie, N., Raz, I., Weiss, L., Slavin, S., Golan, I. CD44 involvement in autoimmune inflammations: the lesson to be learned from CD44-targeting by antibody or from knockout mice. Ann N Y Acad Sci 1110, 233-247, 2007.
- Hutas, G., Bajnok, E., Gal, I., Finnegan, A., Glant, T. T., Mikecz, K. CD44-specific antibody treatment and CD44 deficiency exert distinct effects on leukocyte recruitment in experimental arthritis. Blood, published on line, ahead of print, 2008).
- Teder, P., Vandivier, R. W., Jiang, D., Liang, J., Cohn, L., Pure, E., Henson, P. M., Noble, P. W. Resolution of lung inflammation by CD44. Science 296, 155-158, 2002.
- Butcher, E. C. Leukocyte-endothelial cell recognition: three (or more) steps to specificity and diversity. Cell 67, 1033-1036, 1991.
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration. Cell 76, 301-314, 1994.
- Miyasaka, M., Tanaka, T. Lymphocyte trafficking across high endothelial venules: dogmas and enigmas. Nat Rev Immunol 4, 360-370, 2004.
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat Immunol 6, 1182-1190, 2005.
- Ley, K. Molecular mechanisms of leukocyte recruitment in the inflammatory process. Cardiovasc Res 32, 733-742, 1996.
- Johnson, P., Maiti, A., Brown, K. L., Li, R. A role for the cell adhesion molecule CD44 and sulfation in leukocyte-endothelial cell adhesion during an inflammatory response? Biochem. Pharm. 59, 455-465, 2000.
- Kubes, P. The complexities of leukocyte recruitment. Semin Immunol 14, 65-72, 2002.
- Liu, L., Kubes, P. Molecular mechanisms of leukocyte recruitment: organ-specific mechanisms of action. Thromb Haemost 89, 213-220, 2003.
- Clark, R. A., Alon, R., Springer, T. A. CD44 and hyaluronan-dependent rolling interactions of lymphocytes on tonsillar stroma. J Cell Biol 134, 1075-1087, 1996.
- Nandi, A., Estess, P., Siegelman, M. H. Hyaluronan anchoring and regulation on the surface of vascular endothelial cells is mediated through the functionally active form of CD44. J. Biol. Chem. 275, 14939-14948, 2000.
- Nandi, A., Estess, P., Siegelman, M. Bimolecular Complex between Rolling and Firm Adhesion Receptors Required for Cell Arrest; CD44 Association with VLA-4 in T Cell Extravasation. Immunity 20, 455-465, 2004.
- Zheng, Z., Katoh, S., He, Q., Oritani, K., Miyake, K., Lesley, J., Hyman, R., Hamik, A., Parkhouse, R. M., Farr, A. G., et al. Monoclonal antibodies to CD44 and their influence on hyaluronan recognition. J Cell Biol 130, 485-495, 1995.
- Mikecz, K., Brennan, F. R., Kim, J. H., Glant, T. T. Anti-CD44 Treatment Abrogates Tissue Oedema and Leukocyte Infiltration In Murine Arthritis. Nat. Med. 1, 558-563, 1995.
- Stoop, R., Kotani, H., McNeish, J. D., Otterness, I. G., Mikecz, K. Increased resistance to collagen-induced arthritis in CD44-deficient DBA/1 mice. Arthritis Rheum 44, 2922-2931, 2001.
- Brennan, F. R., O'Neill, J. K., Allen, S. J., Butter, C., Nuki, G., Baker, D. CD44 is involved in selective leucocyte extravasation during inflammatory central nervous system disease. Immunology 98, 427-435, 1999.
- Brocke, S., Piercy, C., Steinman, L., Weissman, I. L., Veromaa, T. Antibodies to CD44 and integrin alpha(4), but not L-selectin, prevent central nervous system inflammation and experimental encephalomyelitis by blocking secondary leukocyte recruitment. Proc Natl Acad Sci USA 96, 6896-6901, 1999.
- Siegelman, M. H., Stanescu, D., Estess, P. The CD44-initiated pathway of T-cell extravasation uses VLA-4 but not LFA-1 for firm adhesion. J. Clin. Invest. 105, 683-691, 2000.
- Cuff, C. A., Kothapalli, D., Azonobi, I., Chun, S., Zhang, Y., Belkin, R., Yeh, C., Secreto, A., Assoian, R. K., Rader, D. J., Pure, E. The adhesion receptor CD44 promotes atherosclerosis by mediating inflammatory cell recruitment and vascular cell activation. J Clin Invest 108, 1031-1040, 2001.
- Katoh, S., Matsumoto, N., Kawakita, K., Tominaga, A., Kincade, P. W., Matsukura, S. A role for CD44 in an antigen-induced murine model of pulmonary eosinophilia. J Clin Invest 111, 1563-1570, 2003.
- Hollingsworth, J. W., Li, Z., Brass, D. M., Garantziotis, S., Timberlake, S. H., Kim, A., Hossain, I., Savani, R. C., Schwartz, D. A. CD44 Regulates Macrophage Recruitment to the Lung in Lipopolysaccharide-Induced Airway Disease. Am J Respir Cell Mol Biol 37, 248-253, 2007.
- Jameson, J. M., Cauvi, G., Sharp, L. L., Witherden, D. A., Havran, W. L. Gammadelta T cell-induced hyaluronan production by epithelial cells regulates inflammation. J Exp Med 201, 1269-1279, 2005.
- Kipnis, A., Basaraba, R. J., Turner, J., Orme, I. M. Increased neutrophil influx but no impairment of protective immunity to tuberculosis in mice lacking the CD44 molecule. J Leukoc Biol 74, 992-997, 2003.
- Wang, Q., Teder, P., Judd, N. P., Noble, P. W., Doerschuk, C. M. CD44 deficiency leads to enhanced neutrophil migration and lung injury in Escherichia coli pneumonia in mice. Am J Pathol 161, 2219-2228, 2002.
- Alstergren, P., Zhu, B., Glougauer, M., Mak, T. W., Ellen, R. P., Sodek, J. Polarization and directed migration of murine neutrophils is dependent on cell surface expression of CD44. Cell Immunol 231, 146-157, 2004.
- Tanaka, Y., Adams, D. H., Shaw, S. Proteoglycans on endothelial cells present adhesion-inducing cytokines to leukocytes. Immunol. Today 14, 111-115, 1993.
- Tanaka, Y., Adams, D. H., Hubscher, S., Hirano, H., Siebenlist, U., Shaw, S. T-cell adhesion induced by proteoglycan-immobilized cytokine MIP-1 beta. Nature 361, 79-82, 1993.
- Wahl, S. M., Wen, J., and Moutsopoulos, N. TGF-beta: a mobile purveyor of immune privilege. Immunol Rev 213, 213-227, 2006.
- Munger, J. S., Huang, X., Kawakatsu, H., Griffiths, M. J., Dalton, S. L., Wu, J., Pittet, J. F., Kaminski, N., Garat, C., Matthay, M. A., Rifkin, D. B., Sheppard, D. The integrin alpha v beta 6 binds and activates latent TGF beta 1: a mechanism for regulating pulmonary inflammation and fibrosis. Cell 96, 319-328, 1999.
- Koli, K., Saharinen, J., Hyytiainen, M., Penttinen, C., Keski-Oja, J. Latency, activation, and binding proteins of TGF-beta. Microsc Res Tech 52, 354-362, 2001.
- Yu, Q., Stamenkovic, I. Cell surface-localized matrix metalloproteinase-9 proteolytically activates TGF-beta and promotes tumor invasion and angiogenesis. Genes Dev 14, 163-176, 2000.
- Acharya, P. S., Majumdar, S., Jacob, M., Hayden, J., Mrass, P., Weninger, W., Assoian, R. K., Pure, E. Fibroblast migration is mediated by CD44-dependent TGF beta activation. J Cell Sci 121, 1393-1402, 2008.
- Toole, B. P. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer 4, 528-539, 2004.
- Stern, R., Asari, A. A., Sugahara, K. N. Hyaluronan fragments: an information-rich system. Eur J Cell Biol 85, 699-715, 2006.
- Laurent, T. C., Fraser, J. R. E. Hyaluronan. FASEB J. 6, 2397-2404, 1992.
- Underhill, C. B., Nguyen, H. A., Shizari, M., Culty, M. CD44 Positive Macrophages Take Up Hyaluronan During Lung Development. Dev Biol 155, 324-336, 1993.
- Culty, M., Nguyen, H. A., Underhill, C. B. The hyaluronan receptor (CD44) participates in the uptake and degradation of hyaluronan. J Cell Biol 116, 1055-1062, 1992.
- Jiang, D., Liang, J., Noble, P. W. Hyaluronan in tissue injury and repair. Annu Rev Cell Dev Biol 23, 435-461, 2007.
- Liang, J., Jiang, D., Griffith, J., Yu, S., Fan, J., Zhao, X., Bucala, R., Noble, P. W. CD44 is a negative regulator of acute pulmonary inflammation and lipopolysaccharide-TLR signaling in mouse macrophages. J Immunol 178, 2469-2475, 2007.
- Kawana, H., Karaki, H., Higashi, M., Miyazaki, M., Hilberg, F., Kitagawa, M., Harigaya, K. CD44 Suppresses TLR-Mediated Inflammation. J Immunol 180, 4235-4245, 2008.
- Vachon, E., Martin, R., Plumb, J. D., Kwok, V., Vandivier, R. W., Glogauer, M., Kapus, A., Wang, X., Chow, C. W., Grinstein, S., Downey, G. P. CD44 is a Phagocytic Receptor. Blood 107: 4149-4158, 2006.
- Vachon, E., Martin, R., Kwok, V., Cherepanov, V., Chow, C. W., Doerschuk, C. M., Plumb, J., Grinstein, S., Downey, G. P. CD44-mediated phagocytosis induces inside-out activation of complement receptor-3 in murine macrophages. Blood 110, 4492-4502, 2007.
- Hart, S. P., Dougherty, G. J., Haslett, C., Dransfield, I. CD44 regulates phagocytosis of apoptotic neutrophil granulocytes, but not apoptotic lymphocytes, by human macrophages. J Immunol 159, 919-925, 1997.
- Krammer, P. H., Arnold, R., Lavrik, I. N. Life and death in peripheral T cells. Nat Rev Immunol 7, 532-542, 2007.
- Chen, D., McKallip, R. J., Zeytun, A., Do, Y., Lombard, C., Robertson, J. L., Mak, T. W., Nagarkatti, P. S., Nagarkatti, M. CD44-deficient mice exhibit enhanced hepatitis after concanavalin A injection: evidence for involvement of CD44 in activation-induced cell death. J Immunol 166, 5889-5897, 2001.
- McKallip, R. J., Do, Y., Fisher, M. T., Robertson, J. L., Nagarkatti, P. S., Nagarkatti, M. Role of CD44 in activation-induced cell death: CD44-deficient mice exhibit enhanced T cell response to conventional and superantigens. Int Immunol 14, 1015-1026, 2002.
- Do, Y., Rafi-Janajreh, A. Q., McKallip, R. J., Nagarkatti, P. S., Nagarkatti, M. Combined deficiency in CD44 and Fas leads to exacerbation of lymphoproliferative and autoimmune disease. Int Immunol 15, 1327-1340, 2003.
- Nakano, K., Saito, K., Mine, S., Matsushita, S., Tanaka, Y. Engagement of CD44 up-regulates Fas ligand expression on T cells leading to activation-induced cell death. Apoptosis 12, 45-54, 2007.
- DeGrendele, H. C., Kosfiszer, M., Estess, P., Siegelman, M. H. CD44 activation and associated primary adhesion is inducible via T cell receptor stimulation. J. Immunol. 159, 2549-2553, 1997.
- Ariel, A., Lider, O., Brill, A., Cahalon, L., Savion, N., Varon, D., Hershkoviz, R. Induction of interactions between CD44 and hyaluronic acid by a short exposure of human T cells to diverse pro-inflammatory mediators. Immunology 100, 345-351, 2000.
- Kryworuchko, M., Gee, K., Diaz-Mitoma, F., Kumar, A. Regulation of CD44-hyaluronan interactions in Burkitt's lymphoma and Epstein-Barr virus-transformed lymphoblastoid B cells by PMA and interleukin-4. Cell Immunol. 194, 54-66, 1999.
-
Levesque, M. C., Haynes, B. F. In vitro culture of human peripheral blood monocytes induces hyaluronan binding and up-regulates monocyte variant CD44 isoform expression. J. Immunol. 156, 1557-1565, 1996.
- Sague, S. L., Tato, C., Pure, E., Hunter, C. A. The regulation and activation of CD44 by natural killer (NK) cells and its role in the production of IFN-gamma. J Interferon Cytokine Res 24, 301-309 , 2004.
- Watanabe, Y., Hashizume, M., Kataoka, S., Hamaguchi, E., Morimoto, N., Tsuru, S., Katoh, S., Miyake, K., Matsushima, K., Tominaga, M., Kurashige, T., Fujimoto, S., Kincade, P. W., Tominaga, A. Differentiation stages of eosinophils characterized by hyaluronic acid binding via CD44 and responsiveness to stimuli. DNA Cell Biol 20, 189-202, 2001.
- Fukui, M., Whittlesey, K., Metcalfe, D. D., Dastych, J. Human mast cells express the hyaluronic-acid-binding isoform of CD44 and adhere to hyaluronic acid. Clin Immunol. 94, 173-178, 2000.
- Dasgupta, A., Takahashi, K., Cutler, M., Tanabe, K. K. O-linked glycosylation modifies CD44 adhesion to hyaluronate in colon carcinoma cells. Biochem. Biophys. Res. Comm. 227, 110-117, 1996.
- Xu, H., Manivannan, A., Liversidge, J., Sharp, P. F., Forrester, J. V., Crane, I. J. Involvement of CD44 in leukocyte trafficking at the blood-retinal barrier. J Leukoc Biol 72, 1133-1141, 2002.
- McKallip, R. J., Fisher, M., Gunthert, U., Szakal, A. K., Nagarkatti, P. S., Nagarkatti, M. Role of CD44 and its v7 isoform in staphylococcal enterotoxin B-induced toxic shock: CD44 deficiency on hepatic mononuclear cells leads to reduced activation-induced apoptosis that results in increased liver damage. Infect Immun 73, 50-61, 2005.






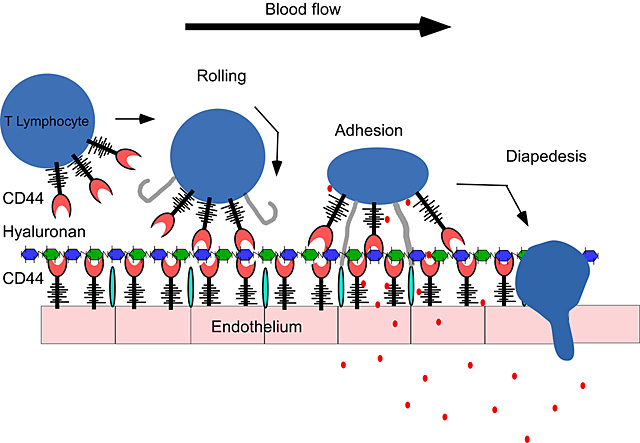
![]() )と共に、内皮細胞のインテグリン(
)と共に、内皮細胞のインテグリン(![]() )とそのカウンターレセプター(
)とそのカウンターレセプター(![]() ) を介して強固な接着を促し、やがてそれは炎症及び感染部位への漏出と遊走に結びつく。
) を介して強固な接着を促し、やがてそれは炎症及び感染部位への漏出と遊走に結びつく。
