
氏名:Larry S. Sherman
Larry S. Sherman博士は、Oregon National Primate Research Centerの神経科学分野の上席研究員であり、Oregon Health & Science University のDepartment of Cell and Developmental Biology、Neuroscience Graduate Program、Program for Molecular and Cellular Biologyの準教授である。博士は神経発生生物学、グリア細胞生物学、脱髄疾患、神経腫瘍学分野において、60報以上の論文報告を持っており、いくつもの研究委員会や助成金審査委員会の委員を務め、雑誌Gliaの編集委員である。2007年Sherman博士は、Oregon Chapter of the Society for NeuroscienceのCo-Presidentに選出された。

氏名:Kerstin Feistel
Kerstin Feistel博士はOregon Health and Science UniversityのLarry Sherman博士の研究室のポストドクトラルフェローである。博士は、Boehringer Ingelheim Fundsからの奨学金を受ける大学院生として、ドイツのシュトゥットガルトにあるUniversity of HohenheimでMartin Blum教授の下研究を行い、2003年に生物学の学位を取得した。彼女の学位論文は胚の左右軸形成期における成長因子のシグナル伝達に着目したものであり、これにより2007年に博士号を受けている。博士は今、神経幹細胞のニッチにおけるシグナル伝達分子としてのヒアルロン酸のマウスの発生と疾患における役割について研究をしている。
哺乳類の中枢神経系(CNS)は神経幹細胞(NSCs)由来の様々な神経細胞とグリア細胞(星状膠細胞と乏突起膠細胞)から構成されている。NSCsは胚神経系に存在する多分化能と自己複製能を持つ細胞であり、「脳室帯」(VZ; Fig. 1)に分化する領域である神経管腔内側に存在する。NSCsはまた、未分化あるいは未成熟群として残る神経前駆細胞となる。神経前駆細胞は後に、損傷や正常な発生や加齢の過程で、死んだ細胞、あるいは傷害を受けた細胞の代替として用いられる 1, 2。
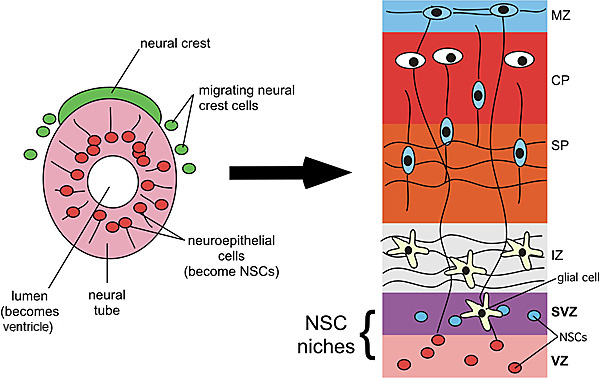
Figure 1
CNS発生初期。CNSは神経管(左図参照)から発生する。その一方で、末梢神経系は神経管背側から移動してくる一過性の細胞集団である神経堤細胞から発生する。脳の発生過程で、神経管管腔は脳脊髄液の満ちる脳室となる。脳室の隣接部位はNSCsが存在する、脳室帯(VZ)と脳室下帯(SVZ)である。大脳皮質では、VZとSVZでNSCsから分化した神経細胞とグリア細胞が成長域へ移動する。成長域には、将来白質となる中間帯(IZ)、大脳皮質の深部5層を含む副板(SP)と皮質板(CP)、脳軟膜直下の水平線維と初期神経細胞を含む辺縁帯(MZ)が含まれるようになる。VZとSVZはともに、NSCsが対称性分裂による自己複製と非対称性分裂による分化を起こすNSCニッチを構成する。
NSCsと神経前駆細胞は、生涯を通じて、成体哺乳類のCNSに残っている。成体のNSCsは、脳室に隣接する「脳室下帯」(SVZ)と学習と記憶に関わる海馬の一部である歯状回とに存在する。成体の神経前駆細胞は、分化できる細胞の種類はさらに制限されてはいるが、脳と脊髄全域で観察される 2。
てんかん、外傷、虚血に反応して、げっ歯類SVZに存在する細胞は、増殖を開始する。それらの細胞は順次傷害部位に移動し、神経細胞や星状膠細胞に分化する。ミエリン鞘の破壊が特徴的な脱髄疾患では、SVZにおけるNSCsの同様な「活性化」が観察される。ミエリン鞘は神経線維をくるみ、伝導速度を上げる構造物である。脱髄疾患のげっ歯類モデルや多発性硬化症の患者では、SVZからのNSCsと他の領域からの神経前駆細胞が、脱髄傷害部位に集まってくる。これらの細胞はミエリンを形成する乏突起膠細胞に成熟する前駆細胞に分化する 3-7。 同様に、SVZ外に存在する神経前駆細胞が傷害部位に集められる。しかしながら、慢性化、あるいは時間の経過した傷害では、NSCsと神経前駆細胞は死んだ細胞や傷害を受けた細胞の代わりとなることができない 8-12。 慢性傷害部位の微小環境においては、NSCsと神経前駆細胞によるCNSの修復が抑制シグナルにより阻害されているという仮説を支持する証拠が次々と提示されている。CNS修復促進の戦略を立てるには、正常な発生と傷害後のNSCsと神経前駆細胞の分化と成熟を制御するシグナルを理解することが必要となる。
CNS傷害後、典型的にはastrogliosisと呼ばれる過程が続いて起きる。その過程では、星状膠細胞が形態的及び代謝的変化を起こし、傷害を受けていない細胞を損害を受けた細胞から隔離する「グリア性瘢痕」の形成を含んでいる。加えて、星状膠細胞は、細胞外グルタミン酸の除去、細胞外のイオンと溶液のバランスの維持、フリーラジカルの除去、炎症誘発や抗炎症メディエーターの生成を含む恒常性維持機能を豊富に持っている 13, 14。これらの機能は傷害を受けたCNS組織にとって十分に有益ではあるが、グリア性瘢痕はしばしば軸索の再形成 15や再ミエリン化 16の失敗と関連している。結果、反応の早い星状膠細胞はそれほどひどくない急性CNS傷害の回復には必要かもしれないが、より大きな慢性傷害に見られるグリア性瘢痕は、CNSの回復に対し長期的には有害な影響を及ぼしている。
ここで我々は、成体や胚のCNS全域に存在しているグリコサミノグリカンである、ヒアルロン酸が様々な成体や胚性の幹細胞集団を維持制御しているという仮説の証拠を概観する。そして我々はさらに、幹細胞ニッチにおいてヒアルロン酸のもつ幹細胞の静止と分化に対する制御機構が、CNS傷害部位の微小環境において神経前駆細胞の分化と成熟を抑え、CNSの修復を妨げていることを主張したい。
1. ヒアルロン酸は非神経幹細胞ニッチの構成要素である。
多細胞生物において、細胞に幹細胞性を与える構造的生化学的微小環境を幹細胞ニッチと呼ぶ。幹細胞ニッチは脊椎動物の様々な器官に存在し、存在部位が血管近傍であること、共通の成長因子があること、豊富な細胞外基質をもつことなどの、共通の特徴がある。ヒアルロン酸は多くの幹細胞集団のニッチを構成する要素として機能している。たとえば、ヒアルロン酸は、骨に豊富に存在し17、造血幹細胞(HSCs;すべての血球を再構成することができる)と、間葉系幹細胞(MSCs;血球を除く中胚葉由来の細胞を再構成することができる)の「幹性」に影響を及ぼすことができる。HSCsとMSCsはともに骨髄内の特別な場所に存在している。ヒアルロン酸は、マウスとヒトの両方のHSCsの表面に存在している 18, 19。このヒアルロン酸の果たす役割が証明されたのは、骨髄低形成と白血球減少を誘発する化学療法剤、5フルオロウラシルが、マウスのHSCニッチでヒアルロン酸の減少をもたらすことをしめした研究においてであった 20。さらに、これらのマウスにヒアルロン酸を全身注射したところ、造血作用の回復が促進されたのである 20。また、げっ歯類に対し、X線照射により骨髄細胞を涸渇させたのち、HSCsを移植した場合、表面にヒアルロン酸を発現しているHSCsを移植した方が高い生存率を示したのである 19 。高い生存率は、HSCsにニッチを提供しているとされる骨内膜にHSCsをとどめておくというヒアルロン酸の効果と相関があった。この所見に一致して移植する前にHSCsをヒアルロニダーゼで処理した場合では、骨内膜にとどまる細胞の数は減少した 19。ヒアルロン酸が移植された幹細胞を誘導しとどめておく機構は、ヒアルロン酸によるHSCにおける直接のシグナル伝達の活性化によるものかも知れない。ニッチにおいて細胞同士が近接した状態にあるHSCsをまねて、HSCs上のヒアルロン酸にヒアルロン酸結合タンパク質を結合させると、HSCsの増殖と分化がほとんど止まったのである 19。これらの結果は、幹細胞におけるヒアルロン酸の発現が、細胞活動に強い影響を及ぼすことを示している。
ヒアルロン酸は軟骨傷害の回復促進のために 21、重合ヒアルロン酸は傷害部位の組織回復を促すMSC移植の足場として 22, 23、治療に用いられている。ヒアルロン酸基質は移植された幹細胞の生存を保証しているので、引き続いて起きる内在性ヒアルロニダーゼによるヒアルロン酸基質の分解は、包含している細胞を組織再生のため解放するかのようである。同様に、ヒアルロン酸ハイドロゲル中で培養されているヒト胚性幹細胞 (hESCs)は未分化状態にとどまるが、ヒアルロン酸基質が酵素により取り除かれると、hESCsは分化能を回復する 24。
ヒアルロン酸の豊富な微小環境に置かれた細胞が、細胞外のヒアルロン酸から構造の支持を得ることと、増殖の少ない静止状態になることとが、HSCs、MSCs、hESCsに対するヒアルロン酸の影響の例からも良く分かる。この静止状態には、生存期間の延長と必要に応じて増殖や分化可能な状態での幹細胞集団の維持が伴っている。
2. ヒアルロン酸は未分化状態にある神経前駆細胞を維持する。
発生と疾病の研究から、NSCと神経前駆細胞集団を制御するヒアルロン酸の役割が徐々に分かってきている。CNS発生中、ヒアルロン酸は広く分布している。ニワトリにおいては、ヒアルロン酸はVZの発生時にも存在するが、のちに白質となる中間帯(IZ、Fig. 1)に最も高濃度で存在する 25。しかし、哺乳類を含め成体では、ヒアルロン酸は白質内で有髄線維周囲により多く存在している。灰白質のヒアルロン酸は、神経の興奮と可塑性の制御に関与しているとみなされているペリニューロナルネットにある神経細胞体の周囲に存在している 26-30。
ヒアルロン酸の局在と濃度の違いはNSCの移動に影響を及ぼしていると考えられている。神経堤細胞の神経管背側からの移動制御にヒアルロン酸が一役を担っているという詳細な証拠がある(Fig. 1)。神経堤細胞は、細胞末梢神経系(PNS)のすべての細胞とメラニン細胞と呼ばれる皮膚の色素細胞やその他の様々な細胞になる一過性の幹細胞集団である。PNSとなる細胞は硬節前方を移動し、末梢の神経節と神経を形成する。ヒアルロン酸は、神経管背側からの神経堤細胞の移動を促進する。このことはヒアルロン酸が神経堤細胞の移動開始に必要である可能性を示唆する 31。この知見と一致するように、Oriとその共同研究者は 32、モルフォリノを使ったツメガエルのヒアルロン酸合成酵素2遺伝子の阻害により、神経堤細胞の移動が阻害されることを示した。VZや他の胚領域からのNSCの移動に対するヒアルロン酸の関与は明らかになっていない。
神経機能と細胞の移動制御に加えて、ヒアルロン酸はNSCと神経前駆細胞の分化と成熟に関与していると考えられている。神経前駆細胞の成熟におけるヒアルロン酸の役割に対する最初のヒントはMarretとその共同研究者 33によってもたらされた。かれらは、in vitroで星状膠細胞や乏突起膠細胞に分化する、いわゆるO2A細胞が、培養液にヒアルロン酸を付加することにより乏突起膠細胞に分化できないことを発見した。我々の研究室で引き続き、多発性硬化症の患者と多発性硬化症のモデルマウスである実験的自己免疫性脳脊髄炎において、ヒアルロン酸が慢性脱髄部位に集積することを示した 16。ヒアルロン酸の集積は、ミエリン特異的プロモーターの制御下でヒアルロン酸受容体CD44を異所性に発現しているCNS組織に見られ、CNS全体に髄鞘形成異常を起こしていた 16, 34。また、重篤なastrogliosisと髄鞘喪失を伴うラットの脊髄傷害においてもまた、ヒアルロン酸の集積がみられる 35。傷害部位で完全に脱髄された部位ではヒアルロン酸の濃度は高く、再ミエリン化されている部位ではヒアルロン酸の濃度は低い 16。我々は、in vivo とin vitroでヒアルロン酸が乏突起膠細胞の前駆細胞からの成熟を阻害することを発見した 16。その結果は、ヒアルロン酸が神経前駆細胞を未分化な、あるいは未成熟な状態に保つことで再ミエリン化を阻害するという仮説を支持している。
NSCsは幹細胞ニッチや傷害微小環境でヒアルロン酸と触れることで同様の影響を受ける可能性がある。そしてそのような場所では、NSCs自身がヒアルロン酸を合成している可能性がある。中間径フィラメントタンパク質ネスチンは胚性神経幹細胞、神経前駆細胞のマーカーとなる。ネスチンプロモーターによる遺伝子活性化に不可欠な転写因子、Sp1、Sp3は 36、ヒアルロン酸合成酵素2プロモーターによる遺伝子活性化にも必要な因子である 37。最近我々はNSCsがヒアルロン酸を合成するかを確認するためにin vitro NSCニッチモデルでヒアルロン酸の発現の有無を確認した。In vitroで育てたNSCsは「ニューロスフィア」を形成する。ニューロスフィアは分化した神経細胞と未分化の神経細胞からなる細胞の球体で、細胞外基質との相互作用により維持されている細胞と球体内で分化した細胞とを含んでいる。多くの点で、ニューロスフィアはin vivoにおけるNSCニッチ環境を要約している 38。Fig. 2では、これらニューロスフィアの外観を示した。NSCsがありヒアルロン酸が豊富に存在しているところがVZやSVZと似ていなくもない。したがって、NSCsによって生成されたヒアルロン酸が、先に述べた他の幹細胞集団を維持する方法で、NSCs自身の幹性を維持することもあり得ることであろう。
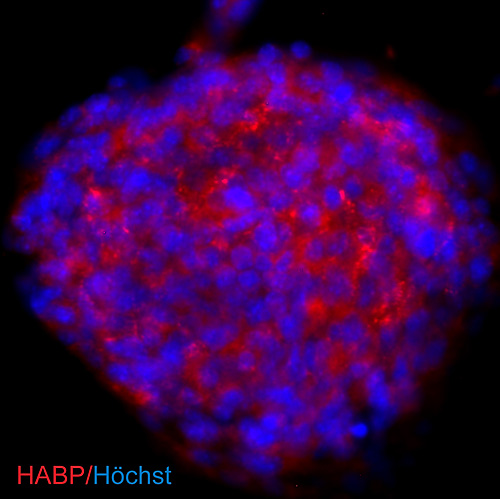
Figure 2
ヒアルロン酸はニューロスフェアとして培養された神経幹細胞、神経前駆細胞により合成される。NSCsは生後1日のマウスの脳より採取され、浮遊培養ニューロスフェアとして培養された。視覚化するために、スフェアの細胞により合成されたヒアルロン酸は、ビオチン標識されたヒアルロン酸結合タンパク質とともにインキュベートされ、Cy3(赤)標識ストレプトアビジンにより検出された。核はHoechst 33342(青)にてカウンターステインされた。
3. ヒアルロン酸はプロテオグリカンを介してNSCsと神経前駆細胞に影響を与えている可能性がある。
ヒアルロン酸はアグリカン/レクチカン/ヒアレクタン プロテオグリカンファミリーと巨大多分子複合体を形成する中心となる。これらのプロテオグリカン(アグリカン、ニューロカン、バーシカン、ブレビカン)のコアタンパク質は、ヒアルロン酸分子との結合をもたらすヒアルロン酸結合領域を保持している。これらの結合はリンクプロテインにより安定化されている。リンクプロテインは、ヒアルロン酸鎖とプロテオグリカンの両方と結合している。コンドロイチン硫酸プロテオグリカン(CSPGs) が、マウスのSVZで見つかっている 39, 40。またアグリカン遺伝子は出生時ラット脳の胚帯で転写されていることが示されている 41。さらに、ニューロカンはニューロスフィアとして培養された神経幹細胞、神経前駆細胞で免疫細胞化学的に検出されている 39, 40。アグリカンとブレビカンの転写産物もまたニューロスフィアに発現している 39。アグリカンとニューロカンの発現は、分化誘導状態下14日間ニューロスフィアを培養すると減少する 39。これらのことは、アグリカン/ レクチカン/ ヒアレクタン ファミリーがNSCニッチの一部であることと、神経幹/前駆細胞が自分のニッチ環境を生成できることを示している。すべてのアグリカン/ レクチカン/ ヒアレクタン プロテオグリカンがヒアルロン酸と結合可能であることは、ヒアルロン酸がNSCニッチの細胞外基質の構成と形成に重要な役割をはたしている可能性を強く支持する。ヒアルロン酸が、ヒアルロン酸受容体を直接活性化するなり、あるいは間接的にNSCsを閉じ込めることにより細胞間連絡を絶つなり、プロテオグリカンの活性を仲介するなりして、「幹性」因子の機能を満たしている可能性がある。
Stern 42 は、系統発生樹上にヒアルロン酸が現れるのは、後生動物で、最終分化した体細胞から多機能幹細胞を分離するための特別なニッチの必要性が生じたことと関連している可能性がある、と提唱している。発生過程にあるCNSや傷害をうけたCNSにおけるこのような区分けをどのように思い描けばよいのだろうか?胚形成時と成体時で脳内ヒアルロン酸の総量が劇的に変化し 43、そしてこれまで我々が議論してきたように、CNSの傷害に応じても総量が変化する。発生過程でのこれら総量の変化は、神経形成期の特殊な細胞集団とヒアルロン酸との配置と関連の動的な変化が関連している 25, 44。本稿で、in vitroでヒアルロン酸結合プロテオグリカンと同様にヒアルロン酸自身が神経幹/前駆細胞に発現し、in vivoでNSCニッチにヒアルロン酸結合タンパク質が局在しているという証拠について述べた。これからすると発生過程でNSCsになることが決まった細胞の周囲にヒアルロン酸とヒアルロン酸結合タンパク質が沈着するのはありそうなことである。
C成体ラット脳のNSCニッチにある細胞はフラクトン(Fig. 3)と呼ばれる構造体にしっかりと囲まれている。フラクトンはSVZに届く皮質毛細血管の基底膜から指のように伸びてきている 45。基底膜はヒアルロン酸を含んでいるとは限らないが、自由なヒアルロン酸の拡散を防いでいるようである 46。その結果、ヒアルロン酸がプロテオグリカンと結合するのに加えて、フラクトンは確実にNSCを静止状態に保っておくために、ヒアルロン酸をニッチにとどめておく役割をもっている可能性がある。
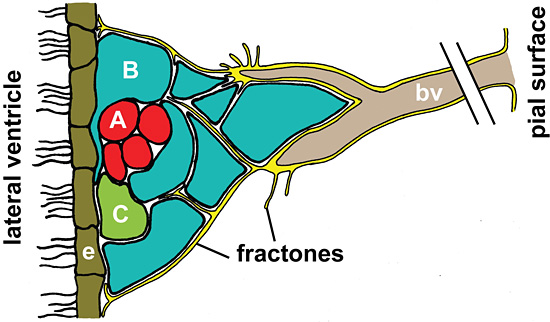
Figure 3
神経幹細胞ニッチにおけるフラクトンの模式図。フラクトン(黄)は、ラミニンが豊富な構造で血管(bv)の基底膜(黄)と続いている。フラクトンは脳室下帯(SVZ)に突き出していて、終末は側脳室を裏打ちしている線毛上衣細胞(e)に及んでいる。フラクトンは青色(Bタイプ)や緑色(Cタイプ)や赤色(Aタイプ)で示されているSVZの幹細胞や神経前駆細胞と直接に接している。ここで示されている神経幹細胞ニッチにおいて、Aタイプは嗅球に向けて移動しつつ増殖している神経芽細胞である。Cタイプは定常的に急速に細胞分裂している前駆細胞である。Bタイプは星状膠細胞様の特徴を持ち、成体脳の幹細胞と考えられている細胞である。Bタイプの細胞はゆっくりと分裂をしながら、広範囲の細胞突起により、移動しているAタイプの細胞を包み込む 48。基底膜および基底膜とSVZの細胞の近接領域は細胞外にHAの足場を提供すると考えうる。SVZにおけるHAの保持は幹細胞の静止状態に影響を及ぼし、外部刺激によるHAの変化は幹細胞から急激に分裂する神経前駆細胞を誘導すると考えうる。
ヒアルロン酸自身とプロテオグリカンとの結合によって生じるヒアルロン酸の分布が、いつどのようにしてNSCsがニッチを離れ、神経細胞あるいはグリア細胞に分化し始めるのかを決定しているのかもしれない。細胞が分化しCNSの別の領域に移動するとき、異なる量と質(すなわち分子サイズ)のヒアルロン酸が存在する領域に入る可能性がある。その時、ヒアルロン酸はさらなる成熟や機能に影響を及ぼす。細胞は、ペリニューロナルネットにおける自身の活動に影響を及ぼすヒアルロン酸の自分自身による産生を増大する可能性もある。可能性のあるさまざまなヒアルロン酸の機能については図4に示した。
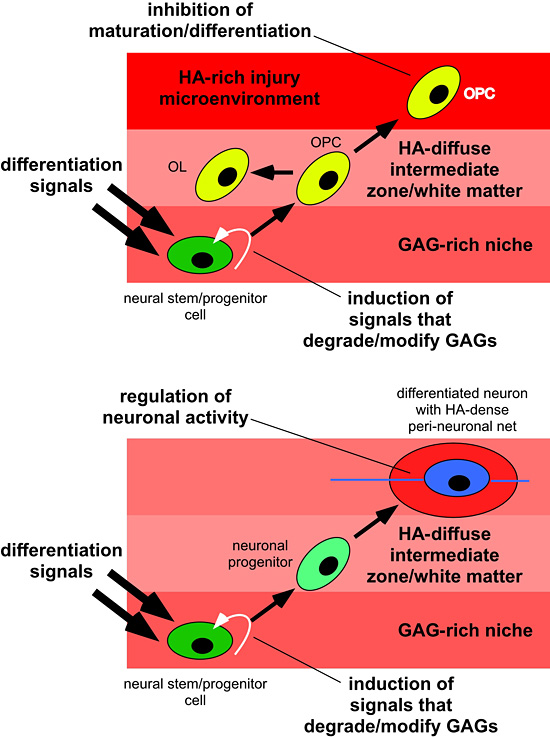
Figure 4
ヒアルロン酸はNSCsと分化した神経細胞とグリア細胞のいくつもの機能を制御する。パネル上部は、白質に移動するニッチ(すなわちSVZ)にあるNSCsの例である。この移動と分化の開始には、ヒアルロン酸合成酵素の活性かヒアルロニダーゼの活性のどちらかにより細胞周辺のヒアルロン酸による基質の変更を必要とする可能性がある。正常な白質中のヒアルロン酸基質の広がりの中で、これらの細胞は、ミエリンを合成する乏突起膠細胞に分化することにより、死亡または傷害を受けた乏突起膠細胞と交代するために待機している乏突起膠細胞かグリア前駆細胞に分化する。もし細胞がひどい神経膠症のある領域かヒアルロン酸の集積する領域に遭遇したとしたら、細胞は乏突起膠細胞に成熟することができずに、傷害部位の再ミエリン化はできないであろう。パネル下部は、細胞が移動と分化する際、どのようにして細胞周辺基質を変化させるかを示している。たとえば、SVZかVZのNSCsは、上で示したように、ヒアルロン酸による基質を変質するシグナルに加えて様々なシグナルを通じてニューロンに分化する。最終目的地である灰白質に到達すると、ニューロンは、神経活性の維持に必要となるペリニューロナルネットに必要なヒアルロン酸を強く発現する。
ヒアルロン酸の沈着はNSCと神経前駆細胞の分化の制限の一方法として起こる可能性があると我々は考えている。これは、NSCニッチでヒアルロン酸の合成と沈着はどのように制御されているかという問題に行き着く。一つの可能性として、NSCsの特異化の進行に伴ってヒアルロン酸合成が増加するという考えがある。これには、ヒアルロン酸合成酵素によるヒアルロン酸合成増大かヒアルロン酸合成酵素遺伝子の転写/翻訳の増大が必要となる。先に述べたように、少なくとも一つのNSCマーカーを制御する転写因子はヒアルロン酸合成酵素の発現を制御する。このことが示唆するのは、幹細胞状態を維持するのはニッチにおいてヒアルロン酸が集積するのを促進することになるということである。図2に示した我々の発見はこの考えと合っている。あるいは、ヒアルロン酸合成の量は神経発生を通じて一定で、ヒアルロン酸の集積を促進するために神経幹細胞の周辺で、ヒアルロン酸の分解かヒアルロン酸結合タンパク質の代謝が特異的に減少するという考えもある。この考えを支持するデータとして、Polanskyと共同研究者は 47、鶏の脳の初期発生時にヒアルロニダーゼの活性が上がり、孵化時に下がることを発見した。ヒアルロン酸合成酵素とヒアルロニダーゼの転写と活性のバランスは、いついかにしてNSCsがニッチを離れ、傷害部位に集められた細胞が神経系の修復に役立つかどうかを説明する可能性がある。
ヒアルロニダーゼが発生期のCNSやとくにNSCニッチにある細胞により制御されているように、ヒアルロン酸をその構成要素(D-グルクロン酸とD-N-アセチルグルコサミン)に分解するほかの酵素も制御されているという考えもある。たとえば、ニッチにあるNSCsそれ自身かそのほかの細胞がヒアルロン酸を分解して特有な生物学的作用を有するヒアルロン酸オリゴ糖を生成しうるヒアルロニダーゼを発現するという可能性もある。どのようにして異なるグループのヒアルロン酸受容体の活性がNSCと神経前駆細胞の分化に影響を及ぼすかという疑問と同様に、これらの疑問は、発生と疾病においてNSCの活動をいかにしてヒアルロン酸が制御しているのかを決定するためのキーとなる挑戦である。
謝辞
本稿に示した研究はLarry S. Shermanに対するNIH(NS056234)とNational Multiple Sclerosis Society (RG3512A2) の援助のもとで実施されました。有用なコメントと示唆をいただいたSteven Matsumotoに感謝します。