
氏名:Carl Verkoelen
Carl Verkoelen博士はRotterdamのVan’t Hoff Instituteで分析化学の学士号を取得、DelftのPolytechnical University では臨床化学の学士号を取得した。1990年に Erasmus University Rotterdamの泌尿器科学部門に移籍し、腎結石症における尿細管上皮の関与の研究に着手した。当初は腎におけるシュウ酸輸送に的を絞り、のちに研究の重点を腎での結晶の滞留に移した。1998年にErasmus University Rotterdamで博士号(PhD)を取得した。現在Rotterdam のErasmus Medical Centerの泌尿器科学部門の上席研究員である。
ヒアルロン酸(以下HAと略記する)はグルクロン酸(GlcUA)とN-アセチルグルコサミン(GlcNAc)の二糖単位の繰り返し構造から成る直鎖の高分子量(>106 Da)グリコサミノグリカンである。生理的溶液中でのHAはGlcUAのカルボキシル基の陰性荷電(COO-)により多価陰イオン性高分子としての挙動を示す。HAの長鎖分子は互いにからみあって網目状の 3 次元構造を形成し、粘弾性を発揮する。この網目構造は水を大量に保持するとともにカチオン類と結合する1。尿濃縮、結晶化の抑制および結晶の滞留などの腎結石症に結びつく可能性がある多くの過程の中で、HAは中心的な役割を果たしている。
腎結石症には3種類の症状発現がある。腎石症(腎臓結石)、尿細管性腎石灰化症(尿細管に結晶が沈着)および間質性腎石灰化症(髄質の間質に結晶が沈着)である(Fig.1)2。腎石症は西側先進国の重要な健康問題のひとつで米国の人口の10〜15 % が生涯一度は苦しめられ、関連する医療費は年間21億ドルに上る3,4。髄質の間質に沈着した結晶質がやがて腎乳頭を浸食し、腎乳頭の壁を通り抜けて腎杯で結晶核を形成するに至り、この結晶核を中心に結石が成長する可能性があると考えられる。また、尿細管性腎石灰化症に関しては、腎結石形成の原因であるのか腎結石症の全く独立した一形態であるのか完全には明らかになっていない。
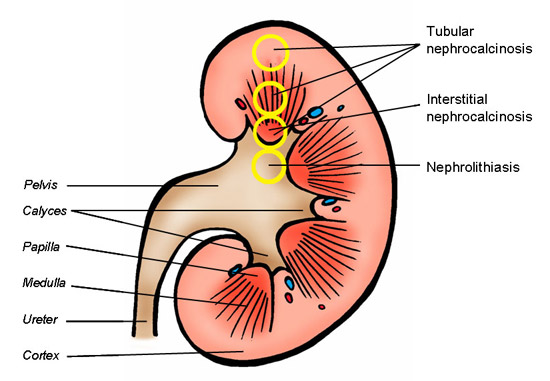
Fig. 1
腎臓の解剖図および腎結石症の各症状が発現する部位。間質腎石灰沈着症がもっぱら腎臓の内部髄質(乳頭)に発現するのに対し、管状腎石灰沈着症はネフロンのどこにでも発現することができる。
HAは腎髄質の間質中に豊富に含まれるが腎皮質にはほとんど存在しない (Fig.2)。HAの生合成は腎臓の発育中ならびに種々の腎臓病の病態でアップレギュレートされる。この場合HAは腎皮質にも発現する5-7。HAは健常腎の尿細管上皮には発現しない。一方でHAは胚形成と創傷治癒の際の、発生および再生する尿細管細胞の管腔表面に発現する。8-10
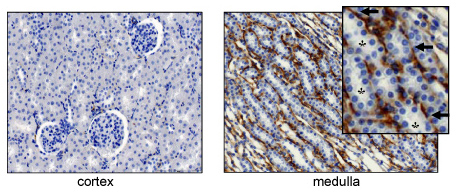
Fig. 2
健常腎のHA。皮質および髄質組織切片をビオチン化HA結合タンパク(bHABP)により染色した。HAは髄質に豊富に含まれるが皮質にはほとんど存在しない。髄質中のHAは間質(矢印)に発現し、尿細管(*)には発現しない。
代謝で産出された老廃物は腎の糸球体に入り、最終的に尿とともに体外に排泄される。ヘンレループに到達した原尿はカルシウム塩が過飽和状態だが、遠位尿細管の前半部では尿細管の尿細管腔液を作る働きによって血漿よりも低張となる。この領域から最終的な尿に至るまで、主として抗利尿ホルモンのアルギニン・バソプレシンの作用によって尿細管腔液のカルシウム塩の過飽和状態が左右される。アルギニン・バソプレシンの作用によって選択的水チャネルを司るタンパクのアクアポリン2が膜に挿入され、その結果遠位尿細管と集合管の水透過性が高まる11。さらに、髄質の間質が高浸透圧であることにより浸透圧勾配が形成され、管腔から髄質へ向かう水の受動拡散に必要な条件が整う。腎髄質の間質中のHAは大きなドメインを形成し、ドメイン内に大量の水を保持できることから、腎臓の水処理能力においてHAは重要な役割を果たしていると提唱されている12,13。髄質の間質のHA濃度は水利尿で高く抗利尿では低い。この事実はHA濃度が高いと腎臓での水の再吸収がさまたげられることを示している14-16。水の再吸収に伴って間質のヒアルロニダーゼ活性が上昇し、HAの低分子化が起きる17-19。尿の生成と水再吸収の過程に関しては、さらにもうひとつ尿流動態に係わる構成要素があることを示唆する報告があいついでいる。SchmidtとNielsenらのグループは腎乳頭がある種のポンプであると提唱している(http://www.apsarchive.org/renalpelvis/index.htm)。彼らの説によれば腎乳頭の壁にはある種のペースメーカーが備わり、これが律動的な収縮を生み出し、尿細管腔液が尿管の方へ移動する。同時にこの収縮とアルギニン・バソプレシン/アクアスポリン2の協働によって水が集合管へ押し出され、押し出された水はさらに間質へ移動する20,21。間質部分に移動した水は有機の多孔性イオン交換樹脂として機能するHAの網目構造に入り込む。つぎに腎盂が収縮するとイオン交換の作用によって純度の高まった水が上行直細血管へと絞り出され、血流に還っていく(Fig.3)13。こうした選択的な水再吸収によって原尿中の難溶性老廃物の塩(カルシウム塩)の過飽和度は大きくなる。抗利尿の局面では髄質のHA濃度が低いので、水再吸収の際に腎の間質にカルシウム塩が沈殿する危険性が増大することも十分考えられる。

Fig. 3
HAはグルクロン酸(GlcUA)とN-アセチルグルコサミン(GlcNAc)の二糖単位の繰り返し構造から成る直鎖の高分子量(>106 Da)グリコサミノグリカンである。生理的溶液中でのHAはGlcUAのカルボキシル基の陰性荷電(COO-)により多価陰イオン性高分子としての挙動を示す。HAの長鎖分子は互いにからみあって網目状の 3 次元構造を形成し、粘弾性を発揮する。この網目構造は水を大量に保持するとともにカチオン類と結合する。腎乳頭の壁にはペースメーカーが備わり、これが律動的な収縮を生み出す。間質性の腎石灰化の危険性に対して腎髄質のHAは一種のイオン交換レジンとして機能し (A)、カルシウムイオンと結合することにより難溶性のリン酸カルシウムの生成を防いでいると考えられる。収縮がゆるむとマトリクスの中がカルシウムとリン酸で満たされ (B)、次の腎盂の収縮時に (C)カルシウムの除かれた水がHAの網目構造から押し出されて上行直細血管に入り、血液循環へ還る (緑=カルボキシル基、青=水分子、茶=リン酸、紫=シュウ酸、橙=カルシウム)。
今から20〜30年前、尿細管での結晶の滞留が腎結石生成の端緒であるとされていた22。その後尿細管上皮の培養細胞を用いて結晶と細胞の相互作用の研究が行われ、細胞表面で結晶と結合する分子がいくつか発見され23-26、HAもそのひとつであった27。シュウ酸カルシウムの結晶はサブコンフルエントな状態にある、あるいは、損傷部位で増殖をしているか移動性の細胞に良く結合する。しかしコンフルエントな状態にある分化細胞にはほとんど結合しない(Fig.4)28。創傷治癒にかかわっている扁平の移動性細胞は内腔表面にHAを発現するが、無傷のモノレイヤーの分化細胞はHAを発現しない(Fig.5 および 6)。再生中あるいは増殖中の細胞の尖端部にはHAの受容体タンパクであるCD44が発現する。コンフルエントに至る増殖細胞でも創傷治癒過程の細胞でも発現したCD44はしだいに尖端側の領域から細胞膜の基底側領域へ移行する(Fig.7)9。増殖をしているかあるいは移動性の細胞をヒアルロニダーゼ処理すると細胞と結晶の結合は顕著に低下する8.27。創傷治癒の過程でアップレギュレートされたHAシンターゼ 2(HAS2)によるHA産生が見られる9。シュウ酸カルシウムの結晶はHAに対する高い親和性を有しているようである(Fig.8)。
HAが尿細管性腎石灰化症に果たす役割を検討する目的で、腎毒性を有しシュウ酸塩前駆体でもあるエチレングリコールをラットに投与する研究が行われた。その結果シュウ酸カルシウムの結晶が腎臓の中で再生中のHAおよびCD44を内腔表面に発現した尿細管上皮細胞に見いだされた (Fig.9)10。この知見が臨床的に意味を持つかどうかを明らかにするために、尿細管性腎石灰化症が随伴する場合の多い早産児例および腎移植例による研究が行われた29,30。いずれの患者群でも尿細管上皮の細胞表面で結晶とともにHAおよびCD44が見いだされた(本稿ではデータを省略)31。早産の新生児の腎はまだ発育過程にあるので、尿細管上皮細胞はHAを合成し発現しているものと考えられる。しかし、移植腎では尿細管上皮細胞でHAが発現している原因は、おそらく虚血と免疫抑制剤による腎組織のダメージにあると思われる。
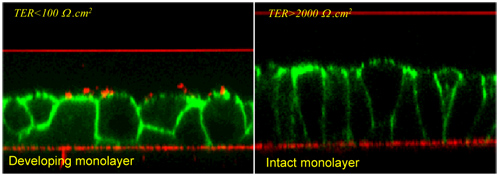
Fig. 4
腎集合管のモデルの MDCK- I細胞。共焦点レーザー走査顕微鏡(CSLM)により増殖基質に対して垂直方向の走査を実施した。細胞膜はFITCラベルした蛍光ファロイジン(緑)により可視化した。左図はモノレイヤー形成されつつある画像で、2 日前(0 日)に透過性の増殖基質(トランスウェル)上に高密度に播種された非臨床未分化な細胞からなる。経上皮細胞電気抵抗(TER)はまだ低値であり、機能的なタイトジャンクションが存在していないことを示している。やがて細胞は丈が高くコンパクトな形状になり、TERの上昇によりタイトジャンクションが形成されることが分かる。
この条件では、 4〜5 日が経過するとインタクトな上皮細胞が生成される。
シュウ酸カルシウムの結晶を細胞の内腔側に添加して一定時間インキュベートし、細胞に吸着しない余剰の結晶を洗浄・除去した。結晶は光の反射で視覚化した(赤い点)。赤い線はレーザー光を反射している増殖基質とカバーガラスである。結晶がコンフルエント形成中の移動性細胞には結合するが、無傷のモノレイヤーの細胞には結合しないという事実から、正常な機能の上皮細胞は結晶の沈着から守られていることが示唆される。これは普通の人が結晶を体内で生成して尿中に排泄しているのに腎結石症にならないことの説明になると考えられる。
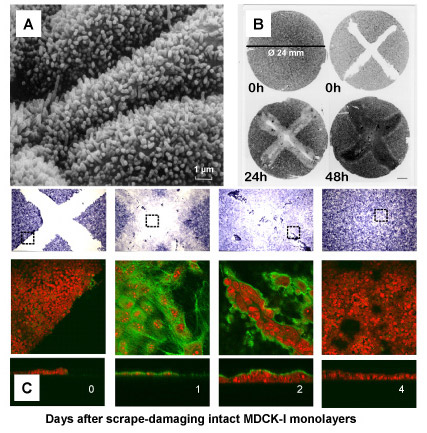
Fig. 5
創傷治癒に関与する細胞にHAが発現する。MDCK-I細胞の無傷のモノレイヤーをピペットの先端で擦過し傷をつけた。(A)走査型電子顕微鏡により無処置のモノレイヤー中の 3 個の細胞を観察し、(B, t=0 h)同じモノレイヤーの 500 万個の細胞を位相差光学顕微鏡で観察した。(B)には増殖基質の全容(直径 24 mm)を示した。無処置(t=0 h、左)、擦過傷を与えた上皮細胞(t=0 h, 右)、 1 日後の傷に細胞が浸潤していく様子(t=24 h)および 2 日後に傷が再び細胞で満たされた様子(t=48 h)である。5 日後にはTERの値が再び高値であった(データは示していない)。
(C)の上部のヘマトキシリンの紫色の染色像は(B)の拡大で、それぞれ傷をつけてから0、1、2および 4日後である。破線の四角で囲んだ部分はその下の共焦点顕微鏡(CLSM)写真を撮影した領域を示している。CLSMによる観察で細胞はヨウ化プロピジウムにより赤く染まり、HAはbHABP-FITC(アビジン化FITCを結合させたビオチン化HA結合タンパク)により緑色に染まっている。この結果からインタクト(0 日)および治癒後(4 日目)のいずれの上皮細胞にもHAが発現しないことが観察された。創傷に浸潤する扁平な移動性細胞および増殖細胞(1 日目)、および傷が閉じる部分に集積して瘢痕を形成する細胞にHAが発現している(2 日目)。
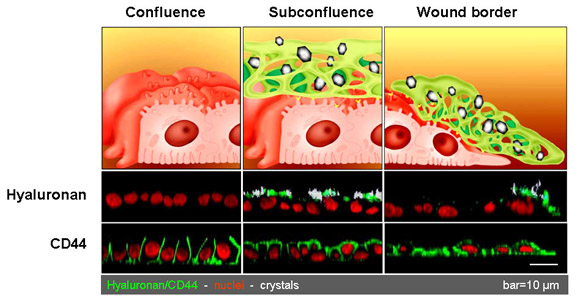
Fig. 6
MDCK-㈵型細胞のコンフルエント(左)、サブコンフルエント(中)ならびに擦過による創傷からの治癒過程(右)を共焦点レーザー走査顕微鏡 (CLSM)で増殖基質に対し垂直 に走査(xzスキャン)を行った。 細胞をシュウ酸カルシウム一水和物(COM)結晶とともに 1 時間インキュベートした後HAとCD44を染色した。すべての細胞に付着していない結晶を洗浄して除去したので、残った結晶は細胞表面に結合したものである。高いTERを持つコンフルエントなモノレイヤー(タイトジャンクション機能を示す)は、HAを発現せず、CD44の発現は側底細胞膜に限定され結晶には非結合性である。サブコンフルエントな状態の細胞には結晶が顕著に結合し、細胞の内腔側にHAおよびCD44が発現していた。創傷の端部分の移動性の細胞にも結晶が多く吸着し、細胞の内腔側にHAおよびCD44が発現していた。
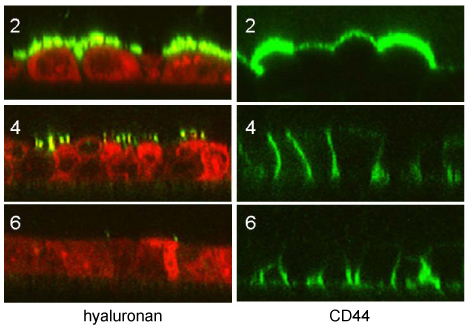
Fig. 7
HAはサブコンフルエントな増殖中の尿細管上皮細胞に発現した(播種から 2 日)。細胞間の接触部位ではこの染色は徐々に消え始め(播種から 4 日)、タイトジャンクションが形成された時点で完全に消失した(播種から 5〜6 日)。
HA受容体のCD44もサブコンフルエントな細胞の内腔表面に発現した(播種から 2 日)。細胞間の側方接触部位では、CD44の発現は間隙に向かって移動したが、コンフルエントな状態になると(播種から 6 日)底面に集中した。
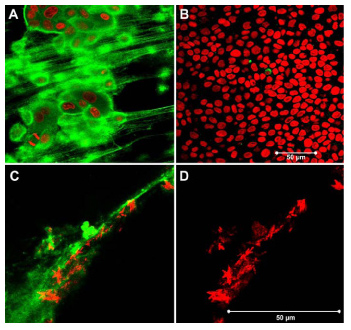
Fig. 8
A) 移動性MDCK-I細胞の表面にある、HAを多く含む細胞近傍基質を共焦点顕微鏡により視覚化した。B) コンフルエントな状態のモノレイヤーにはHAの発現が見られない。C) シュウ酸カルシウム結晶はHAに付着している。D) 結晶による光の反射。
AおよびCの緑色の部分;アビジン化FITCを結合させたビオチン化HA結合タンパク(bHABP)による染色。AおよびBの赤色の部分;エタノールによる膜の透過処理後、ヨウ化プロピジウムによって染色された核。CおよびDの赤色の部分はレーザー光を反射して光るシュウ酸カルシウム一水和物の結晶である。
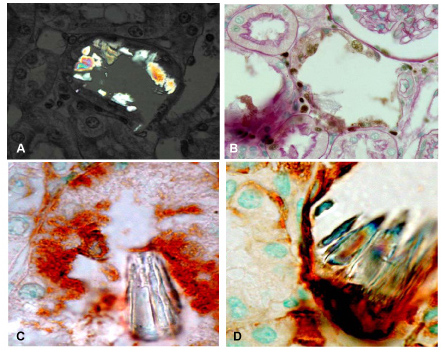
Fig. 9
腎毒性を有しシュウ酸カルシウム前駆体でもあるエチレングリコールをラットに8日間給餌した(飲水に0.75 % 添加)腎組織。
(A)偏光顕微鏡により可視化したシュウ酸カルシウム結晶。
(B)PASおよびメチルグリーンで染色した切片中にみられた結晶、扁平化したPCNA(増殖細胞核抗原)陽性の尿細管上皮細胞表面に見られる。
(C)結晶は、内腔側にHAを発現している尿細管上皮細胞および
(D)CD44を発現している尿細管上皮細胞に見られた。
腎乳頭の間質中のカルシウム塩濃度は準安定域の上限をはるかに超えて高い32。しかし、フリーのカルシウムイオンの大部分はHA分子のGlcUAのカルボキシル基と結合している可能性が高く、カルシウム塩が難溶性であっても容易に沈殿は生じないものと考えられる。腎結石のサブセットはランダルプラーク上で成長する。ランダルプラークとは腎乳頭の表面が石灰化してできたものである33,34。このプラークは腎乳頭の間質中に沈殿したリン酸カルシウムでできている。沈殿物の貯留が進行して最終的に腎盂の壁を突き破ったものがランダルプラークと呼ばれる。結石はランダルプラークを持った腎臓においてより多く発見され、こうした患者の尿は通常カルシウム濃度が高く、pH および尿量は低い35,36。結石のできた患者の腎間質が健常人に比べてリン酸カルシウムが生成しやすい状態になっているのは確実であると思われる。腎乳頭の間質にリン酸カルシウムが生成されるのは、カルシウム塩およびリン酸塩の濃度上昇ならびに局所的な変化あるいは、HAの濃度が低下して大量の遊離のカルシウムイオンが貯まった結果であるとも考えられる。
HAは水を保持して陽イオン類と結合するという特長を有するばかりでなく1,13、結晶質とも非常に良く結合する27。遠位尿細管が発育中か再生する過程で細胞表面にHAが合成され発現すると、必然的に尿細管性腎石灰化症につながる (Fig.10)。このような様式の腎結石症によって閉塞が起きた場合には結果としてネフロンの総量が減る可能性がある。これは早生児が成人に達した時の腎機能低下につながり、腎移植を受けた成人の場合は長期にわたる移植腎生着に悪影響を及ぼす可能性がある37。HAはカルシウムイオンと結合するので、腎乳頭の間質における結晶生成に対する強力な抑制物質でもある。したがって、間質中のHA含量を高めれば間質性腎石灰化症を予防できるかもしれないという誘惑的な推測が成り立つ。また、間質性腎石灰化症は最終的にランダルプラークの形成 (Fig.11)と腎臓結石の生成 (Fig.12)に至る。したがって腎乳頭のHA含量を増加させても腎臓結石の生成を予防する効果を発揮するかもしれない。毎日の水分摂取量を増やすと腎乳頭の間質中のHA含量を高める可能性がある。注目すべき点はシュウ酸カルシウム結石を再発する人の尿排泄量が少ない傾向にあることである38,39。再発は往々にして環境要因、ライフスタイルあるいは職業に原因があるとされるが、そうした症例の一部は腎臓の水処理能力に異常により尿排泄量が少なくなっていると考えることもできる。このことは多量の水分摂取が常に腎結石予防の柱とされる理由の説明になると思われる40,41。腎結石を発症しても原因が不明である例は少なくない(特発性の再発結石)。
本稿では腎結石症の異なる症状発現のいずれの病態生理においてもHAが関わりを持つ可能性があることを示した。腎でのHAの合成、蓄積および分解の機作ならびに関連因子の理解が深まれば、より効果的な治療の戦略を構築することが可能になるかもしれない。
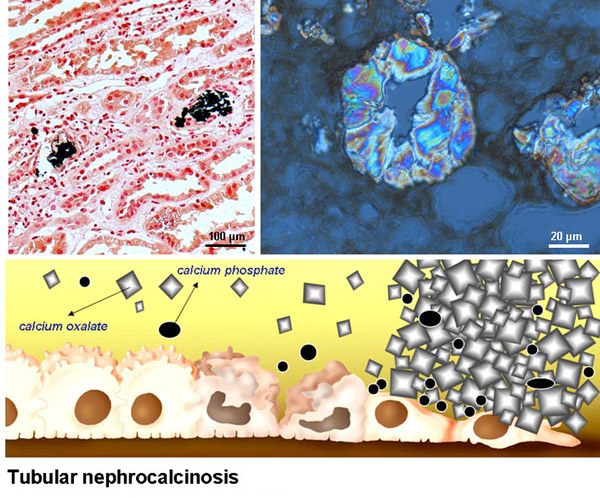
Fig. 10
左上:移植腎の尿細管上皮細胞に保持されたシュウ酸カルシウム結晶。右上:原発性高シュウ酸尿症から末期腎不全を来した患者の尿細管を閉塞しているシュウ酸カルシウム結晶の拡大像。尿細管の閉塞は尿細管壊死およびネフロン総数の低下を招く。尿細管性腎石灰化症は早生児に発現すれば成人期での腎機能低下につながり、腎移植を受けた成人の場合は長期にわたる移植腎生着に悪影響を及ぼす可能性がある。
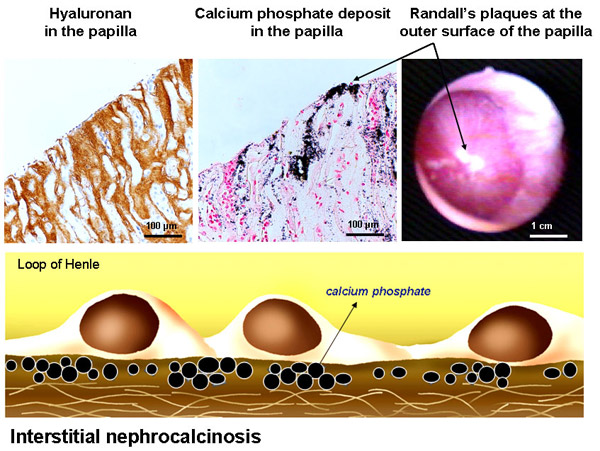
Fig. 11
左上:HA結合タンパク(HABP)によるHAの染色像。腎乳頭の間質領域が染まり、尿細管は染まっていない。上中央:HAと同じ領域に結晶の沈着がYasueのカルシウム染色法により観察される。矢印は、間質に沈着したカルシウムが腎乳頭の壁を突き抜け、ランダルプラークを形成したところ。右上:泌尿器科医が経皮的腎結石摘出術を施行する際に内視鏡で観察されるランダルプラーク像(ビデオ映像を参照のこと)。こうしたプラークが腎臓結石の成長に必要な核を形成する。
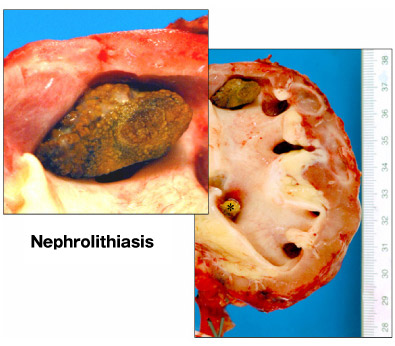
Fig. 12
右は慢性腎盂腎炎のため摘出を受けた腎の中のシュウ酸カルシウム結石の像である。腎杯に大型の結石があり(差し込み写真を参照)、小型の結石が尿管を閉塞している(*)。
謝辞 本稿に示した研究はDutch Kidney Foundation、Oxalosis and Hyperoxaluria Foundation, およびFoundation Scientific Urological Researchの援助のもとで実施された。また、原稿を丁寧に読み有意義なディスカッションをしていただいたRobert Stern (Department of Pathology, School of Medicine, University of California, USA) および Dirk-Jan Kok (Department of Urology, Erasmus MC Rotterdam, The Netherlands)に感謝するとともに、素晴らしいイラストとアニメーションを製作していただいたNihal Yildirimとランダルプラークの映像を提供していただいたPaul Verhagen (Department of Urology, Erasmus MC Rotterdam, The Netherlands)にも謝辞をささげたい。さらに、Marc de Broe, Anja Verhulst, Benjamin Vervaet and Patrick D’Hease (Laboratory of Pathophysiology of the University of Antwerp, Belgium) およびHans Romijn, Marino Asselman, Marieke Schepers, Burt van der Boom, Eddy van Ballegooijen, Charlie Laffeber, Fritz Schröder and Chris Bangmaの皆さんの優れた業績と共同研究に対して感謝を申し上げたい。