
James B. McCarthy: McCarthy博士は1974年にSusquehanna 大学から学士号を得た。彼は1981年にワシントンD.C. のCatholic大学からPh.D.を得た。彼の大学院生としての研究はメリーランド州ベセスダの国立歯学研究所でDr. Sharon M. Wahl の指導のもとに行われた。彼の大学院での研究は急性および慢性の炎症に焦点をあてたものであった。彼の研究は、コラーゲン性マトリックスのメタロプロテアーゼ発現を制御する活性化マクロファージにおける重要なシグナル伝達経路を同定することに重点を置いていた。彼は1981年Minnesota大学の Dr. Leo T. Furchtの元でポスドクとなった。彼のポスドクとしての研究は、細胞外マトリックスタンパク質のフィブロネクチンとラミニンが、転移性腫瘍細胞の接着、移動および侵入を促進するメカニズムを扱ったものであった。彼の現在の研究は細胞表面のプロテオグリカンとグリコサミノグリカンが腫瘍の接着、成長および転移を仲介することの重要さに焦点を当てている。彼は現在、ミネアポリスのMinnesota大学検査医学及び病理学部門の正教授である。また、Dr. McCarthyはMinnesota大学総合ガンセンターにおけるガンの進行と転移プログラムのプログラムリーダーもつとめている。

Simpson博士はMinnesota大学生化学部門の Dr. James Fuchsの研究室でE. coliの制御タンパク質を研究して学士を得た。1992年に理学士学位を得た後、彼女はMinnesota大学生化学部門、分子生物及び生物物理学科で大学院生としてDr. David Bernlohr と研究を続けた。彼女のPh.D.学位論文は、脂肪細胞の脂質結合タンパク質のリガンド結合の生物物理学的性質と、ノックアウトマウスを用いた脂肪細胞の脂質代謝におけるその役割の研究に焦点を当てたものであった。1997年にPh.D.取得を終了し、彼女はDr. James B. McCarthyと検査医学及び病理学部門でヒアルロン酸研究に関わり始めた。Dr. Simpsonは2002年にポスドクの訓練を終了し、Nebraska大学生化学部門でテニュアトラック助教授となった。彼女の現在の研究は、腫瘍におけるヒアルロン酸リッチマトリックスの合成と集合を促進する分子メカニズムを理解することに焦点を当てている。
前立腺ガンは男性におけるガンによる死亡の主要原因の一つであり、死亡率でも肺および大腸・直腸ガンに次いで高い1。ほとんどの前立腺ガンは診断時において前立腺内に留まっている。他の悪性腫瘍におけるように、前立腺ガンの進行は侵襲性の増大、血管新生及び最終的には遠隔組織への腫瘍の転移を伴う。局部に限定された前立腺ガンは当初アンドロゲン遮断療法により、ある程度効果がみられる。しかしながら多くの場合腫瘍細胞はアンドロゲン依存性を失って再び成長し始め、侵襲性を増加させる。遠隔転移は骨とリンパ節に最も高率に起こり、いくらかの内臓転移も伴う。骨転移は前立腺ガン患者における臨床上の主要な悪化原因であり、ガンが進行した患者では強い骨の痛みを引き起こし、QOLを低下させる。腫瘍の成長、血管新生および転移に影響する要因を明確にすることは、原発性腫瘍の診断を容易にし、新しいガン治療の発展へと導くことになるだろう。
ヒアルロン酸(以下HAと略記する)は、高分子量の陰イオン性ポリマーであり、組織の形態と機能に影響する機械的および生物学的性質を有する。HAを豊富に含むマトリックスは高度に水和されたいくつかの正常組織に見いだされており、それらは硝子体液、軟骨および卵丘細胞の丘体などである2-5。HAは組織の水和状態の維持、関節のクッションおよび無細胞スペースの維持に重要であるが、生物学的刺激物として重要な役割をしていることを証明する多くの研究がある。HAは、正常な神経冠細胞の移動、心臓の形成および前立腺管形成の足場として必要である。また、HAは創傷治癒における接着基質および発生における上皮系から間葉系への細胞の形質転換における不可欠のエフェクターとしても証明されている6。
HAはほ乳動物において、HAS1、HAS2およびHAS3の3つのヒアルロン酸合成酵素ファミリーにより合成される7-9。アミノ酸レベルでは50 - 70%相同であるが、ヒトの3つのアイソザイムの遺伝子は3つの別々の染色体に位置している:HAS1(19q13.3-q13.4)、HAS2(8q24.12)およびHAS3(16q22.1)。2次構造予測とホモロジーモデルから、これらの膜タンパク質は6つの膜貫通ドメインと7つ目の膜にくっついたドメインから成っていることが示唆されたa,7。全分子量の約半分の大きさの細胞内ループに酵素活性サイトと基質結合ドメインが含まれる。3つの全てのアイソザイムは同じ反応を触媒する。それはそれぞれのUDPエステル化糖前駆体からグルクロン酸とN-アセチルグルコサミンを交互に連続して付加し、繰り返し2糖を形成する。ポリマー化は成長する糖鎖の分泌を同時に進行するので、その最終サイズは細胞の大きさに制限を受けない。新しく合成されたHAの分子量は平均1 x 105 - 1 x 107 Dalton の範囲である。
a このシリーズの Weigel、McDonaldとSpicer のレビューを参照
ヒアルロニダーゼはHA合成酵素により産出された大きなHAポリマーの分解を担う。ヒアルロニダーゼで生じたHAの断片は、元の高分子量ポリマーと異なる生物学的性質を有する。ヒアルロニダーゼはHAの細胞内hの取り込みと血管新生を促進する小さなHAオリゴ糖の生成に必要である。正常な発生と組織の機能においては、ヒアルロニダーゼ発現の増加は通常分化した細胞に伴っており、従ってこれらの細胞は速く分裂していない。ヒアルロニダーゼファミリーには5種の酵素があり、それらはアミノ酸配列と活性の性質において種々異なっている。これらの酵素をコードする遺伝子の位置は、染色体の3P21.3と7q31.3の2つのグループに極めて接近して存在しているb。ファミリーのメンバーの発現は、組織特異性と細胞内局在性のどちらにおいても異なっている。酵素の翻訳後のプロセッシングもまた組織特異的に観察される。血漿中の主要なヒアルロニダーゼであるHyal1は全体の見かけの分子量は57kDで、そのうち8kDはコアタンパクのグリコシル化によるものである。これとは対照的に尿中から単離されたHyal1はそのカルボキシル末端のタンパク分解によって、より小さな分子量を示すb。ヒアルロニダーゼのプロセッシングまたは発現の仕方における組織特異的違いの重要性は完全に分かっていないが、尿中のHyal1は血漿Hyal1より高い比活性を有する。
b このシリーズのSternとCsoka のレビューを参照
HAは高度に陰性で、全ての2糖単位に1つずつ陰性荷電をもつ。高分子の糖として、HAはまた非常に親水性を示す。各HA分子間の静電気的反発と分子の高い水和性が相まってHA水溶液に粘性の高いゲル様の性質を与えている。組織内における高いHA含量の生理的性質としては、組織容積を増大させ、ゆるいマトリックスを維持するようになる10。これは関節や生命に必須の器官のような組織のクッションとして望ましい性質であり、物理的損傷に対する防御として、分泌された高分子量HAに依存する。組織の水和維持に加えて、HAマトリックスは栄養物や低分子活性物質の拡散を調節できる。たとえば成長因子とサイトカインはそのような拡散が制限されることで局部的に濃縮されるかも知れない。従って組織における高いHA含量はまた、細胞外刺激への組織の応答を制御するかも知れない。
HAは遊離のグリコサミノグリカンとして分泌されるので、HAリッチ細胞外マトリックスの保持には特異的なHA結合プロテオグリカンとレセプタータンパク質の存在が必要である10,11。HAポリマーへ効果的に結合するいくつかのタンパク質は、リンクプロテインホモロジードメインとして知られる共通の構造モチーフをよく使っているc。HAリッチマトリックスの厳密なタンパク質組成は組織特異的に変わるが、バーシカン(以下に記述)やアグリカンのようなHA結合プロテオグリカンが含まれる。このときマトリックスとの相互作用を安定化させるリンクプロテインと共同して働く。
c このシリーズのDayのレビューを参照
腫瘍細胞はHAリッチ細胞外マトリックスが高度にクロスリンクした線維性タンパク質のネットワークを欠き、廻りの組織により容易に侵入できる性質を利用するかも知れない4。HAによって水和された組織では、腫瘍細胞が移動し侵入するかも知れない物理的な空間が生じる。腫瘍に伴っている間質内のHAリッチマトリックスはまた新しく形成された血管により侵入される.12,13。腫瘍によって分泌された刺激物に応答して形成されたり、増大したりするかも知れないこれらのマトリックスは、成長する腫瘍に血管新生を増強することにより腫瘍細胞の生存と成長の助けとなる環境を提供すると考えられる。原発性腫瘍におけるHA含量の変化は、ガンと腫瘍に伴う間質の間の複雑な相互作用に起因する。ガンにより産出された成長因子とサイトカインは、間質中の繊維芽細胞を刺激して、HAとそれに伴うHA結合マトリックス成分の産生を増加させ、拡大する腫瘍の近傍HAリッチマトリックスを形成させるようになるかも知れない。蓄積するHAはガンの成長、生存および侵入を促進し、HA断片は血管形成に寄与しているかも知れない。腫瘍が進行するにつれ、ガン細胞はそれぞれの細胞周辺HAリッチマトリックスの合成と保持を行うようになり、間質繊維芽細胞によるHAの産生にあまり依存しなくなるかも知れない。ガンによるHAの産生は従ってオートクライン的に作用して、腫瘍の成長と転移を促進するのかも知れない。
HAは細胞増殖や移動のような正常な発生プロセスの制御に関与しているので、その過剰生産は不適切な細胞分裂や移動によって特徴づけられる病態としばしば関連する。重要なことは、大腸、乳房、膀胱および前立腺の各ガン患者で血中HAレベルが上昇し、また原発性腫瘍内でHA沈着が増加していることである。腫瘍の種類によって、これらのHAの沈着は、ガンまたは腫瘍に伴っている間質細胞によって形成される。これらの観察から、ヒトにおけるHAの蓄積と腫瘍の進行の間に重要な関連性がある可能性が強い。
ヒト前立腺ガンサンプルのHA含量を調査したいくつかの研究によると、腫瘍に伴う間質のHA染色強度とガンの重篤度に関係が見られた。間質内HA染色が強い患者は、低い患者に対し、13年間での生存率が50%以上低かった14。腫瘍細胞上のHA検出は、もう一つの独立した予後の指標であり、腫瘍の神経周囲への侵入とは弱い相関性しか示さなかった。腫瘍細胞のHA染色は予後全般とは相関しなかったが、この研究における患者グループは均等に処理されておらずHAと予後の関係を正確に予測することを困難にしている14。同じグループのその後の研究で間質HAの予後における価値を扱った15。PSA(前立腺特異抗原)の再発、貯精嚢と神経周辺への侵入や遠隔転移の存在のようないくつかの悪い予後の指標は、前立腺間質の強いHA染色と相関した15。さらに局部的に侵襲された貯精嚢とリンパ節転移部にHA染色が見られた16。総合すると、前立腺腫瘍での高いHAの検出は予後判定に対する価値をもち、HAが原発性および転移腫瘍の両方の進行の促進に関係するように見える。
腫瘍中HAの大部分は、ヒト前立腺腫瘍のサンプルからは容易に抽出されるので、これはHA結合性プロテオグリカンまたは組織特異的リンクプロテインへ結合することによるクロスリンクは強くないことを示している16。この溶解したHAのゲル濾過分析によると分子量分布は広く、小さなオリゴマーへ強くシフトしており、腫瘍に伴ったヒアルロニダーゼが分解していることが推定された。腫瘍片にHA分解物が広く存在し、正常前立腺組織にはないことは、低分子化HAが血管新生のような腫瘍機能の促進において役割を果たしていることと矛盾しない。進行した前立腺ガンでは、正常な前立腺や良性の前立腺肥大に比較して、ヒアルロニダーゼ活性が著しく上昇する.17。分泌されたヒアルロニダーゼであるHyal1のタンパク質レベルも患者の組織サンプルで上昇が見られ、原発性腫瘍の進行期と関連しリンパ節転移で最も高く相関するなど、ガンの進行と相関する16。このように、ヒアルロニダーゼはHA合成酵素およびHA結合タンパク質と一緒に腫瘍の進行を促進するのかも知れない。
一つの特異的HA結合プロテオグリカンであるバーシカンは、HAとHyal1のように、病理学的進行度に相関した仕方で、原発前立腺ガン組織に蓄積する18。腫瘍におけるHAの蓄積を増加させる因子は完全には解明されていないが、それは腫瘍の進行度に相関する特異的なHASアイソザイムの増加と、変化した特異的なHA結合タンパク質レベルとに関連するらしい。腫瘍に伴う間質でのバーシカン量増加は、ガンに由来したTGF-β1刺激で腫瘍の間質領域内繊維芽細胞によって一部は産生される18。原発性ガンのHAリッチ細胞外マトリックスの変動する組成を示す更なる研究は、これらのマトリックスが安定化または分解されて、前立腺ガンの進行を促進するメカニズムを明確にするために重要であろう。
前立腺ガンの進行におけるHAリッチマトリックスの細胞表面への保持と生物学的機能もまたHAの細胞表面のHAレセプターおよび細胞内HA結合タンパク質への結合に依存している。CD44とRHAMM(receptor for hyaluronan-mediated motility)の2つは、HAに対する細胞表面レセプターとして最もよく研究されており、どちらも腫瘍の浸潤と転移の生物学に関係していると推測されているd,19。これら2つの細胞表面レセプターのリガンド結合性およびシグナル伝達機能の複雑さは活発に討論されてきた10,19。これらレセプターに関する多くの研究を詳しく紹介することは、このレビューの範囲を超えるが、前立腺ガンに直接関連すると推定される両者におけるいくつかの重要な特徴がある。
d このシリーズのTurleyとHarrison、 KnudsonとKnudsonのレビューを参照
CD44は高度に多形性を示す膜タンパク質である。多数のCD44異性体は選択的スプライシングと翻訳後修飾により作られる。CD44のHAへの結合は、細胞接着と運動性に影響するため、このレセプター/リガンドの組み合わせは細胞株を使って、細胞の移動、成長および生存という面において、広く研究されてきた19。CD44は細胞骨格に直接結合し、多くのシグナル伝達カスケードを刺激する。特にCD44は、p185HER2/neuとc-srcチロシンキナーゼが密にカップルしていることが報告され、rhoファミリー GTPasesを活性化することが示された。CD44はまた細胞骨格リンカータンパク質であるezrin/radixin/moesinファミリーとも相互作用する。このように、CD44は多くのタイプの細胞において、細胞骨格の再組織化、細胞接着および運動性の重要なメディエーターとして位置づけられる。CD44は正常と癌化した両方の細胞の接着、運動性および浸潤に直接関係し、CD44の特異的スプライシング変異体の発現がある腫瘍細胞株の転移に関係するという報告も驚くに値しない20。
細胞接着と運動性におけるCD44の重要性は多く報告されてき、一方前立腺ガン細胞におけるその役割は、転移の抑制物質として大きく認識されている。CD44は正常前立腺内では腺上皮に発現する。しかしながら、ヒトの前立腺ガンの進行においてCD44の発現はプロモーターがメチル化された結果、低く抑えられる14,21,22,23。根治的前立腺切除術を受けた患者を使った初期の研究では、前立腺ガン細胞におけるCD44発現の低下は、独立した悪い予後因子であることを示した24。より最近のレトロスペクティブな研究では、腫瘍中のCD44が高い患者に対し、低い患者の全13年間での生存率は50 - 60%低い結果となり、低下したCD44の予後診断における価値を確認した14。これらのデータと一致して、ダニングラットにおける研究でも、ラットの転移性前立腺細胞株で、標準型CD44を発現させると、腫瘍増殖は阻害しないが、転移を抑えることが証明された25。従ってCD44は、前立腺腫瘍において、単に浸潤と細胞接着を亢進させるだけで機能しているとは思われない。
CD44は細胞外HAの細胞内への取り込みと分解を促進することが示され、HAマトリックスを維持することにより寄与しているらしい26。前立腺内における高レベルのCD44はHAの分解を促進するので、従って腫瘍における細胞表面のCD44の減少は、腫瘍に伴うHAの蓄積に寄与するかも知れない。しかしながら、細胞株におけるCD44の転移抑制機能は、このタンパク質のHA結合活性には依存しないことが示されているので、ダニングモデルでのCD44によるガン悪性化の抑制には、他の因子が働いていることが示唆される27。
前立腺腫瘍進行の生物学におけるRHAMMの重要性はあまり知られていない。他の細胞において、RHAMMは細胞内および細胞表面タンパク質として報告されている19,28,29。その細胞内における局在を制御するメカニズムはあまり理解されていない。CD44のようにRHAMMは選択的スプライシングと翻訳後修飾(このメカニズムは不完全にしか理解されていないが)により、数種の異性体として発現される。細胞表面のRHAMMは、HA依存メカニズムにより多くのタイプの細胞の運動性と浸潤を促進することに関係している。HAによるRHAMMの結合は、c-srcキナーゼ、フォーカルアドヒージョンキナーゼおよびMAPキナーゼを活性化する細胞内シグナル系に関係すると言われてきた19。細胞内RHAMM(IHABPとしても知られているが)はまた、アクチン細胞骨格および微少管へ結合することが示されている。従ってこれは、シグナル伝達経路でリンカー分子として働いているかも知れない。RHAMMとHAS2は細胞周期において同時に増加し、細胞内HAは有系分裂紡錘体と共に局在するe,28,29。従って一つの可能性として、RHAMM/HA複合体は重要な細胞周期チェックポイント通過を制御することにより増殖を促進しているのかも知れない19。
e このシリーズのEvankoとWightのレビューを参照
これら以外のHA結合タンパク質が報告されているが、それらが前立腺ガンに関連するかどうかは、まだ報告されていない。一つの例は、リンパ管内皮細胞に最初に同定されたリンクタンパクホモログであるLYVE-1である30,31。乳ガンにおいて、腫瘍に誘導されたリンパ管の成長は、リンパ節転移の1つの仮定されているメカニズムである。広がったリンパ管内皮細胞に発現されたLYVE-1は、原発性腫瘍を離れた悪性細胞に提示された提供されたHAを認識するかも知れない。腫瘍細胞とリンパ導管の間の相互作用は転移性腫瘍細胞によるリンパ節転移増殖を高める可能性がある。
腫瘍形成と転移におけるHAと細胞表面レセプター相互作用の重要性は、その相互作用を消失させる実験方法で証明されてきた。たとえば腫瘍細胞に優性ネガティブ型のCD44またはRHAMMをトランスフェクトし、内在性のレセプターとHAの結合を阻害すると、腫瘍の成長が抑えられるかまたは、アポトーシスが増加した19,32。HAの二糖が3 -10回繰り返したサイズの断片は、HAのポリマーがCD44と結合することに対して競合する。これらのオリゴ糖によるCD44とHA結合の阻害は、阻害された細胞のアポトーシスを増加することにより、皮下での腫瘍成長と足場非依存性成長を抑えた33。まとめると、HAポリマーのレセプター結合を阻害することにより見られる効果は、腫瘍細胞の生存においてレセプターとHAポリマーの相互作用が必須の役割を果たすことと矛盾しない。腫瘍細胞の生存の促進は、その拡大と進行を予測させる。生存が促進されると、HAの過剰産生の結果として細胞毒性療法への応答が変化するかも知れない。従ってHAとレセプターとの相互作用を壊すHAオリゴ糖または他の試薬は、ヒトのある種の悪性腫瘍の治療における補助療法として有用かも知れない4。
HA合成酵素によるHAの過剰産生と腫瘍細胞の浸潤または転移が関係する、という多くのモデルがこれまで使われてきた(表1に要約)。たとえば、HT1080ヒト繊維肉腫細胞において、HAS2の過剰発現で増加したHAは、in vivoで大きな腫瘍塊を生成し、またソフトアガー中での成長を促進した34。TSU前立腺細胞株でのHAS3過剰発現は腫瘍の成長を加速した35。HA合成能の低い乳ガン細胞を選択すると、HA合成能の高い親の細胞株に比較して、肺への転移巣形成が大きく減少した。転移に対するこの抑制効果はHAS1のトランスフェクションによりHA合成を回復させることにより完全に元に戻った36。我々自身の最近の結果でも、転移性前立腺ガン細胞のHAS活性を阻害すると骨髄内皮細胞への接着が抑制されるとともに、免疫不全マウスに注入した時には、腫瘍塊形成も抑えることが証明された。(表1及び 詳細は後述)
Table. 1 ヒアルロン酸合成酵素遺伝子操作の研究要約
我々の研究室における研究でヒト前立腺腫瘍細胞株を用いて前立腺ガンの進行における重要な因子を同定した37-39。我々の当初の実験は、前立腺腫瘍細胞は、これの最も高頻度に転移する部位は骨であるが、この細胞表面レセプターが分布しているゆえに骨組織に優先的に転移巣形成できると言う仮説を検証することを目指した。我々は、下層に培養ヒト骨髄内皮細胞を使い、それぞれ異なった転移能を有する前立腺細胞株を用いてin vitroの単純な細胞接着実験を行った。我々は、非転移性LNCaP細胞は骨髄内皮細胞にあまり接着しないことを見つけた。対照的に転移性のPC3細胞、それにPC3の変異種で転移能が更に高いPC3M-LN4は、骨髄微少血管由来内皮細胞に迅速で定量的に接着したが、たとえばヒト臍帯静脈内皮細胞のような太い血管由来のものには接着しなかった(図 1)。さらに、ヒアルロニダーゼ分解に感受性があることと、外部から添加したHAが競合的に働くことから、この迅速な接着には腫瘍細胞表面のHAが必要であることが分かった37。骨髄内皮細胞への接着は前立腺腫瘍細胞株の転移能と概ね相関することから、接着表現型は転移性前立腺ガン細胞の特徴の一つらしいことが示唆された。
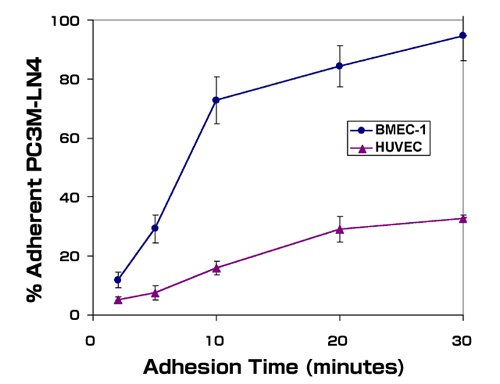
図 1
転移性の前立腺腫瘍細胞は骨髄内皮細胞に優先的に接着する。 転移性のPC3M-LN4細胞の、遊離細胞浮遊液をカルセイン-AMでラベルし、骨髄内皮細胞(BMEC-1)またはヒト臍帯静脈内皮細胞(HUVEC)を含むウェルに加えた。それぞれ示した時間でウェルを洗い、接着した細胞を溶解した後、蛍光強度により定量した。データは各3つのウェルからの総細胞に対する平均パーセント±SEMを示す。
HA合成と前立腺腫瘍細胞株による細胞表面への保持との比較から、HAの高い産生と転移能の相関性が証明された37。我々は正常前立腺と比較した前立腺腫瘍細胞株におけるHA合成酵素の発現レベルを分析し比較するために半定量的RT-PCRを用いた。HAS1は検出できなかったが、HAS2とHAS3が劇的に過剰発現されていた。対照的に、非転移性LNCaP細胞は、HAS2を発現せず、HAS3の発現もわずかであり、これらの細胞表面にHAがなく、骨髄内皮細胞にあまり接着しないことと矛盾しない。同様に正常前立腺においてHAS2とHAS3の発現は通常非常に低く、これは正常なヒト前立腺組織切片で検出されるHAレベルは低いという組織学的報告と一致する16。
腫瘍細胞において過剰に産生されたHAの影響力を調べるため、我々はアンチセンスとしてのHAS2/またはHAS3の部分的c DNAでトランスフェクトしたPC3M-LN4の安定な細胞株を選別した。この方法によるとどちらか一方のHAS異性体だけの阻害で、コントロールのトランスフェクタントに比較して、HAの合成と細胞表面へのHAの保持(図 2)および骨髄内皮細胞への接着が減少した(図 3とRef. 39)。驚くことではないが、HAS2とHAS3を同時に阻害すると最大の効果が表れた。これらの結果はHA合成酵素を阻害するとHA産生と前立腺細胞と骨細胞間の接着が制限されることを確実に証明した。さらに、腫瘍細胞表面からHAを除外して、この相互作用を阻害する実験は、浸潤性の高い前立腺腫瘍細胞により作られた細胞周囲のHA被覆物が骨転移を促進することを示唆していた。
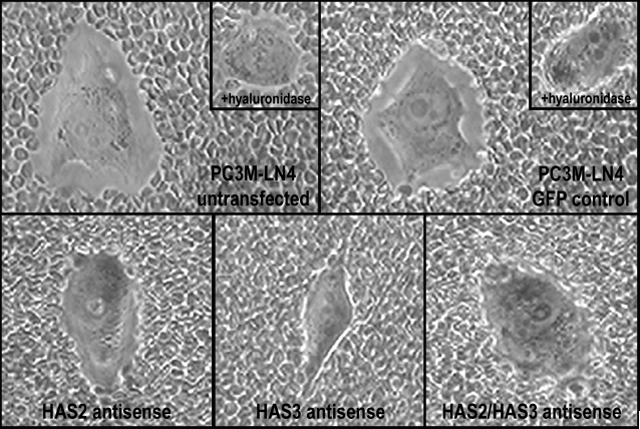
図 2
PC3M-LN4細胞におけるHA合成酵素の阻害は細胞表面へのHA保持を減少させる。細胞表面のHAは粒子排除法により検出された。PC3M-LN4のトランスフェクトしないもの、コントロールベクターでトランスフェクトしたもの、HAS2、およびHAS3アンチセンスでトランスフェクトしたもの、またはHAS2/HAS3ダブルアンチセンスでトランスフェクトした各細胞を、アグリカン(2 mg/ml)と90分インキュベートした。アグリカン溶液を除き 1×108 個の固定したヒツジ赤血球を含む、フェノールレッドを含まないMEMで置き換えた。15分インキュベート後、細胞を400倍で光学顕微鏡により観察した。PC3M-LN4のトランスフェクトしない、またはコントロールの細胞を取りまくHAマトリックスでは赤血球は排除され鮮明なハローとして見られる。これらマトリックスがHAを含むことは、アグリカンを添加する前にヒアルロニダーゼ消化することにより確かめており、こうすると鮮明なゾーンはもはや見られない。(枠内パネル)
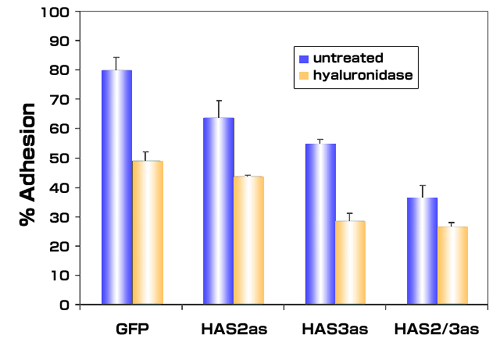
図 3
転移性前立腺腫瘍細胞でHA合成酵素の発現を阻害すると、骨髄内皮細胞との接着が阻害される。コントロールベクター(GFP)、HAS2アンチセンス(HAS2as) またはHAS3アンチセンス(HAS3as)で安定的にトランスフェクトしたPC3M-LN4細胞の遊離細胞サスペンションをカルセインでラベルした。コントロール培地または16 U/mlのストレプトミセスヒアルロニダーゼで処理した培地を、コンフルエントな骨髄内皮細胞単層培養を含むウェルに添加した。10分後、非接着性または弱く接着した前立腺腫瘍細胞をウェルを洗うことにより除去し、次に接着した細胞を溶解し、蛍光により定量した。平均の接着細胞は各条件とも加えた総細胞のパーセントとして計算し、±SEMで表わした。
転移性および原発性の前立腺腫瘍の成長では、高いレベルのHA合成が付随している。それゆえ我々は、腫瘍細胞成長におけるHAの役割を、免疫不全マウスにHASアンチセンスで阻害したPC3M-LN4細胞を皮下注入することにより評価した38。その結果、ベクターコントロールまたはトランスフェクトしない細胞株と比較して、一方のHASまたは両方のHASを同時にアンチセンス処理したものは腫瘍の成長が75 - 80%減少した(図4)。in vitroでのHASアンチセンス発現細胞の成長は、HAの合成と保持の減少に相関したように抑制されたが39、この抑制効果は、成長しているケラチノサイト培養でのHASアンチセンス発現したものでも観察されたように、細胞をより長期間培養すると減少した40。腫瘍内の増殖性細胞のパーセントは変わらないことから、抑制された腫瘍サイズは、成長する性質の変化だけでは完全に説明できない。
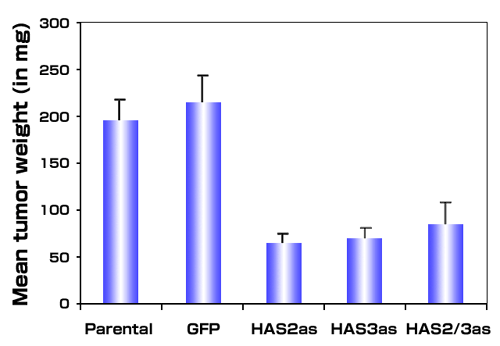
図 4
HA合成酵素の発現のアンチセンスによる阻害はin vivoでの腫瘍成長を阻害する。転移性PC3M-LN4細胞、ベクターのみ(GFP)、HAS2アンチセンス(HAS2as) 、HAS3アンチセンス(HAS3as)または両方のアンチセンスベクター(HAS2/3as)の発現をするものを選別した。安定なトランスフェクタントの遊離細胞サスペンジョンを免疫不全マウスの皮下へ注入した。3週間後、各条件における10匹の動物からの腫瘍を集め重量測定をした。データは平均重量 ±SEMで表した。
コントロールとHAS欠損腫瘍細胞からの腫瘍中血管系の評価から、腫瘍の成長動態が抑制されていることに対し追加される説明は、血管形成の減少であることが示唆された38。腫瘍の血管新生は、細胞表面血管内皮細胞マーカーである抗CD31抗体による染色で計測された(図5)。PC3M-LN4細胞によるHA産生の減少は、腫瘍血管系を70 - 90%抑制した。腫瘍切片における血管密度が減少したことから、HA合成の阻害が腫瘍により産生された血管新生因子の発現または機能を変えたようにみえる。これらの結果は、完全長HAS3をTSU前立腺ガン細胞株にトランスフェクションすると、腫瘍成長と血管新生が導かれたという以前の研究を補足するものである35。
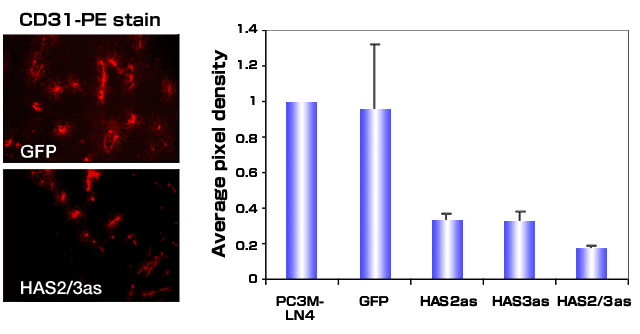
図 5
HA合成酵素の発現のアンチセンスによる阻害はin vivoでの腫瘍成長を阻害する。転移性PC3M-LN4細胞、ベクターのみ(GFP)、HAS2アンチセンス(HAS2as) 、HAS3アンチセンス(HAS3as)または両方のアンチセンスベクター(HAS2/3as)の発現をするものを選別した。安定なトランスフェクタントの遊離細胞サスペンジョンを免疫不全マウスの皮下へ注入した。3週間後、各条件における10匹の動物からの腫瘍を集め重量測定をした。データは平均重量 ±SEMで表した。
興味深いことに、PC3M-LN4細胞におけるHASアンチセンス発現の成長(図6)と血管新生(示していないが)に対する阻害効果は、ヒアルロン酸(平均810 kDa)の注入液への添加により完全に回復したことである38。この観察はHAによる腫瘍成長の促進は、腫瘍注入に続く初期での活性化を通じて起こり、浸潤性の高い乳ガン細胞株のヒアルロニダーゼ処理が腫瘍の成長を劇的に縮小させたというShusterらの結果を補足するものである41。HAにより活性化される初期事象としては、アポトーシスからの保護による腫瘍細胞生存の促進、または腫瘍を取り囲む正常組織での血管新生の促進を考えることもできる。どの様なメカニズムであろうとも、成長する腫瘍は代替供給源由来のHAを利用することができる。この観察は、原発性ヒト前立腺ガン間質で検出されるHAの増加は、腫瘍細胞または間質細胞のどちらに由来するものであっても、腫瘍成長、局所への浸潤、血管新生および転移に影響することを示唆している。
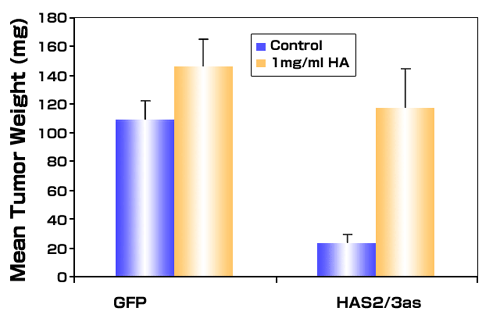
図 6
アンチセンスで阻害した前立腺腫瘍細胞の腫瘍成長は、外部から加えたHAにより回復する。ベクターのみ(GFP)またはHAS2とHAS3に対するアンチセンスを含むダブルベクター (HAS2/3as)により安定的にトランスフェクトした転移性PC3M-LN4を、コントロール培地または1 mg/ml HA(平均分子量810 kDa)を含む培地に浮遊させ、免疫不全マウスに皮下注入した。腫瘍は3週間後に集めた。データは各条件7 - 9個の腫瘍の平均湿重量±SEMとして表した。
ヒト前立腺ガンの進行は、間質マトリックス中のHAとヒアルロニダーゼ含量の大幅な増加を伴っている(図 7に要約)。マトリックス中のHA含量は、HA合成酵素、ヒアルロニダーゼおよびHA結合タンパク質の複雑な相互作用によって調節されている。しかしながら、HA代謝酵素と結合タンパク質の発現と活性を制御するメカニズムは余り理解されていない。前立腺ガンにおけるHA合成酵素の遺伝的増幅についていくつかの証拠はあるが、HAの合成と分解の制御において、前立腺ガンのミクロ環境内の因子が確かに重要な考察の対象である。
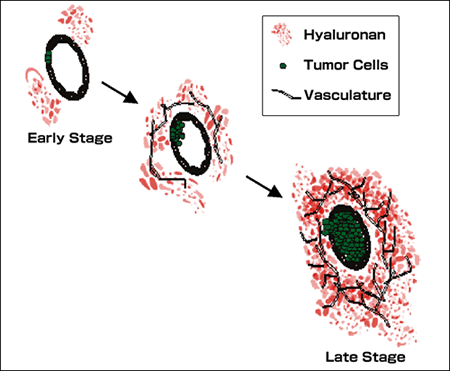
図 7
原発性前立腺腫瘍におけるHAの上昇。前立腺ガンの進行はHAの上昇を伴う。図は原発性前立腺ガン腫瘍における進行を描いている。進行は、腫瘍に伴っている間質のHA含量の増加に対応した前立腺ガン細胞腺組織の拡張を伴っている。進行した原発性腫瘍のHAは容易に抽出され、分子量は多様であり、原発性腫瘍の血管新生を促進する小さなHA断片を含む。これらの小さなHA断片は、腫瘍に伴っているヒアルロニダーゼの作用により産出される。これらの断片は、他の腫瘍関連因子と協力し、腫瘍の血管新生増加をもたらし、これに付随して腫瘍の成長と進行が起こる。このモデルを支持する研究は本文中で詳しく討論されている。
前立腺腫瘍進行を伴う遺伝的変異は、今やっと同定され始めたところである。このような変化は腫瘍内のHA合成レベルを変化させるのかも知れない。染色体8q.24部分の過剰発現は前立腺腫瘍の進行に見られる42。この増幅された領域に存在する遺伝子座は、部分的に解析され、HAS2のコーディングシークエンスを含むことが見つかった。前立腺腫瘍の細胞株の分析から、HAS2遺伝子座の増幅と、HAS2の高い発現の間に相関関係が示された。前立腺腫瘍細胞内での遺伝的過剰発現は、より進行した転移性腫瘍細胞において、HAS酵素レベルが増加することによるという重要なメカニズムを示しているのかも知れない。
いくつかの細胞と組織で、数種の成長因子と炎症性サイトカインがHA合成をアップレギュレートすることが示されてきた43-46。現在までのほとんどの研究は、HAの生産がHASの転写レベルで第一に制御されるが、最近の1つの研究でHAS活性をコントロールするのに重要かも知れない追加の因子が見つかった43 。異なったHASアイソザイムは別々の制御因子によりコントロールされ、その違いは細胞、組織特異的因子に関連しているように見える。TGFβ1、bFGFおよびIGF-1は、前立腺ガンに関連ある成長因子として報告されているが、種々のタイプの細胞でHA合成と/またはHAS発現を促進することが示されている。これらの研究によるとHAS2はHAS3に比べてより短時間に制御されているように見える。ある種の組織におけるHASレベルも、原発性および転移性腫瘍におけるHAレベルを制御することに対し重要かも知れない。特に前立腺細胞と前立腺腫瘍間質におけるHASアイソザイムのアップレギュレーションにおける細胞外因子の役割を決定することは重要だろう。腫瘍内におけるHA分解に対するそのような因子の効果についても、報告はされておらず今後研究される必要がある。
前立腺腫瘍の細胞株におけるヒアルロニダーゼの発現も評価された。PC3M細胞はHyal1、Hyal2およびHyal3全ての発現が正常の前立腺組織よりも、高いレベルであることが報告された47。Hyal1の発現は前立腺腫瘍のグレードに直接相関し16、また血管新生刺激物として知られ、正常な腫瘍組織には見られない小さなHA断片の存在とも関係した。トランスフェクトした細胞を用いたいくつかの研究より、腫瘍の最大の成長と転移には、HA合成酵素とヒアルロニダーゼの両方同時の過剰発現が要求されることが示唆された。例えば、HA合成酵素を過剰発現しているPC3細胞においてHyal1の過剰発現をすると、既に高転移性を示すこの細胞では、転移の拡大はわずかに増加した47。ヒアルロニダーゼを欠くグリオーマ細胞株におけるHAS2の過剰発現は腫瘍成長を実際に減少させたが、調べた全てのヒトグリオーマはヒアルロニダーゼを発現した48。ラットの大腸がんモデルでは、HAS2の過剰発現は腫瘍成長を増加させるが、一方Hyal1は成長を抑え、大きな壊死部分を持つ腫瘍を生じた49。腫瘍進行におけるHA合成と分解の相互作用は、活発な研究領域として残っている。
活性化されたCD44発現は、軟骨でのHAの除去を促進するので、軟骨細胞のHAマトリックスレベルを制御し、関節の完全な状態を維持するのに重要である26。前立腺腫瘍でのHAの蓄積も、同様に腫瘍内のCD44と他のHA結合タンパク質のレベルと分布により調節されているらしい。これらの可能性はまだ調査されていないが、腫瘍に結合したHAのレベルとその完全さを制御する転写の機構を徹底的に理解することにより、HAマトリックス合成を阻害し、腫瘍の拡張と進行を阻止することに使用できる新しい薬剤が作り出せるかも知れない。
腫瘍に結合したHAの上昇により腫瘍の進行が促進されるメカニズムを理解することは、前立腺腫瘍研究の重要な領域である。腫瘍間質内HAの上昇と、患者における好ましくない予後の間には、はっきりした関連がある。さらにわれわれおよび他のグループの結果によると、最も進行した腫瘍は自律的にHA合成酵素を発現し、原発性腫瘍またはその転移領域における自分自身の微少環境をよい状態にして、成長、生存および血管新生を促進するのかも知れない。腫瘍細胞表面におけるHAの存在は、骨髄での腫瘍細胞の捕捉を促進するらしく、結果として組織への進入と成長の維持のためのシグナルを伝達するのかも知れない。これは進行した前立腺がん患者における病態の臨床的に重要な特徴であり、治療の標的として用いられる可能性がある。
今後取り組むべきいくつかの重要なトピックが残っている。腫瘍におけるHA合成、またはパラクライン的にHA合成を促進する腫瘍の能力は、原発部分での成長と血管新生を促進する重要な因子かも知れない。さらに腫瘍に結合したHAは、局部での腫瘍拡大、転移および/または局部リンパ節内での成長、または骨や他の二次的部位における成長に重要であるのかも知れない。局所における腫瘍の進展と転移におけるHAの影響は、HAポリマーと腫瘍細胞の持つHAレセプターの相互作用を含むらしく、このレセプターは細胞の生存、成長および運動性の増強へと導く細胞内シクナル伝達経路を調節する。性質のよくわかったヒト腫瘍細胞株の使用は、これらの課題を解明する1つの重要なツールであるが、前立腺ガンのトランスジェニック動物モデルの使用もまた、前立腺ガン進行の各ステージにおけるHA代謝の異常調節の重要性を研究するのに不可欠であろう。ヒトにおいて、HASの発現または活性を変化させることは、侵襲的で転移性を示す原発腫瘍の補助的治療に用いることが出来る新規な治療のアプローチを提供するかも知れない。ホルモン遮断療法にもはや応答しない、転移または局所再発腫瘍においてもHASをターゲットとすることは可能かも知れない。このような治療は、特にQOL低下を伴う重大な臨床的問題の原因となる骨転移腫瘍に対して、よりよい制御と管理への道を開くかも知れない。