
Forteza博士は1987年、アルゼンチンの国立コルドバ大学医学部からM.D.を得た。彼女はアルゼンチンで、内科および肺と重症例の治療訓練を受けた。彼女の研究歴は、1991年にMiami大学Mount Sinai Medical Centerに移り、そこでAdam Wanner とWilliam Abraham両博士に会い、気道生物学と喘息の生理病理学に興味をもったことから始まった。肺と重症例治療部の研究員として、彼女は気道の炎症を持続する因子としての、キニンの産生に焦点を当てた。1995年彼女はMiami大学に移り、そこで細胞生物学・解剖学講座の、後に彼女のよき指導者となったGregory Conner博士に会い、彼は細胞および分子生物学的技術の気道生物学への応用を導いてくれた。彼女はヒアルロン酸が、キニン産生酵素の活性を制御するカギであることを発見した後、気道におけるヒアルロン酸の役割と、気道の恒常性への寄与を研究するため、ConnerおよびMatthias Salathe両博士(下記Profile参照)と協力体制を作り上げた。現在Forteza博士はマイアミ大学医学部内科助教授として、肺と重症例治療部における研究に専念している。

Conner博士は1972年Vanderbilt大学から分子生物学のB.A.を取得し、1978年Florida大学から生化学および分子生物学のPh.D.を得た。その後彼はニューヨークRockefeller大学のGünter Blobelの細胞生物学研究室に加わり、リソゾーム酵素であるカテプシンDの生物発生について研究した。Conner博士は1984年教官としてMiami大学医学部の細胞生物学・解剖学講座に移った。彼の現在の研究は、気道での反応性酸素の代謝と、気道での感染に対する宿主防御におけるペルオキシダーゼの役割を中心としている。現在彼は細胞生物学・解剖学の助教授であり、Miami大学医学部の肺と重症例治療部門の研究主任である。

スイス生まれのMatthias Salathe博士は1986年Basel大学からM.D.を得た。スイスで臨床医としての訓練を受けた後、1991年Miami大学へリサーチフェローとして移動し、そこで彼はほ乳類繊毛の細胞学的、および分子的制御メカニズムの研究を開始した。Howard Hughes Medical Instituteにより支援されて、分子・細胞薬理学講座のポストドクを終了後、1997年彼は肺と重症例治療部門に教官として採用され、現在はここで内科と、分子・細胞薬理学の助教授の地位についている。気道においてHAが繊毛運動を制御していることを発見し、ConnerおよびForteza両博士との活発な共同研究が始まった。
安静時の呼吸では、気道は1日当たり20,000 Lもの空気を肺胞へ送り込んでいる。清浄空気の基準においても、1日当たり1〜2×105 個までの細菌(約8,500細菌/m3空気)と、100 mgまでの不活性なほこりが吸い込まれる。この挑戦に対処するため、気道粘膜は種々のサイズと組成をもった空気中の物質に対し、洗練された防御を持たなければならない。
気道を守る防御システムの一つは粘膜繊毛装置である。これは、粘膜(杯)細胞と粘膜下腺により産生された分泌物により覆われた、繊毛を有する上皮細胞から成る(Fig. 1)。
正常な環境下では、気道表面に付着した吸入粒子は粘液によってとらえられ、次に繊毛の調和した運動により声門へ移送される。分泌作用そのものが、外来粒子のこの機械的除去を支援する追加の防御作用を提供する。これらの分泌液は、ラクトペルオキシダーゼ、リゾチームおよびラクトフェリンのような抗菌性物質や、分泌性ロイコプロテアーゼインヒビター(SLPI)および組織性メタロプロテアーゼインヒビター(TIMPs)のようなプロテアーゼインヒビターを含有し、これらが協力して気道の無菌性と恒常性を維持するために働いている。
呼吸器における分泌物は繊毛運動により定常的に除去されるので、種々の防御分子の合成と分泌の速度が、上皮表面におけるそれらの物質の利用度と活性を決める主な要素であると信じられてきた。この理論的枠組みは、例えば涙がまばたきにより除かれたり、小腸分泌物が蠕動により除去されるように、分泌物が速やかにかつ連続的に除去される他の粘膜表面にも適用されてきた。この総説で我々はこの概念にチャレンジする我々の最近の証拠をレビューし、ヒアルロン酸が気道上皮細胞の頂膜表面で、恒常性の維持に重要ないくつかの酵素を維持し、粘膜繊毛運動による除去から守っているという発見について議論する。そのようなメカニズムはヒアルロン酸(以下HAと略す)が存在する他の表面でも働いているであろう。
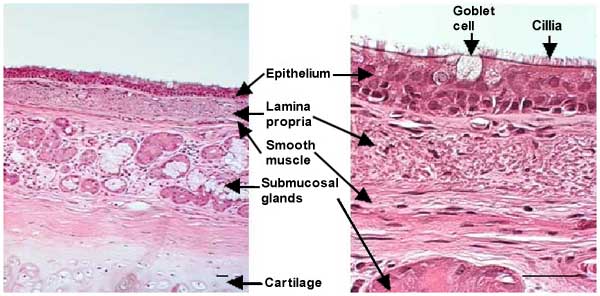
Fig. 1 ヒト主気管支の断面 棒線=50μm
空気を口から気体交換装置(肺胞)へ送るチューブ構造の気道は、粘液を分泌する杯細胞を含む繊毛を持つ偽層状の円柱上皮細胞により被われている。固有層は基底膜の下にあり、縦方向の弾性線維の束を有するゆるい結合組織を含んでいる。平滑筋層は固有層の外側にリングを形成している。粘膜下腺は固有層の下に見られる。直径2mm以上の気道においては、コラーゲン線維と軟骨から成るさらに外側の層が存在する。気道上皮細胞を覆う分泌物は、通常2層に分かれている:1つは主にO-リンク糖タンパク質またはムチンのような巨大分子を含む粘液層で、吸入されここに捕獲された粒子が保持される。もう1つは繊毛周囲の液層で、これは繊毛により打たれ、第一の粘液層を声門に向かって移動し、ここで飲み込まれる。
HAは肺実質の細胞外マトリックスの重要な成分として知られており、肺の発達において大きな役割を果たしている。HAの分子量の変化や、蓄積と/または除去は、炎症細胞が間質に流入したり、1,2 腫瘍が発生とか転移したり、ブレオマイシン誘導による間質性肺線維症と瘢痕形成3-6等に伴っておきている。 HAはまた気道の分泌物中にも見いだされていたが、これまでその役割についてはあまり研究されてこなかった。この“分泌物”中のHAが今回のレビューにおけるトピックスである。
1970年代の初期に、人の正常および疾病における肺から得た気管支肺胞洗浄液中の、HA含量を調査したという多くの論文が出た。喘息や慢性気管支炎患者だけでなく、肺胞タンパク症や成人呼吸困難症候群の患者からもHAレベルの増加が見られた。7-9 気管支肺胞洗浄液中でHA含量が増加していることは、間質組織の損傷の徴候であると解釈された。しかしながら1988年には、HAが培養した正常粘膜下腺細胞から分泌されることが示された。10 その後HAは粘膜下腺の漿液細胞の生産物として、従って気管支分泌物の正常な成分であることが示された。11,12 気道におけるこれらの発見に加えて、HAは唾液、13 精液、14小腸からの正常な分泌物15および鼻粘膜からの正常分泌物16などの他の外分泌液中にも含まれることが示された。粘膜の表面で、HAは粘液の水和や表面保護、および上皮細胞修復に重要であると考えられており、これらのことはすべて気道において、粘膜繊毛による除去が適切に作用する上で不可欠である。例えば粘液の粘弾性の性質が変わったり、上皮細胞の修復が損なわれたりすると、外来物を含んだ粘液を気管支樹の外へ移送する繊毛の能力もまた損なわれることになろう。粘膜表面でHAはまた、細胞移動と成長因子の輸送体となったり、気管支分泌液に存在するプロテアーゼやプロテアーゼインヒビターと相互作用するなどの追加の役割も担っている。
我々は組織カリクレイン(以下TKと略す)と気道ラクトペルオキシダーゼ(LPOと略す)を研究してきた。これら2つは気道表面に分泌され、気道粘膜の防御に大変重要な酵素である。TKは粘膜下腺細胞で生産され、アレルギー性の気管支収縮に関係している。LPOは表面の上皮杯細胞と粘膜下腺細胞の両方で作られ、過酸化水素の掃除と細菌の除去に関係している。TKはセリンプロテアーゼであり、キニノーゲンを切り離して気道にリジル・ブラジキニンを遊離させる。ブラジキニンは気道の炎症における重要なメディエータであり、喘息の病態生理学に関係あるとされてきた。気道におけるTKの酵素活性の制御を研究してきて、我々は気管支TKがHAと会合し、それによってその酵素活性を阻害されることを発見した。17 TKがHAと結合することを示唆する最初の実験は、TKを気管支分泌液と一緒に陰イオン交換樹脂にかけたとき変わった溶出パターンを示したというものである。例えば膵臓や尿由来のような他のカリクレインは0.3〜0.5 M NaClで溶出するのに対し、気管支TKは1.8 M NaClで溶出した。このようなより強い結合は、TKが陰性電荷をもつ分子と会合していることを示唆した。気道分泌物中の候補分子としては、粘膜下腺から分泌されるGAGであるHA、ヘパラン硫酸(HS)およびコンドロイチン硫酸(CS)があった。Streptococcusヒアルロニダーゼでサンプルを分解すると、TKのクロマトグラフィーのパターンは“正常化”されたが、一方コンドロイチナーゼABC(pH 7.5で使用したが、このpHではほとんどヒアルロニダーゼ活性は見られない)またはヘパリナーゼではされなかった。気管支TKはHA-Sepharoseによるアフィニティークロマトグラフによっても精製できた。これらのデータは明らかにTKがHAと結合することを示した。
気管支分泌液をヒアルロニダーゼで処理するとTKの活性が600%増加した。HAの大分子を用いては阻害定数の評価は困難だが、リコンビナントのTKを用いた予備実験によると、少なくとも10糖のHAフラグメントはTK活性を阻害できる。TKは低分子量の蛍光ラベルペプチドを分解できるセリンプロテアーゼなので、HAによる酵素活性の阻害は、TKに対する蛍光ラベル基質を予めしみこませた 湿らせたセルロースアセテート膜を用いた、膜の重ね合わせ技術によって視覚化できる(Fig. 2)。
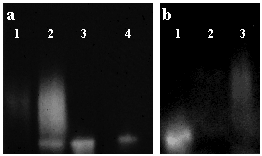
Fig. 2
粘膜下腺細胞培養からの上清を非変成条件下で電気泳動にかけた。酵素活性は、蛍光ラベルTK基質を含む膜を重ね合わせることにより視覚化した。
(a) レーン1:無処理サンプルはTK活性のかすかなシミを示している。レーン2,3:ヒアルロニダーゼで3h(レーン2)と18h(レーン3)処理したものでは、TK活性は増加し、一方分子としての不均一性は減少し、18hサンプルではリコンビナントTK(レーン4)と同じ位置にシングルバンドを示した。 (b) HAを添加すると不均一性が戻った。レーン1:ヒアルロニダーゼ分解サンプル レーン2:ヒアルロニダーゼ処理前 レーン3:ヒアルロニダーゼ分解サンプルに過剰のHAを加えた。Am J Respir Cell Mol Biol 21(6):666-674より許可を得て転載
TKは気道においてHAと結合し阻害されるので、HAの分解はTKを活性化し、結果としてキニンを生じさせる。気道においてHAの分解は、内在性の細胞源からの、または感染中には細菌源からのヒアルロニダーゼにより、または上皮細胞によりまたは炎症中は気道へリクルートされる食細胞から生じる、反応性の酸素と窒素種により行われる。HAを分解できる反応性酸素と窒素の分子種とともに、それらの比較能力が徹底的に研究された。18-21 アレルギー性気管支収縮は、気道において反応性の酸素と窒素種の増加を伴っている。従って、その結果としてのHA分解の増加は、少なくとも部分的には、アレルギー反応の間のTKの活性化とキニンの産生の原因となろう。この仮説を支持して、我々は喘息の動物モデルで、エアゾール化したHAがin vivoで、TK伝達性の気管支収縮を防止することを示した。22
一般に、HAに対する結合“モチーフ”としての特異的アミノ酸シーケンスはないと考えられている。多くのHA結合タンパク質は「リンクモジュール」を含み、これは約100個のアミノ酸より成り、4つのシステインジスルフィド結合と他の高く保存された残基をもつ領域である。a
a このシリーズのDayによるレビューを参照。
一方、HA結合性タンパク質の数は増加中で、これらはアミノ酸1次配列のレベルではお互いに関連していない。TKのシーケンスはリンクモジュールを含んではいないが、表面の触媒サイトの近くに塩基性アミノ酸のクラスターがあり、これはHA結合部位のよい候補である(Fig. 3)。しかしながら正確な結合サイトは研究中である。
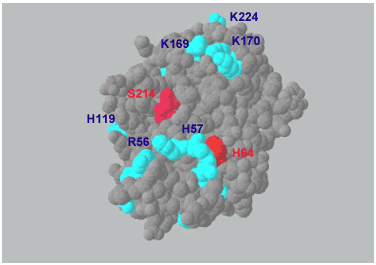
Fig. 3 0.2 nm解像度におけるリコンビナントTKの3次元構造23
H64とS214は活性触媒サイトであり(赤);推定上のHA結合サイトは塩基性アミノ酸の表面クラスターでR56、H57、H119、K169、K170、K224(青)から成る。
我々は気道におけるTKの局在を明らかにするために、免疫組織化学を用いた。そしてこれが予想通り粘膜下腺細胞にあるのを見いだしたが、驚いたことに気道上皮細胞の繊毛の縁に沿っても存在することを発見した(Fig. 4)。これに加えて、粘膜下腺細胞を含むヒツジ気道上皮細胞の、初期培養におけるTKの局在部位を調べたところ、繊毛に沿って特異的な染色が見られた。気道に分泌される他の酵素であるラクトペルオキシダーゼ(LPO)もまた繊毛の縁に局在していた。上皮細胞上にはこれらの酵素に対する既知のレセプターはない。しかしながらHAは同じ位置に存在しており(Fig. 4)、従って我々はHAが、気道上皮細胞の頂膜でこれらの酵素を固定することに関与しているかどうか知りたかった。ヒアルロニダーゼ処理により、繊毛先端におけるHA,LPOおよびTKの染色は除去された(pH 7.0におけるコンドロイチナーゼABC、またはヘパリナーゼでは除去されなかった)が、アルシアンブルーとPAS陽性物質がそこに残っていることより、上皮細胞の頂膜からすべての複合糖質が除かれたのではない(Fig. 4)。我々はHAがTKと特異的に相互作用することを知っているが、LPOアミノ酸シーケンスにも特異的HA結合サイトは見られない。LPOは塩基性のpIをもっており、従ってHAとイオン的相互作用で結合できる。しかしHAは、気道上に存在するグリコサミノグリカン(GAG)の中でもっとも高い電荷密度をもってはいないので、LPOはHAと会合している他のGAGのイオン的相互作用で結合している可能性もある。我々の実験ではこれら2つの可能性を区別できなかった。以上を要約するとこれらのデータは、生合成されてきたか、または細胞膜に結合したHAが、気道の上皮細胞表面でTKとLPOをつなぎ留めることを示している。
我々の結果は、気道上皮細胞におけるHAの局在に関する以前の組織化学によるレポートで24上皮細胞の側底膜のみに限局して見つかったというものと異なっていた。これらの著者は病理標本から得たパラフィン包埋切片を用いており、組織の保存または処理の違いによって、このような見かけ上の不一致が生じた可能性がある。
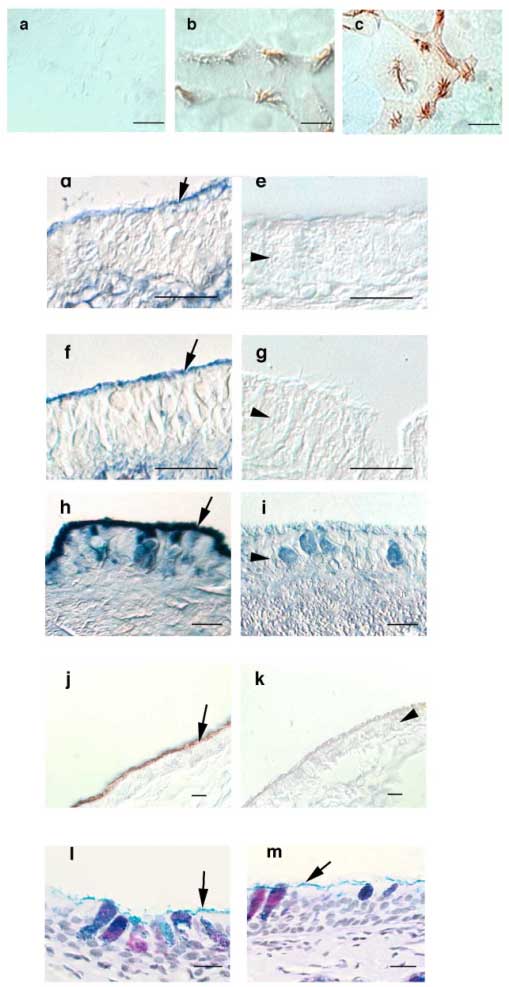
Fig. 4 気道上皮細胞におけるTK,LPOおよびヒアルロン酸の染色(微分干渉顕微鏡像)。
培養した気道上皮細胞 (a-c)を固定、透過処理し(a)免疫前血清(b)抗LPO抗体(c)抗TK抗体を用いて標識した。その後西洋わさびペルオキシダーゼを結合させた第2抗体で可視化させた。繊毛の特異的染色が見られる。気管のパラフィン切片をビオチン化したHA結合タンパク質と、アビジンーアルカリフォスファターゼで染色すると(d-g) HAは既知の局在部位である粘膜下間質に加え、上皮細胞の繊毛の縁にも局在することが示された。ヒアルロニダーゼで処理するとHAの特異的染色は除去された(e)が、pH 7.5においてコンドロイチナーゼABCで処理してもHAの染色パターンは変わらなかった(f)。一方コンドロイチナーゼをpH 5.6で用いたところ、このpHではヒアルロニダーゼ活性を示すので、HA染色は切片から除かれた(g)。抗LPO抗体とニトロブルーテトラゾリウム/5-ブロモ-4-クロロ-3-インドリルリン酸でラベルするか(h)、抗TK抗体とジアミノベンチジンでラベルすると(j)、やはり気道上皮細胞の繊毛の縁に沿って特異的染色が見られる。ヒアルロニダーゼ処理するとLPO(i)とTK(k)は除かれた。ヒアルロニダーゼは上皮細胞の縁から、すべての複合糖質を除くのではないことは、処理前(l) 後(m) でアルシアンブルー・PAS染色することによって分かった。全ての棒線は10 μMを示す。矢印は上皮の繊毛の縁を指している。矢頭は上皮細胞層を指す(iでは杯細胞も示す)。FASEB J 15(12):2179-86から許可を得て転載
我々はHAと気道上皮細胞の頂膜極との間のみならず、TKとの間の相互作用も視覚化することと、その生物学的関連性をテストするため追加のアプローチを用いた。安楽死させたヒツジから新たに単離した気管にex vivo の条件下で、蛍光ラベルしたタンパク質を管腔面に添加した。これらの標品の繊毛は調和した運動を維持して、気管支分泌液を近位端に移送するので、in vivoでのように蛍光標識の移動を見ることができる。Fig. 5で見られるように、フルオレセインで標識したTKはスポットした場所で動かないが、一方ローダミンで標識したBSAは繊毛運動により移動した。この移動の結果、当初の混合物でのオレンジ蛍光色は緑(TK)と赤(アルブミン)のバンドにきれいに分かれた。これはBSAが気管の近位端に自由に動くのに対し、TKは固定化されたことを示している。ヒアルロニダーゼで前処理すると、フルオレセインとローダミンの標識は一緒に近位端へ移動したことから、TKはHAにより固定化されたことが分かる。

Fig. 5
粘膜繊毛移送システムにおいて、HAと結合したTKの移動は変化させられるがアルブミンは影響されない。新たに安楽死させたヒツジの気管を膜部分で切り開いた。白い矢印は気管の近位端を指し約2cmの長さを示している。a/bとc/dの各パネルはそれぞれ同じ気管の0時間(aとc)と30分後(bとd)を示す。フルオレセイン標識したTKと、ローダミン標識したアルブミンを混合して気管表面にスポットすると、0タイムでオレンジ蛍光の混合色を示した (a)。 37℃(加湿)で30分インキュベート後フルオレセイン標識TKはスポットした位置で動かずに緑の蛍光バンドを示した。一方赤い蛍光のアルブミンは、TKから分かれて気管の近位端の方向へ移動した。(この実験では約2.5 cm移動)(b)。 もう一方の気管はヒアルロニダーゼ前処理してからTKとアルブミンの混合物をスポットした (c)。 こちらは30分の観察期間にTKもアルブミンも分離せずに約2.5 cm移動した (d)。FASEB J 15(12):2179-86から許可を得て転載
HAは気道上皮細胞表面にTKを保持しているので、我々はHA結合レセプターも発現されているかどうかを調べた。HAレセプターとして知られているものとしてはCD44,ICAMそれにCD168(またはRHAMM: receptor for hyaluronic acid mediated motilityともいう)が含まれる。以前の報告によるとCD44は上皮細胞の側底膜側に見られるが、正常な繊毛化された気道上皮細胞の頂膜にはなかった。25 それに加えて、精液中のHAは、RHAMMと相互作用することにより精子の運動に必須であることが分かった。b
b このシリーズのTurleyとHarrisonのレビュー参照。
RHAMMは精子の鞭毛に発現されており、その超微細構造は繊毛と特徴を共有し、鞭毛運動を制御しているので、我々は免疫組織化学とPCRを用いてヒツジ気管上皮にRHAMMが発現されているか調べた。抗RHAMM抗体(R36:ペンシルベニア大R. Savani博士から供与された。)により、繊毛を持つ細胞の頂膜部分でRHAMM特異的染色が見られたが、杯細胞では全く見られなかった(Fig. 6)。免疫細胞化学の手法により、RHAMMが培養した繊毛細胞にも存在していることを証明した。
この抗体により認識された上皮のエピトープは、実際にRHAMMであるというさらなる証拠は、我々のヒツジ気管粘膜cDNAライブラリーと、RHAMMの特異的プライマーを使って得られた。PCR反応により、マウスRHAMM cDNAから得た増幅対照品と一緒に移動する、予想したサイズのバンドが得られた。このフラグメントの塩基配列が決められ(GenBank 登録番号:AF 310973)、推定アミノ酸配列によれば、ヒトと91%一致し、またマウスの配列とは81%一致した。
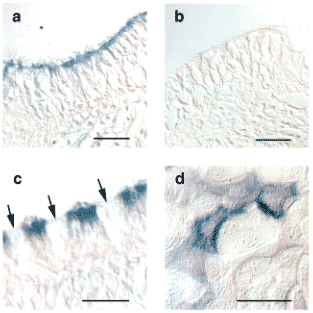
Fig. 6 ヒツジ気道上皮細胞でのRHAMMの免疫組織化学および免疫細胞化学的検出
培養細胞 (d)または気道切片 (a-c)をアフィニティーで精製したRHAMM抗体 (a,c,d)で、または免疫血清 (b)で染色した。繊毛化された細胞の頂膜部分(繊毛そのものも含む)は特異的にラベルされたが(a,c)、一方杯細胞はされなかった(c)。矢印は杯細胞を示す。FASEB J 15(12):2179-86から許可を得て転載
RHAMMに結合したHAが精子の動きを促進することにより、我々はin vitroにおける繊毛運動振動周波数(CBF:ciliary beat frequency)に対するHAの効果についても、デジタルビデオ顕微鏡を用いて研究した。内在性のHAをヒアルロニダーゼで除去した後、培養繊毛化上皮細胞を、50-100μg/mlの平均分子量約100 kDa HAにさらすと、振動周波数(CBF)は、ベースラインから約15%増加した。26この増加はHAの製造メーカーによる差の影響は受けなかった(Worthingtonと生化学工業からのHAはどちらも等しく効果があった)。しかしながらヒアルロニダーゼで分解(18 h)したHAは、CBFに効果を示さなかった。27これらの発見は森本ら28による以前の研究とは対照的であった。すなわち彼らの実験では、鼻細胞において高分子量HA(1,000 kDa以上)はCBFに効果がなかった。しかしながら多くの研究から現在では、いろいろな細胞へのシグナル伝達において、低分子量のHAは、高分子量のものと比較してより顕著な生物活性を有することが示されている。従ってこれらの観察結果は必ずしも驚くことではなく、全く矛盾していない。実際、正常に気道に分泌されるHAは、その平均分子量がかなり高い(数百kDa)ので、CBFに対し効果を示さないと推測できる。しかしながらもしHAが気道で低分子化されると(例えば反応性の酸素または窒素類により)、CBFは促進される。このことは気道から有害な刺激物を除去するという、固有の防御反応とよく適合するだろう。
HAがCBFを促進する一方で、抗RHAMM抗体で機能をブロックするとHAへの反応は完全になくなった。非特異的な対照としての抗ニワトリIgGウサギ抗体で細胞を処理しても、無処理と区別できないようにHAに対し反応した(Fig. 7)。これらの実験はCBFを高めるというRHAMMの機能的役割をはっきり示している。しかしながらRHAMMは膜貫通シグナル伝達成分を有していないので、このプロセスにおける正確な役割は不明である。この興味深い問題を解明するためには将来の研究が必要である、なぜならばRHAMMによって活性化される数少ないシグナル伝達経路(例えば、ERK)が、CBFを制御しているという報告はなかったし、それらは通常HAへのCBFの観察された反応よりも遅いからである。
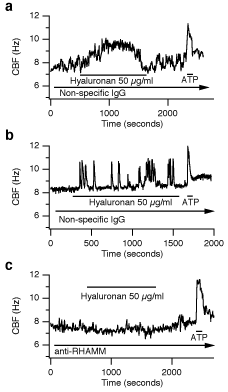
Fig. 7
HAによるCBFの増加は抗RHAMM抗体によりブロックされる。ヒツジ気管上皮細胞の初代培養において、対照であるIgG抗体の存在下(aとb)または抗RHAMM抗体存在下(c)でCBFを測定。外部から50μg/mlのHAを加えたときのCBFを連続的に記録した(n≧8)。2種類の反応が見られ:(a)CBFが一過性だが連続的に増加するものと(b)変動するものである。どちらのタイプのHAへの反応も抗RHAMM抗体を用いるとブロックされた(c)。3つ全ての系で、20μM ATP添加により統計的に相互に差のない、CBFの一時的増加が見られた(a-c)。各試薬添加の継続時間は水平の線で示した(矢印は連続して存在していることを示す)。FASEB J 15(12):2179-86より許可を得て転載
少なくとも一部の気道HAは、上皮細胞の頂膜部に固定され、そこでHAは分泌タンパク質と結合し保持できるという事実は、上皮細胞表面に分泌された酵素は機械的作用により速やかに除去されるという、一般的概念を否定するものである。他の粘膜分泌液もHAと多分他のGAGを含むので、気道におけるこれらの観察は、分泌液に浸され、機械的プロセスで除去される他の上皮にもあてはまるかも知れない。
HAはいかにしてTKや他の気道タンパク質と結合するかは知られていないが、いくつかのメカニズムが考えられる。TKの3次元構造を見ると、TKの活性サイトの近くに塩基性アミノ酸があり、これがHAと強く結合できる可能性がある。 一方LPOのアミノ酸配列は、リンクモジュールまたは明確なHA結合可能サイトを含まない。前に述べたように、LPOは塩基性pIをもち、GAGと非特異的イオン相互作用で結合できる。実際HA(または他のHA結合能力を持つGAGやタンパクも)は一般に、気道に存在するいくつかの塩基性タンパク質と結合できるカチオン交換体として作用するようだ。これらのタンパク質の多くは抗菌性タンパク質とデフェンシンなどのペプチドである。
要約として、我々はモデル(Fig. 8)を提案する。ここではHAは粘膜の宿主防御において、以前には認識されていなかった中心的役割を果たす。HAは恒常性維持に重要ないくつかの酵素を、粘膜表面の頂膜側に保持・制御しており、HAが分解され上皮が傷害を受けるとき、それらを遊離しいくつかは活性化される。酵素の遊離と同時に、小さくなったHA断片が繊毛運動を促進し(RHAMMとの相互作用を通じ)、その結果異物を粘膜表面から除去する。ここに示したデータは、上皮に結合したHAが、宿主防御に重要な分子のプールを保持し、「いつでも使えるように用意し」、繊毛運動による除去から保護するという粘膜保護の新しい理論的枠組みを示している。
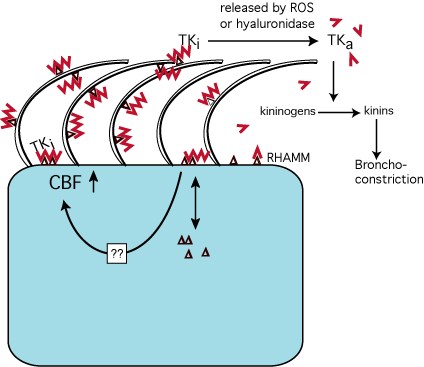
Fig. 8
気道におけるヒアルロン酸の機能モデル粘膜下腺細胞からの分泌液はHA(![]() )、LPOおよびTKを含む。HAはRHAMM(
)、LPOおよびTKを含む。HAはRHAMM(![]() )と、多分他の表面レセプター(示さず)と結合する。RHAMMは繊毛膜上に描かれているが、この部位に発現されているという公式の証拠は得られていない。HAがRHAMMと相互作用すると、CBFを促進し、それによって異物粒子の除去が促進される。同時にLPOとTKは頂膜表面に保持され、繊毛運動による排除から守られている。LPOは静電気的作用で直接または間接にHAと結合し(表示せず)、一方TKはHAと特異的に結合し、その結果TKは不活化される。気道表面におけるHAの正常な代謝速度はまだ求められていない。しかしながらもし傷害により反応性酸素(ROS:例えば喘息時)の遊離または、ヒアルロニダーゼが遊離されると、HAは低分子化されTKが遊離し、それによって活性化(TKa)されてキニンを生じ、これは気管支収縮を引き起こす。いくつか疑問点が残っている:RHAMM以外に頂膜表面に他のヒアルアドヘリンがあるのか。CBFを増加させるRHAMMのシグナリングはどのようにして起こるのか。それに頂膜側の細胞内外にあるRHAMMの代謝または交代はどのように制御されているのか?
)と、多分他の表面レセプター(示さず)と結合する。RHAMMは繊毛膜上に描かれているが、この部位に発現されているという公式の証拠は得られていない。HAがRHAMMと相互作用すると、CBFを促進し、それによって異物粒子の除去が促進される。同時にLPOとTKは頂膜表面に保持され、繊毛運動による排除から守られている。LPOは静電気的作用で直接または間接にHAと結合し(表示せず)、一方TKはHAと特異的に結合し、その結果TKは不活化される。気道表面におけるHAの正常な代謝速度はまだ求められていない。しかしながらもし傷害により反応性酸素(ROS:例えば喘息時)の遊離または、ヒアルロニダーゼが遊離されると、HAは低分子化されTKが遊離し、それによって活性化(TKa)されてキニンを生じ、これは気管支収縮を引き起こす。いくつか疑問点が残っている:RHAMM以外に頂膜表面に他のヒアルアドヘリンがあるのか。CBFを増加させるRHAMMのシグナリングはどのようにして起こるのか。それに頂膜側の細胞内外にあるRHAMMの代謝または交代はどのように制御されているのか?