
岐阜県多治見市生まれ。大学時代から名古屋に住んでいる。名古屋大学理学部卒業後20年間奉職し、1987年より愛知医科大学・分子医科学研究所の開設時に移り、1991年研究所長、教授となり現在に至る。この間、1978年から2年間、NIHのG. R. Martin博士の招聘により、visiting associateとしてNIHに留学した。1993年NIH Scholar-in-Residenceの資格を受ける。米国、NIHでの2回の研究の機会を得たことで、医学における基礎研究の重要性を認識した。研究テーマは細胞外マトリックスの役割、中でもプロテオグリカンの生理機能の研究で微少環境としての細胞外マトリックスの重要性を目に見える形で具体的に明らかにしたいと考えている。名古屋をプロテオグリカン研究の発信地にと願っている。

中国福建に生る。1993年中国浙江大学、生物科学技術系を卒業し、2001年愛知医科大学でPh.D.の学位を得た。彼のglycobiologyに対しての興味は中国科学院、上海生化学研究所の孫册教授の研究室で、精子と卵子の相互作用におけるレクチンの役割を研究していた時に芽生えた。3年間の中国水稲研究所光温依存性雄性不稔研究室助手を経て、1997年より愛知医科大学分子医科学研究所研究員、大学院研究生となった。2001年より長寿科学振興財団リサーチ・レジデント。現在SHAP—ヒアルロン酸複合体の生物学的機能について精力的に取り組んでいる。
ヒアルロン酸(以下HAと略記)はβ1,4-グルクロン酸−β1,3−N−アセチルグルコサミンの2糖の繰り返しからなる直鎖状のグリコサミノグリカンである。HAは他のグリコサミノグリカンの様に硫酸化されることもなく、またコアタンパク質とも結合していない。構造的に極めて単純であるにもかかわらず、HAは様々なHA−結合タンパク質やプロテオグリカンと相互作用を持ち、幅広い生物活性を示すa
。相互作用のほとんどが非共有結合であるが、SHAP (Serum-derived Hyaluronan-Associated
Proteins)とのそれだけは共有結合である。従って、SHAP-HA複合体は共有結合したHA−タンパク質結合を持つ唯一の例と言える。最近の研究から、このユニークな分子複合体の形成が、ある種の細胞外マトリックスの主成分としてHAが機能を果たすためには必須であることが分かった。
a このシリーズのDayの総説を参照
SHAP−ヒアルロン酸複合体は、当初血清存在下で培養したマウス皮膚線維芽細胞のHAを多量に含む細胞外マトリックス(以下HAリッチマトリックスと言うことにする)から分離された1。分子量83 kDaと85 kDaのタンパク質は、通常の分子間会合が解離する溶液中(例 6 M グアニジン塩酸)や、変性する条件下 (例 10 mM ジチオスレイトール含有1 % SDS中で煮沸) でさえHAと固く結合したままであった。しかしこのタンパク質は、Streptomyces ヒアルロニダーゼやコンドロイチナーゼABCによる消化、あるいはアルカリ処理(0.02 M NaOH、30分間、室温)ではHAから遊離した1,2。タンパク質は培養液に加えられた血清に由来することが分かり、SHAPと命名された。それらのアミノ酸配列を分析して、SHAPはInter-α-Trypsin Inhibitor (ITI)ファミリー分子の長鎖と同一であることが明らかになった3。
ITIファミリー分子は共通の成分であるビクニン(約40 kDa)短鎖と、1本あるいは2本の長鎖(約80 kDa)から成っている(Fig.1a) (概説はref. 4を参照)。ビクニンは、トリプシンインヒビター活性を持つことで古くから研究されてきたが、実はプロテオグリカンで、コアタンパク質の10番目のセリン残基にO−グリコシド結合した繰り返し2糖が約15個あるコンドロイチン4-硫酸鎖を含んでいる。長鎖は、そのC-末端のアスパラギン酸残基と、ビクニンのコンドロイチン硫酸の鎖中のN−アセチルガラクトサミン残基との間でエステル結合している5。このようなタンパク質−グリコサミノグリカン−タンパク質結合は、ITIファミリー分子に特有のようである。3種類の長鎖、HC1、HC2およびHC3は3つの異なる遺伝子によりコードされており、それらは色々の組み合わせでビクニンに結合している4。プレ−α−トリプシンインヒビター(PαI)は長鎖が1本だけ結合しており、ヒトとげっ歯類ではHC3が、ウシではHC2である。ITIは2本の長鎖を持つが、その組み合わせはヒトではHC1とHC2、ウシでは HC2とHC3、げっ歯類では両タイプといったように異なっている。
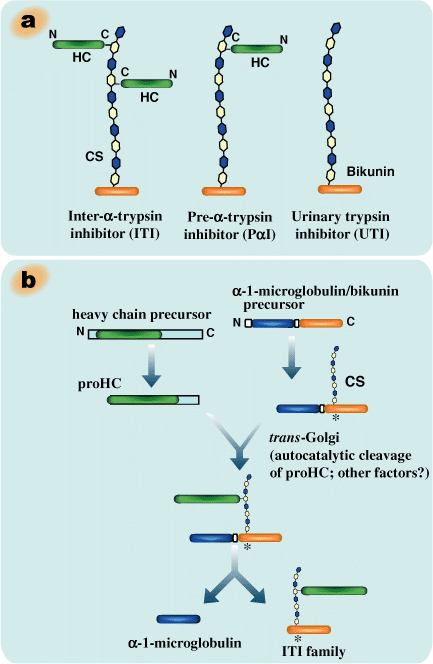

Fig. 1 インターα−トリプシンインヒビター(ITI)ファミリーの模式図とその細胞内での形成の概要
a)ITIファミリー分子は小さなコンドロイチン硫酸プロテオグリカンの共通短鎖、ビクニンと、遺伝学的には異なるが関連した3つの長鎖のうちの1つあるいは2つから構成される。長鎖のC−末端はユニークなエステル結合でコンドロイチン硫酸に連結している。b)ビクニンタンパク質に対する遺伝子は、他の血清タンパク質、すなわち長鎖の結合が完了するまでビクニンと結合しているα−1−ミクログロブリンもコードしている。長鎖はN−末端、C−末端ともに伸長ペプチドがついた形で合成される。N−末端の伸長ペプチドは非常に早期に小胞体中で切り離される。C−末端の伸長ペプチドはtrans-ゴルジの中で、おそらくは低いpHが引き金となる自己触媒的な開裂メカニズムで遊離される。ビクニンのコンドロイチン硫酸鎖に長鎖がエステル結合するメカニズムは分かっていない。c)ビクニン中のコンドロイチン硫酸結合部位の保存(図1bでは*で図示)。矢印はα−1−ミクログロブリンとビクニンが解離する際のタンパク質分解部位。
肝臓はITIファミリー分子を合成し、血流中へ分泌する主臓器である。ITIファミリー分子の複雑な構造が細胞内でどのように結合されるかは肝細胞を用いて研究された(Fig. 1b)。ビクニンの遺伝子は、他の血清タンパク質、α−1−ミクログロブリンもコードしている。この遺伝子は2つの先祖遺伝子が癒合して一つになったと考えられるが、これらの2つのタンパク質間に構造的にまた機能的にも意味のある関係は見つかっていないので、どうしてこのようになったかは不明である。α−1−ミクログロブリン配列部分が隣接するビクニン部分の翻訳後のグリコシレーションや硫酸化反応をなにがしか修飾している可能が示唆された6。前駆体ポリペプチドでは、α−1−ミクログロブリンとビクニンとがテトラペプチドから成るコンセンサス配列で結合されており、その配列中には塩基性アミノ酸(通常アルギニン)が開裂部位から-4、-2、および-1の部位にある (Fig. 1c)。このコンセンサス配列は細胞内プロテアーゼfurinの典型的なターゲットとして知られているが、α−1−ミクログロブリン/ビクニン cDNAをトランスフェクトした場合、furin欠損CHOミュータント細胞系でも2つのタンパク質は正常に分離された6。いずれにしても、前駆体タンパク質の2つのタンパク質への開裂は、コンドロイチン硫酸鎖の合成と長鎖の集合付加がビクニン部分になされた後にpost-ゴルジ領域で生じるという7,8。
長鎖はN−末端とC−末端の両方に完成品にはみられないペプチドがさらについた状態で合成される(Fig. 1b)。それらのN−末端プロペプチドは小胞体中で、分泌タンパク質が通常受けるよりも早期に切り離されるらしい9。240〜300アミノ酸残基から成る大きなC−末端のプロペプチド部分はtrans-ゴルジ体の中で、コンドロイチン硫酸鎖に長鎖がエステル結合される間に遊離される。N−末端のこの伸長ペプチド部分はITIファミリー分子の合成、分泌には影響しないらしい。しかしながらC−末端側の伸長ペプチドが無いとCHO細胞中で共発現したビクニンに結合できなかったことから、このC−末端の伸長ペプタイドの存在は長鎖のエステル結合のためには必須である10。エステル結合するアスパラギン酸残基(D)のすぐ後に続くPHFII(Pro-His-Phe-Ile-Ile)配列は、様々の動物種の3本の長鎖の全てに保存されている。このような配列に特異性を持ったプロテアーゼはこれまで報告されていない。最近の研究では、低いpHはD(Asp)とP(Pro)との間の自己触媒的な開裂の引き金になり得ること、その開裂はC−末端ペプタイドの中の或る配列で調節されることが示された11。しかしながらアスパラギン酸残基とコンドロイチン硫酸との間のエステル結合がどのように形成されるかは、まだ謎である。
ITIファミリー分子は0.15 - 0.5 mg/ml濃度で血中に豊富にあるが、長鎖が欠けたビクニンだけのものはほんの僅かである。しかしながら、この遊離のビクニンは尿中では通常尿トリプシンインヒビター(UTI)と呼ばれており、ファミリー分子のほとんどを占めるようになる。従って、ビクニンは、尿中へ排泄されたITIファミリー分子の代謝物と考えてよい。
SHAP−ヒアルロン酸複合体の糖鎖−タンパク質結合部位の構造解析から、HA鎖中のN−アセチルグルコサミン残基のC-6位水酸基と、長鎖のC−末端にあるアスパラギン酸残基との間のエステル結合が明らかになった2 (Fig. 2a)。またこのエステル結合は、コンドロイチン硫酸中のN−アセチルガラクトサミンがN−アセチルグルコサミンに置き換わった、ITIファミリーのそれと同等のものであった。従って、SHAP−ヒアルロン酸複合体形成は置換反応であり、そこではHAがビクニンのコンドロイチン硫酸鎖に置き換わる(Fig. 2b)。病態関節液から精製したSHAP−HA複合体の構造から、分子量200万のHAには3〜5個のSHAP分子が置き換わっていることが分かった(未発表データ)。このようなSHAP−HA複合体の多価性が、細胞外マトリックス中でのHA機能には重要であるらしい。
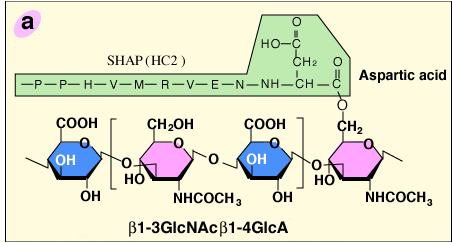
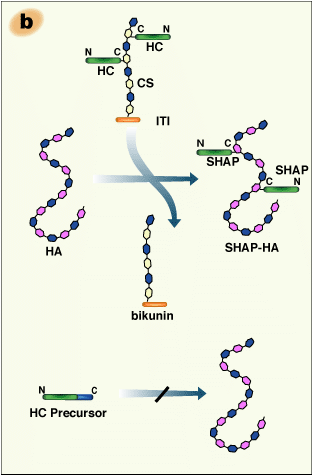
Fig. 2 SHAP-HA複合体形成の模式図
a)SHAP-HA複合体のタンパク質−グリコサミノグリカン結合領域の構造。各SHAPはそれぞれのC−末端アスパラギン酸のα−カルボキル基とHA鎖中の N−アセチルグルコサミンの6位の水酸基との間のエステル結合を介して、HAと結合する。b) HAはビクニンのコンドロイチン硫酸と置き換わり、ビクニンを遊離しながら長鎖とのエステル結合を形成する。
SHAP−ヒアルロン酸複合体は、in vitro系で、未同定であるが酵素活性の存在下、簡単にITIとHAから形成される1,3。この様な活性は顆粒膜細胞12、肝がんの細胞、神経膠腫細胞および肺線維芽細胞などの細胞を培養した後の培養液中や、血清中に存在する。EDTAの添加で完全にSHAP−ヒアルロン酸複合体の形成が阻害されることから、2価の陽イオンが反応には必要である。プロテアーゼ阻害剤は活性に影響しないことから、長鎖のタンパク質分解反応はHAへの転移には不要であることが示唆された3。HAオリゴマーのうち8糖およびそれ以上のものは競争阻害剤となった。他のグリコサミノグリカンであるコンドロイチン、コンドロイチン硫酸、デルマタン硫酸、ヘパラン硫酸およびデキストラン硫酸はいずれも5 mg/mlの高濃度でも基質や阻害剤にならなかった1。興味深いことに、PGM/バーシカンの存在は有意に形成反応を促進した。SHAPのC−末端の反応はPGM/バーシカンのG1ドメインのHA結合部位の周辺か、部位上で起きる13。従って、PGM/バーシカンはITIとHAとの間をより近づけることで、その反応を起き易くしているのかもしれない。
長鎖とビクニンとの結合は、その後長鎖がHAへ転移するために絶対必須である。ビクニンが欠損した場合、長鎖はC−末端が長い前駆体のままで血中に分泌される。このような形ではSHAP−ヒアルロン酸複合体形成の基質にはならない14(Fig. 2b)。このことは血清酵素因子がエステル転移酵素である可能性とよく合い、プロテアーゼ阻害剤がこの反応に影響しない事実が説明できる。ITIファミリー分子のセリンプロテアーゼ阻害活性はビクニンの2つの隣接するKunitzタイプドメインに存在し、このことからビクニンと命名された。しかしながらその阻害活性は、α1−アンチトリプシンやα2−マクログロブリンのような他の血清プロテアーゼ阻害剤に比べかなり弱い。従って、血清中にITIファミリー分子は多量に存在するにもかかわらず、全部合わせても全血清プロテアーゼ阻害活性の約5 %にしかならない。このことが長期間に渡って、ITIファミリ−の生物学的機能をとらえ所がないものにしてきた(概説はref. 15を参照)。長鎖のHAへの転移にはビクニンが必要であるとの発見は、ビクニンが“SHAP—プレゼンテーション”分子であるという、これまでになかった新しい概念を打ち出した14。
長鎖はビクニンのコンドロイチン硫酸上にのみ選択的に結合するので、C1q阻害剤のような他の肝由来血清コンドロイチン硫酸プロテオグリカン上への結合はない14。このような特異性に関してのメカニズムは不明である。コンドロイチン硫酸−タンパク質橋渡し構造、HexUA-Gal(4S)-Gal-Xyl-Ser中のガラクトース残基の4位での硫酸化が、ITIとUTIでは共通して見られ、軟骨コンドロイチン硫酸プロテオグリカンではこの領域の硫酸化が不均一なことと著しい対照をなしている16。ビクニンにおけるコンドロイチン硫酸結合部位のセリンとその隣接残基は、サカナからヒトまでの種でよく保存されている(Fig. 1c)。興味深いことに、組み換え体糖付加なしのビクニンと、ウシ鼻中隔軟骨由来で糖をはずしたアグリカンコアタンパク質の比較で明らかにされたように、このセリンは軟骨プロテオグリカン中のものよりも、良いβ−D—キシロース転移酵素(コンドロイチン硫酸の生合成を開始する酵素)の受容体となる(それぞれKm = 0.9 µMと155 µM) 17。この特徴の違いが、SHAPが特異的にビクニンプロテオグリカンに集合付加されることと関係しているのかどうか、今後の検討が必要である。
SHAP−ヒアルロン酸複合体はHAリッチ細胞外マトリックスの構造および維持に重要な役割を果たしている。初期の観察により、ITIファミリー分子は培養線維芽細胞や中皮細胞の細胞外マトリックス中に、分泌したHAを引き留めるのに必要とされ、それはin vitroで膨張が誘導された卵丘においても同様であることが示された(概説はref. 18を参照のこと)。最近の結果からは、SHAP-ヒアルロン酸複合体の形成がITIファミリー分子の役割の基礎をなしていることが明らかになった14。
In vivoでのSHAP−ヒアルロン酸複合体の機能は、ビクニン遺伝子を不活化した結果その形成ができなくなったノックアウトマウスのモデル(ビクニンーヌルマウス)で明らかになった14。これらのノックアウトマウスでは長鎖を高レベルにもっているがITIファミリー分子はない。このビクニンーヌルマウスは、排卵前濾胞での卵丘膨張が異常であるため雌は重度の不妊症になる(Fig. 3)。卵丘膨張に、大量のHAリッチ細胞外マトリックスの貯留が関係していることはよく知られているb。ビクニン−ヌルマウスでは卵丘細胞は卵丘中に不規則に並び、濾胞腔内ではまばらにしかなく、卵丘HAリッチマトリックス形成が欠けていることが示されている。実際、ビクニン−ヌルマウスの交配0.5日目(0.5dpc)では輸卵管内の排卵された卵細胞は全てはだかであり、野生型マウスでHAリッチな卵—卵丘複合体が観察されることと全く対照的である(Fig. 3c)。卵丘膨張が無いと、卵子が著しく濾胞内に残存してしまい、排卵された卵数はビクニン−ヌルマウスでは57 %も減少した。さらに、ビクニン−ヌルマウスでは卵子の受精効率も著しく低下した。これらの一連の出来事は雌のビクニン−ヌルマウスに重度の不妊症をもたらす。重要なことは精製したITIを、排卵を誘発する性腺刺激ホルモンと一緒に腹腔内投与すると卵丘の膨張と正常の受精が回復したことである。従ってこれらのことから、血流循環しているITIファミリー分子は、主として卵丘細胞が分泌したHAとSHAP-ヒアルロン酸複合体を形成することでHAリッチ卵丘マトリックスの形成に関与すること、このことは卵丘の構造が機能を発揮するのに必須であること、が明らかになった。このマウスモデルの結果は、SHAP-ヒアルロン酸複合体の欠損が、排卵された卵丘を見つけることが難しい女性の不妊症、特に全不妊症カップルの15%を占める説明不能な不妊症メカニズムの1つの可能性であることを示唆している。
b このシリーズのSalustri and Fulopによる総説を参照
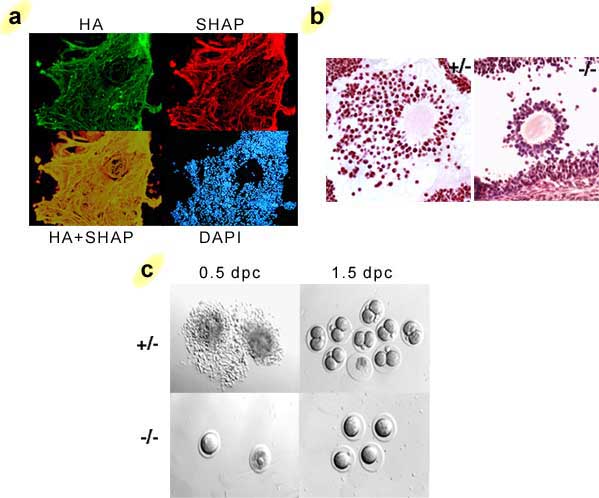
Fig. 3 卵丘マトリックス中のSHAP-HA形成は排卵および受精に必須
a)免疫組織学的に見た卵丘のHAリッチ細胞外マトリックスにおけるSHAP-HAの分布。SHAP(赤)はHAリッチマトリックスのネットワークのどこでもHA(緑)と共に局在している。 b)マウスでSHAP-ヒアルロン酸複合体形成が無くなると、卵丘構造の形成は損なわれる。ヒト絨毛性性腺刺激ホルモン(hCG)処理後10時間でのマウス卵巣の切片のhematoxilin-eosin染色。c)卵丘マトリックス形成の欠損は卵細胞の著しい濾胞内残留を引き起こす8。交配1.5日目のホモ接合卵細胞では受精が観察されなかった。
SHAP-HAがどのようにマトリックス形成に関与するかは今だ明らかでない。上述したPG-M/バーシカン−SHAPの相互作用に加え、もう一つの重要な候補はTSG-6遺伝子(Tumor necrosis factor-Stimulated Gene-6)の産物でHA結合リンクモジュールドメインを持った〜35kDaの糖タンパク質である19。TSG-6遺伝子の発現は卵丘が膨張するにつれて一過性にアップレギュレートされており、HA合成酵素(HAS-2)の発現が卵丘の膨張につれて増加してくることと似ている20。最近の結果で、TSG-6タンパク質が卵丘マトリックス中にあること、そして重要なことは、TSG-6のサブポピュレーションがSHAPと共有結合し複合体を形成することが明らかになったことである21,22。この発見はHAリッチマトリックスの形成の基礎になる、これまでになかった新たなメカニズムを示唆している。すなわちHA鎖の結合は、SHAP-TSG-6複合体を通しているということである。卵丘のSHAP-TSG-6複合体はビクニンを含んでおらず、コンドロイチナーゼABC消化に抵抗性であることは特徴的な点である。従ってこれは、以前に報告された長鎖の置き換えによってTSG-6がコンドロイチン硫酸鎖と結合する、関節液中のTSG-6-ITI複合体とは明らかに異なっている23。
排卵におけるITIファミリーの役割から分かった重要なヒントは、SHAP-ヒアルロン酸複合体形成が厳密に時間と空間を制御されていることである。すなわち排卵刺激は膨張する卵丘で大規模なHA合成を開始させる。一方血液—濾胞バリアがそれと同時に開放されることでSHAP-HA複合体形成に必要なITIファミリー分子の流入が可能となる24。このカスケードは炎症反応のそれと似ており、ほ乳類の排卵反応は炎症反応と共通の一般的な制御メカニズムであるという確信を強めた25。
ビクニン−ヌルマウスのSHAP-ヒアルロン酸複合体欠損は、1歳齢以上のマウスにおいても他の特記すべき異常を生じさせなかったことから、SHAP-HA複合体形成は正常な発達と恒常性維持においてよりも、むしろ主に正常とは異なる状態の対応に関与していることを暗示している。
一般にITIファミリー分子とHAはそれぞれ身体の異なる部位、すなわち循環系と結合組織に分布している。In vitroの実験で血清とHAを単純に混合し、37°Cでインキュベートすることで、SHAP-HAは十分形成されることが示された1,3。従って、血清とHAの合流が律速段階であるようで、上述仮説と一致する(Fig. 4)。このことはまた、SHAP-ヒアルロン酸複合体がリウマチ患者の関節液中に多量に存在し、正常関節液にはない事実によっても支持される26。炎症反応におけるSHAP-ヒアルロン酸複合体の役割は、CD44−HAの相互作用を修飾しそれにより白血球の活性化と侵入を仲介することかも知れないc。さらに、TSG-6の発現も炎症部位で亢進している。TSG-6は、TSG-6-ITI複合体を形成することでビクニンのプロテアーゼ阻害活性を大きく増進していることが示されている27。これまでになかった新規な共有結合のTSG-6-SHAP複合体が同定されたことで、HAリッチマトリックスの組織化およびHA機能の修飾に関連して、炎症過程におけるその役割を調べることが大変興味深いことになってきている。
c このシリーズのStrong and de la Motteの総説を参照
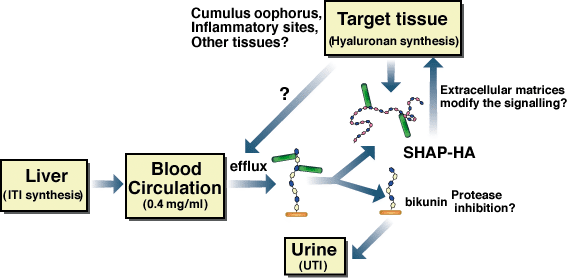
Fig. 4 SHAP-HA複合体の形成、制御と生理機能の模式図
循環血流中ITIファミリー分子は、適当な刺激があるとHA合成レベルが上がっている局所に供給される。ITIファミリー分子の長鎖は、新たに合成されたHA鎖に転移し、SHAP-ヒアルロン酸複合体を形成する。SHAP-ヒアルロン酸複合体はそれに引き続き、排卵時の卵丘マトリックスの構築や、炎症反応では炎症局所の細胞と遊走してくる単球との相互作用の様な、局所的に生じる生理学的現象あるいは病態現象で役割を果たす。
ITIが発見されてから40年、この複雑な、そして魅力的なファミリー分子は、それらがTSG-6と共有結合しているだけでなく、HAと長鎖(SHAPs)との間の共有結合も促進することが発見されたことで、その生理学的機能が明らかになりつつある。このことは結合組織中で最も重要な分子の一つであるHAの機能制御に新たな洞察をもたらす。まだ答を導かなければならないたくさんの大きな疑問点が残っている。たとえばビクニンと長鎖の結合、酵素因子の同定、ITIファミリーの流出がどのように制御されているか、SHAP-ヒアルロン酸複合体がどのようにHAリッチ細胞外マトリックス構成を組織化しているか、そしてSHAP-結合がCD44やTSG-6のような特異的受容体とHAとの相互作用にどのように影響を及ぼすかなどである。SHAP-ヒアルロン酸複合体形成は、幾つかのHAが関連した病態現象を制御するための新たなターゲットを提示しているのかもしれない。