
Prestwich博士は1996年以来、ユタ大学の医薬品化学の学部長である。同時に化学、生化学、生物工学の各学部にも属している。彼はUtah Center of Excellenceの一研究施設であるCell Signaling Centerの所長でありHuntsman Cancer Instituteの分子薬理学プログラムも指導している。彼の研究はイソプレノイドの生合成と情報伝達、抗寄生虫剤、イノシトールリン酸の情報伝達、抗ガン剤、組織工学とドラッグデリバリーのためのバイオマテリアルで構成されている。
Prestwich博士はCalifornia Institute of Technologyから1970年に化学科の名誉B.Sc.を受け、1974年にはStanford大学の化学科からPh.D.を受けた。コーネル大学でNIHのポスドクを、1974から1977年の間ケニヤのナイロビで昆虫の生理学と生態学のための国際センターでポスドクとして過ごした。1977年から1996年、ニュ−ヨークのStony Brook大学で化学科、および生化学と細胞生物学の教授を勤め、生物工学センターの部門長を勤めた。受けた賞にはAlfred P. Sloan Research Fellowship、Dreyfus Teacher-Scholar Award、アメリカ薬科大学連合からのPaul Dawson Biotechnology Award等がある。
Prestwich博士は390編余の技術論文を発行し、100余名の卒業生やポスドク研究者を教育指導してきた。彼はEchelon Research Laboratories Inc. (Salt Lake City, Utah)の研究部門の副社長であり、又Clear Solutions Biotech, Inc. (Stony Brook, New York)のコンサルタントを勤めているが、これらは彼の研究室から生まれる技術を商品化するために共同出資をしている組織である。
関節液と細胞外マトリックスに豊富に存在する非硫酸化グリコサミノグリカンであるヒアルロン酸(以下HAと略記)は、新しい生体適合性および生分解性のポリマーとして魅力のある構築ブロックであり、ドラッグデリバリー、生体組織工学、ビスコサプリメント等に適用される。
しかし新規なバイオマテリアルの製造は、HAの貧弱な生体力学的特性により妨げられている。機械的にも化学的にも強力な素材を得るため、天然のHAの化学的修飾が種々工夫されてきている。その結果得られたHAの誘導体は天然のポリマーとは有意に異なる物理化学的特性を示すが、ほとんどの誘導体は生体適合性と生分解性を保持し、ある場合には天然HAの薬理学的特性も保持している。この総説では、これまでHAにどのような化学的修飾が行われ、その結果どのような種類の新規バイオマテリアルが調製され、またそれが生体組織工学、創傷治癒、術後癒着、ドラッグデリバリーなどの用途に対しどのように予測され、開発されてきたかを総括する。
Fig.1はHAの誘導体またはHA合成物を調製する際使用されるいくつかの分子様態を示している。修飾の基本形は粘性を示すゾル体から架橋ハイドロゲルへの変換である(Fig.1A)。この修飾は穏和な中性の条件下に、あるいは塩基性の条件下に行われてきたがその例を説明する。別な方法として、レポーター基を付加することを可能にするための橋渡しグループを導入し、生化学的及び生理学的研究を行うための新しい試薬を得たり、または標的に向けられ制御された放出が可能である新規なプロドラッグを作るために、HAに薬物を導入するいくつかの方法が考案された(Fig.1B)。生体力学的及び生理学的性質を変えた新規な素材を創出するために、過去10年間に天然ポリマーや合成ポリマー上に結合させたHAを用いた混性素材が実現してきている(Fig.1C)。最後に"穏密(stealth)"リポゾームにコートされているポリエチレングリコール(PEG)の代替物として、HAはリポソーム表面に結合でき、これは更に利点としてターゲッティングと被覆効果を有している(Fig.1D)。
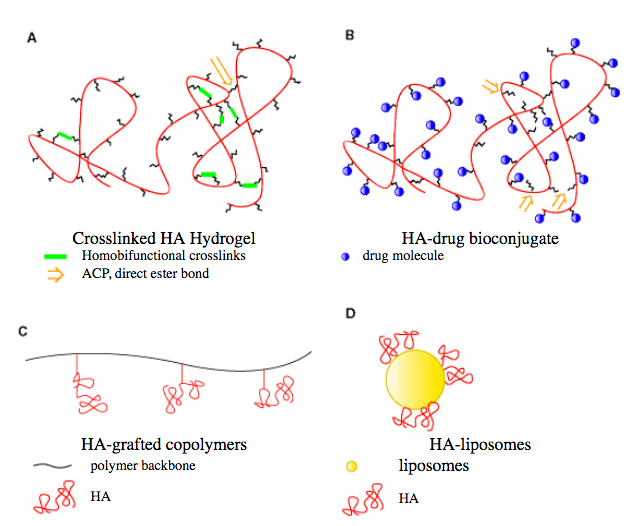
Fig. 1 ヒアルロン酸誘導体の模式図:
(A) 架橋ヒアルロン酸; (B)ヒアルロン酸—医薬品結合物;
(C)ヒアルロン酸を接木したコポリマー; (D)ヒアルロン酸—リポソーム複合体
Fig.2はHAの化学構造を示し、もっとも一般的に利用される2カ所の共有結合修飾部位を示している:それはカルボキシル基とハイドロキシル基である。以下にこれらの修飾の基礎的な化学反応をレビューし、医学生物学上有用なHAの誘導体の素材を作るための種々の反応の応用について精査する。Fig.3には以下に記述するいくつかの化学反応についてその詳細を総括している。化学修飾に関するオリジナル論文を選んで参考文献として後ろにリストアップした。またそれ以外の文献については、3つの最近の総説と1つのシンポジウムのまとめを参考にするとよい。1-4
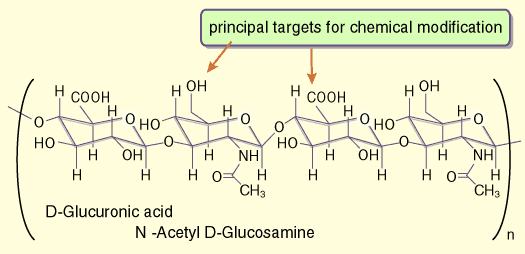
Fig. 2
二糖繰り返し構造と化学修飾の一次反応部位を示したヒアルロン酸の四糖画分
A.カルボキシルグループの反応
1. エステル化
HAのテトラ(n-ブチル)アンモニウム塩をDMF溶液中のアルキルハライドでアルキル化することにより一連のエステル化HAのバイオマテリアルが調製された(Fig.3A)。5 エステル化率をより高くすると、![]() (Fidia Advanced Biopolymers)となるが、これは水に不溶性となる。これらのHAエステルは押し出して膜や繊維を作ったり、凍結乾燥を行ってスポンジを作ったり、噴霧乾燥、抽出および蒸発工程を経て小粒(ミクロスフェア)を製造したりする。これらのポリマーは乾燥している時には程良い機械的強度を示すが、水和した素材はその強度が減少する。エステル化の度合いは疎水性パッチの大きさに影響を及ぼし、これにより固い安定したポリマーネットワークを作り、酵素学的分解を受けにくくする。
(Fidia Advanced Biopolymers)となるが、これは水に不溶性となる。これらのHAエステルは押し出して膜や繊維を作ったり、凍結乾燥を行ってスポンジを作ったり、噴霧乾燥、抽出および蒸発工程を経て小粒(ミクロスフェア)を製造したりする。これらのポリマーは乾燥している時には程良い機械的強度を示すが、水和した素材はその強度が減少する。エステル化の度合いは疎水性パッチの大きさに影響を及ぼし、これにより固い安定したポリマーネットワークを作り、酵素学的分解を受けにくくする。![]() を基盤としたデバイスからの薬剤の放出について、封入、または共有結合させた分子について調べられた。例として、異なる
を基盤としたデバイスからの薬剤の放出について、封入、または共有結合させた分子について調べられた。例として、異なる![]() 素材から製作されたミクロスフェアから、分散した状態とポリマーに結合した状態でステロイドのハイドロコーチゾン、α-メチルプレドニゾロンの放出について調べられた。ハイドロコーチゾンは10分以内にミクロスフェアの外側へ拡散したが、共有結合した薬剤の放出速度はエステルの加水分解により0次の放出(t1/2=100h)であることがわかった。HAのベンジルエステルからできているミクロスフェアや薄膜はそれが疎水性と粘着性を有することから鼻腔内、頬内、眼、膣への適用に適しており、薬剤やペプチドのデリバリーに最適な物理的形状であることが判明した。最後に、HAのベンジルエステルは培養ヒト線維芽細胞の成長や、軟骨および骨欠損を修復するための軟骨細胞や骨髄由来の間充織細胞の培養に、その素材をスポンジやメッシュにして利用されてきた。
素材から製作されたミクロスフェアから、分散した状態とポリマーに結合した状態でステロイドのハイドロコーチゾン、α-メチルプレドニゾロンの放出について調べられた。ハイドロコーチゾンは10分以内にミクロスフェアの外側へ拡散したが、共有結合した薬剤の放出速度はエステルの加水分解により0次の放出(t1/2=100h)であることがわかった。HAのベンジルエステルからできているミクロスフェアや薄膜はそれが疎水性と粘着性を有することから鼻腔内、頬内、眼、膣への適用に適しており、薬剤やペプチドのデリバリーに最適な物理的形状であることが判明した。最後に、HAのベンジルエステルは培養ヒト線維芽細胞の成長や、軟骨および骨欠損を修復するための軟骨細胞や骨髄由来の間充織細胞の培養に、その素材をスポンジやメッシュにして利用されてきた。
2. カルボジイミドを介した反応
カルボジイミド化合物によるHAのカルボキシル基の化学修飾は、一般にはpH4.75の水溶液中で行われている。このpHではカルボキシル基は陽性荷電(プロトン化)しているが、少量のアミン塩基は求核性の性状を保持していて、共有結合で付加反応を行う性質がある。しかしながら、一級アミンを用いたHAのカルボジイミドによるカップリング反応を試みたところアミド反応物はほとんど生成しなかった。そのかわり、主要な生成物は転移したN-アシルウレアの付加物のみであった。6
HAを修飾する化学における重要な発見は、対応する共役酸のpKa値が2〜4の間にあるヒドラジドは、pH4.75で求核性を保持し、カルボジイミドで活性化したHAのグルクロン酸残基と効率よくカップリングするという認識であった(Fig.3B)。7 アジピン酸ジヒドラジド(ADH)のようなジヒドラジド化合物を使用すると、薬剤、生化学的プローブおよび架橋用試薬で更なる誘導体を調製するための多価のペンダント型ヒドラジド基を用意することができる。こうして、ADHで修飾したHAのペンダントヒドラジド基には薬剤分子を結合でき、次にハイドロゲル中に架橋させることができる。その結果薬剤はハイドロゲルの内部に存在することになる。または、限定的にヒドラジド基を架橋に用い、得られたハイドロゲルの残りのヒドラジド基は治療薬を結合させることもできる。例えばHA-タキソールのバイオコンジュゲートは、HA-ADHとタキソールのエステル活性化物とを結合する事により合成された。HA-ADH-タキソール複合体を蛍光色素で標識することにより、ヒト乳がん細胞、卵巣がん細胞、結腸がん細胞への取り込みをモニターでき、またこの高分子化プロドラッグの選択抗がん性を調べることができた。8
他にカルボジイミドを介したHAとの反応ではヒドロキシルアミンを含有した化合物を用いHAの活性化エステルを得た。例えば、DMSO水溶液中で可溶性カルボジイミドと1-ハイドロキシルベンゾトリアゾール(HOBt)の存在下に、大過剰のアミンあるいはアミノ酸とHAと反応させるとアミド化合物を効率良く生成した。
B.水酸基との反応
1. 硫酸化
医療用デバイスをコートする血液適合性マテリアルを得るために、HA分子内のOHグループを硫酸化する試みが考案されてきた。DMF中で3酸化硫黄-ピリジン複合体によるHAの硫酸化反応は硫酸化の割合が異なるHyalSxを生成する;ここで2糖あたりx=1-4。硫酸化ヒアルロン酸Hyal
S3.5は、ジアミンポリエチレングリコール誘導体と水溶性カルボジイミドを用いて血漿で処理したポリエチレン上に結合させることができた。トロンビン時間試験、血小板接着能からみてこの方法は血液適合性があり、抗トロンビン性ポリエチレン表面を調製するには期待の持てる操作であることが示唆された。さらに、HyalSxが光反応性アジドフェニルアミノ誘導体に変換されポリエチレンテレフタール酸(PET)のフィルム上に光照射で結合できた。9硫酸化HAで被覆した表面は非被覆表面に比べ細胞の接着性や汚染、バクテリアの繁殖が著しく減少し、コンドロイチナーゼやヒアルロニダーゼによる分解に対しても安定であった。
2. エステル化
酪酸は細胞の分化を誘導し、種々のヒト癌細胞の成長を阻害することで知られているが、この酪酸の無水物をジエチルアミノピリジンを含んだDMF中で、低分子量のHAのSym-コリジン塩と反応させHAに結合させた。このようなHAの酪酸エステルは腫瘍を特異的に標的とする新規なドラッグデリバリーシステムとなった。
3. イソウレアカップリング
アントラサイクリン系の抗生物質アドリアマイシンとダウノマイシンが臭化シアノジェン(CNBr)による活性化によってHAに結合された(Fig.3C)。この反応様式はオリゴ糖を活性化し高い反応性のイソウレア中間体を経てアフィニテイ−マトリックスを調製するために一般的に用いられている。治療薬はオリゴ糖またはグリコサミノグリカンのハイドロキシル基の一つにウレタン結合を介して結合するものと思われるが、分光学的には立証されていない。さらには、この反応条件は激しいのでHAの分子性状や生体適合性を損傷するかもしれない。
4. 過沃素酸酸化
過沃素酸ナトリウムの酸化反応を用いHA鎖上の隣接する二級アルコール基から2つの反応性アルデヒド官能基を生成させることができる(Fig.3D)。この化学反応は糖タンパクを親和性物質として結合させたり蛍光プローブに変換するための標準的な化学的活性化法である。過沃素酸による活性化HAを用いると一級アミンとのカップリングで架橋したり、細胞接着部位を有するペプチドとの結合や固定化を行うことができる。激しい酸化処理により鎖の解裂や、潜在的に免疫原性を持った結合をHAのバイオマテリアルに導入する可能性も生ずる。
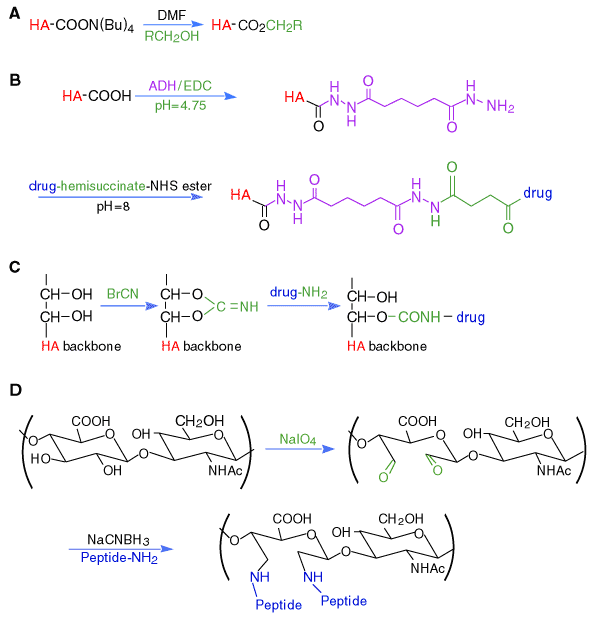
Fig. 3 ヒアルロン酸のカルボキシル基と水酸基の化学修飾:
(A) エステル化; (B)ビスヒドラジドによる修飾;
(C)臭化シアノジェンによる活性化;と(D)過ヨウ素酸酸化
C.環元末端の修飾
HAの還元端の還元アミノ化が、アフィニティーマトリックスや蛍光標識物の調製およびリポゾーム中に挿入するHA-リン脂質を調製するときに用いられてきた。例えば、低分子量HAが共有結合でフォスファチジル-エタノールアミンに結合され、この結合物は低密度リポタンパク(LDL)粒子の表面上の保護作用のある"糖鎖の装飾物"として使用されてきた。
末端標識はグリコサミノグリカン当たりただ一カ所結合点があるのみなので、他にはHAバイオマテリアルまたはプロドラッグへの広範な適用が行われてきたわけではない。このことは高分子量のHAにとって修飾や架橋の可能性をより一層厳しいものにしている。
D.アミド修飾
天然のHAは、標品によっては定量出来ない程度の自然に生じた脱アシル化のグルコサミンをもっており、これを修飾することができる。これは還元端の修飾のときと同様非常に効率が悪い。しかしながらN-アセチル基の修飾は、よく用いられるヒドラジン分解法を用いる場合が重要と思われる。HAの限定ヒドラジン分解はHA鎖にフリーのグルコサミンを作り出すが、これは同時に塩基性により誘導される基本骨格の分解につながり、還元端も修飾されることになる。
E.架橋戦略
以下に記述するプロセスはしばしば前述の基本反応を用いて行われる。にもかかわらずこの項では、上述のより選別され制御された修飾とは対照的に、大量のHAを機械的に強固な素材に転換させる操作に焦点を絞り別項として論じる。表面結合法もこのセクションで述べる。Fig.4にはいくつかの架橋戦略の化学反応を示し、またFig.5ではHAで共有結合で表面を修飾する一つの方法を示した。
1.ビスエポキシドおよびジビニルスルフォン架橋
アガロースを架橋するために最初に開発された戦略を用い、Laurentはビスエポキシブタンと水素化ホウ素ナトリウムを用いて希薄な苛性ソーダ中でHAの架橋ゲルを調製した。10 エタノール性0.1N苛性ソーダ中、60℃でのエチレングリコールジグリシジルエーテルとHAとの反応はハイドロゲルを生成する(Fig.4A)。このようにして得られたゲルは大量の水を保有し(95%)、移植可能なドラッグデリバリーとして炎症(刺激性)に反応して分解可能なマトリックスとして利用することについて研究された。HAとアルカリ性1,4-ブタンジオールジグリシジルエーテルから調製したハイドロゲルは非常に多孔性で、この素材を過沃素酸で活性化し、次にHAの細胞接着性を増強するために細胞接着ドメインArg-Gly-Asp(RGD)を持つ18アミノ酸から成るペプチドで修飾された。アルカリ溶媒中ではジビニルスルフォンも、おそらく水酸基との反応を介してHAを架橋する(Fig.4B)。
2. 分子内エステル化
自己架橋したポリマー(ACPTM、Fidia)はHAの水酸基およびカルボキシル基の間の分子内、分子間両者で結合したエステル化誘導体である。ACPTMは白色粉末になるまで凍結乾燥し、水和させて透明ゲルにすることが可能である。この新規バイオマテリアルは腹部、婦人科領域の手術の結果生じる術後癒着を抑えるバリヤーとして、また損傷組織を修復する細胞の増殖支持体として応用されてきている。軟骨細胞や骨芽細胞を植え付けた多孔性のスポンジACPTMの皮下移植では骨や軟骨の再生が見られた。
3. 光架橋
HAのメタクリレート誘導体は、HAの酪酸エステルについて前述したように、過剰のメタクリル酸無水物と水酸基をエステル化することで合成された。この誘導体はイニシエーターとして1-ビニル-2-ピロリドンとトリエタノールアミン中でエチルエオジンを用い、514nmのアルゴンイオンレーザー光を照射して光架橋が施され、安定なハイドロゲルが形成された。in situで、HA誘導体に光重合を応用すると損傷組織を被覆する凝集性のゲルが形成されるが、これは周辺組織との隔離を形成し癒着形成の防止になる。インスリンの人工的な供給源として開発するため、ランゲルハンス島を利用した初期的な細胞のカプセル化研究も成功した。
4. グルタルアルデヒド架橋
この操作の化学的特性は明確にはなっていないが、陽イオン交換したヒアルロン酸ナトリウム(1.6 MDa)から成型したHA線維がグルタルアルデヒド水溶液中で架橋された。この線維の表面をポリ-D-リジン、ポリ-L-リジンを結合させて再構成した。このポリペプチドで再表面化したHA線維は良好な生体適合性を示し、細胞の接着を促進した。
5. 金属陽イオンを介した架橋
![]() (FeHA、LifeCore)は水酸化第二鉄とキレート結合により作り出されたHAのハイドロゲル剤である。同様なHAの架橋には銅、亜鉛、カルシウム、バリウムおよび他のキレート結合する金属を基にしたものがある。赤色のFeHAは術後の癒着防止剤として開発中である。
(FeHA、LifeCore)は水酸化第二鉄とキレート結合により作り出されたHAのハイドロゲル剤である。同様なHAの架橋には銅、亜鉛、カルシウム、バリウムおよび他のキレート結合する金属を基にしたものがある。赤色のFeHAは術後の癒着防止剤として開発中である。
6. カルボジイミド架橋
![]() はイソプロパノール水溶液中でビスカルボジイミドを介して架橋することにより調製された生体吸収性のスポンジ(Anika Therapeutics)である(Fig. 4C)。11 この反応過程はN-アシルウレアを形成してHAと反応するというカルボジイミドでは好ましくない傾向を利点としている。この応用においては、二つのN-アシルウレア結合形成により化学的に安定で、副産物を発生させない架橋をすることができる。疎水性のビスカルボジイミドを用いたことにより、
はイソプロパノール水溶液中でビスカルボジイミドを介して架橋することにより調製された生体吸収性のスポンジ(Anika Therapeutics)である(Fig. 4C)。11 この反応過程はN-アシルウレアを形成してHAと反応するというカルボジイミドでは好ましくない傾向を利点としている。この応用においては、二つのN-アシルウレア結合形成により化学的に安定で、副産物を発生させない架橋をすることができる。疎水性のビスカルボジイミドを用いたことにより、![]() は縫合を必要とせずに組織を接合し、血液が存在してもその効果を保持することができる。最近、ウサギの盲腸焼灼の研究から術後癒着を防止する効果が分かった。
は縫合を必要とせずに組織を接合し、血液が存在してもその効果を保持することができる。最近、ウサギの盲腸焼灼の研究から術後癒着を防止する効果が分かった。
水に混和しやすく溶媒を含まないHA(1.6 MDa)フィルムを、水溶液中で水溶性カルボジイミドを用いて架橋する事により低水分含量のHAハイドロゲルが調製された。低水分含量を与える架橋度の高いハイドロゲルは80%エタノール中で調製された。このフィルムは60%の水分含量で緩衝液中に浸せきしても2週間は安定であった。L-リジンメチルエステル存在下に水溶性カルボジイミドでHAフィルムを架橋するとin vivoでのこのフィルムの分解はさらに延びた。
7. ヒドラジド架橋
前述のヒドラジド化学を利用し、架橋剤としてビスヒドラジド、トリスヒドラジド、多価ヒドラジド化合物によりハイドロゲルが調製されてきた。反応条件、反応薬剤のモル比等を調整し柔らかい流出の容易なゲルから、機械的に固いがもろいゲルに物理化学的性質を変化させた一連のゲルが得られている。市販されている小さな分子の、同一の二つの反応基を持った架橋剤を用いてHA-ADHが架橋できる(Fig. 4D)。最近、高分子架橋剤であるPEG-ジアルデヒドを用いてHA-ADHを生理的条件下にin situでポリマー化する技術が開発されてきた(Fig. 4E)。12 はっきりと測定可能な機械的強度を保持した生体適合性で生分解性のHAハイドロゲルフィルムが溶剤を蒸発させることにより得られた。高分子の薬剤はこのHAハイドロゲルフィルムからゆっくりと放出され、この新しい素材は創傷の治癒過程において上皮組織の再形成を促進した。
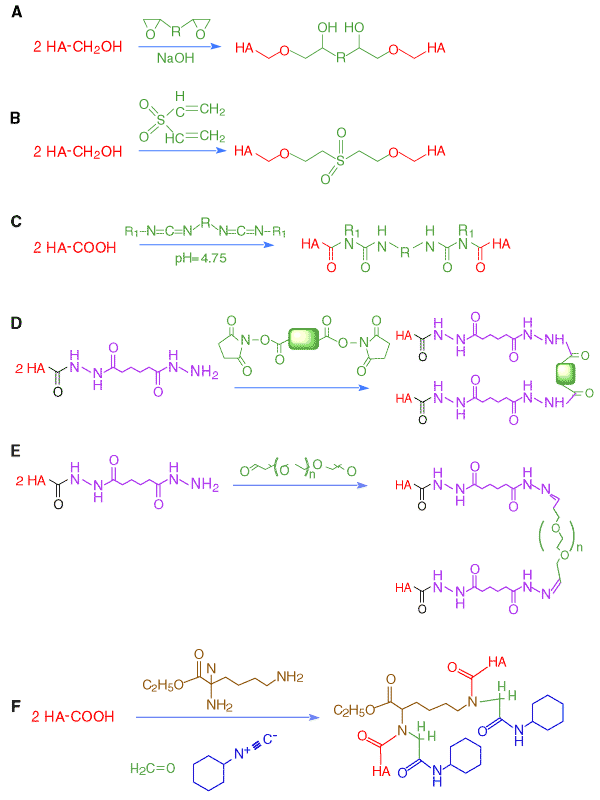
Fig. 4 ヒアルロン酸の化学的架橋戦略
(A) ビスエポキシド架橋; (B)ジビニルスルホン架橋; (C)ビスカルボジイミドによる架橋; (D)HA-ADHを用いた低分子でホモの二官能基をもつ架橋剤を使用するもの; (E)巨大分子の架橋剤による網目構造の形成; (F)ヒアルロン酸とホルムアルデヒド、シクロヘキシルイソシアナイドおよびリジンエチルエステルを用いた、Ugiの4成分縮合による架橋ハイドロゲルの調製
8. 残留タンパク質との架橋
Hylans(Biomatrix)は塩基性溶液中でホルムアルデヒドを用いて、HAが含有する残留タンパク質を架橋して作られたハイドロゲルまたはゾルである。13 可溶性のハイランは、HAに比較して流体特性を増強したHAの高分子体(8-23 MDa)である。ハイランゲルは可溶性ハイランに比しより強い弾性と粘性を示すがそれでも天然のHAが示す高い生体適合性は保持している。ハイランは数多くの医学的用途について研究されてきている。ハイランは退行性関節症やリウマチ様関節炎の治療で、その効果は可逆的で粘性に依存しているが、軟骨を保護し、さらに進行する軟骨細胞の損傷を抑制する。ハイランの製剤である![]() は変形性関節炎のビスコサプリメンテーシヨン療法に医療用具として特別に開発されてきた。この治療法は関節液や、滑膜組織、滑膜包の細胞間マトリックスの粘弾性を増強させる。
は変形性関節炎のビスコサプリメンテーシヨン療法に医療用具として特別に開発されてきた。この治療法は関節液や、滑膜組織、滑膜包の細胞間マトリックスの粘弾性を増強させる。
Hylan BTMゲルスラリー注射剤(![]() ゲル)の臨床試験では、ウサギをモデルとした声帯ヒダのビスコサプリメンテーシヨンで見られたように軟組織増強には安全で有効な素材であることが分かった。このゲルは炎症や有害反応を惹起することなく、一ヶ月後には新生した結合組織の侵入を伴って、12ヶ月間もの間投与部位に留まっていた。Hylanは、1995年以来ヨーロッパにおいて軟組織増強のために利用されている部分架橋HA誘導体
ゲル)の臨床試験では、ウサギをモデルとした声帯ヒダのビスコサプリメンテーシヨンで見られたように軟組織増強には安全で有効な素材であることが分かった。このゲルは炎症や有害反応を惹起することなく、一ヶ月後には新生した結合組織の侵入を伴って、12ヶ月間もの間投与部位に留まっていた。Hylanは、1995年以来ヨーロッパにおいて軟組織増強のために利用されている部分架橋HA誘導体![]() (Q-Med Inc)と同様に、皮内移植や美容整形の形成術に注射することで使用されている。
(Q-Med Inc)と同様に、皮内移植や美容整形の形成術に注射することで使用されている。![]() はハイランの加工されたゲルで術後癒着防止の補助剤として検討されている。最後にハイランは、治療薬剤を取り入れることで薬物担体として用いられることができる。例えば、ハイランマトリックスに共有結合で結合させるとサイトカインであるインターフェロンの生物活性はin vitroで約40%増強した。
はハイランの加工されたゲルで術後癒着防止の補助剤として検討されている。最後にハイランは、治療薬剤を取り入れることで薬物担体として用いられることができる。例えば、ハイランマトリックスに共有結合で結合させるとサイトカインであるインターフェロンの生物活性はin vitroで約40%増強した。
9. 多成分の反応
HA誘導体はPasserini反応やUgi反応で知られている、3成分あるいは4成分の反応によっても調製できる。14 Passerini反応では、HAの水溶液を水溶性グルタルアルデヒド(または、別の水溶性ジアルデヒド)と混和し、高い反応性のイソシアン化物、たとえばシクロヘキシルイソシアン化物を既知量加えた。Ugiの4成分反応では、ジアミンをこの3成分反応混合物に加えた。架橋の程度はアルデヒドとジアミンの量をコントロールして行う。Fig. 4Fは、シクロヘキシルイソシアナイド、ホルムアルデヒドおよび(ジアミンとして)リジンエチルエステルを用いて、(酸の成分として)HAにUgi縮合反応を行い、ハイドロゲルを得たことを示している。このようなハイドロゲルは、透明で機械的に安定であり、塩の水溶液中で膨潤し、架橋度に依存した圧縮率を示した。
10. 表面修飾
ポリプロピレン(PP)とポリスチレン(PS)表面をアミノ化するため、アルゴンガスと アンモニアガスプラズマで活性化した。アミノ化した表面は、次に表面上にペンダントのカルボキシル基を導入するため無水コハク酸で修飾した。このものは次にカルボジイミドの存在化にHA-ADHと縮合させることにより、親水性、非接着性でかつ滑らかなプラスチック表面を与えた(Fig. 5)。15 前記のように表面は、プラズマエッチング法により硫酸化HAで修飾することもできる。あるいはまたフィブロネクチン(RGD)ペプチドを結合したHA-ADHで表面修飾することにより、細胞接着性の表面を作ることができた。金属およびガラス表面もまた、適切なHA誘導体を共有結合でつけることにより、表面活性化による修飾をすることができる。
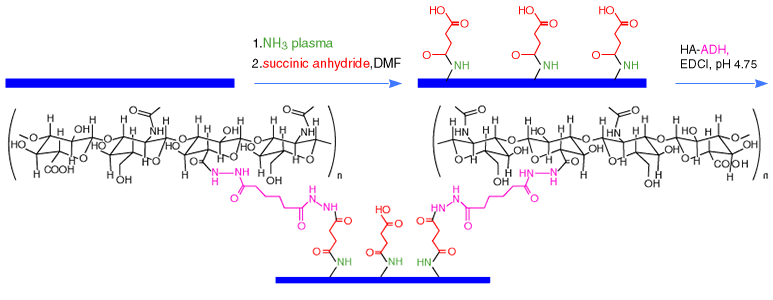
Fig. 5
アンモニアプラズマによるポリプロピレンの活性化を用いたプラズマエッチング法と、無水コハク酸による修飾およびその後のヒアルロン酸誘導体HA-ADHによる共有結合を用いた修飾
A.HA-リポゾーム
非修飾のHAはリポゾームに取り込まれた。たとえばHAをシクロスポリンAと結合させリン脂質のリポゾームに封入した。HA(Mw10 kDaと1000 kDa)粉末をこのリポゾームとともに水和しHAの終濃度を2.5wt%にした。この溶液は局所投与用薬剤として開発され、全身循環を最小にし、皮膚疾患の治療に効果を発揮した。
HAがリポゾーム表面に生体接着性のリガンドとして固定化されている生体接着性リポゾームは、HAをカルボジイミドで事前に活性化して調製された。16 この活性化リポゾームをフォスファチジルコリン、フォスファチジルエタノールアミン、コレステロールから作成された多層リポゾーム懸濁液に加えた。HA-フォスフォリピド付加物の共有結合性は形成されなかった。原理的には、HAをコートしたリポゾ−ムは機能的にはPEGでコートした"穏密"リポゾームに類似していた。これらのことから創傷や火傷部位の局所治療に上皮成長因子の局部付着性と持続的放出性の可能性をもったキャリヤーとして効果が検討されている。
B.HA-タンパク質
ゼラチンとHAから作られた多孔性のマトリックスが、架橋剤に少量のカルボジイミド(EDCI)を用い、90%(w/v)アセトン/水混液にゼラチン-HAの水溶性スポンジを浸して調製された。このスポンジ型バイオマテリアルは創傷の被覆やティシューエンジニアリングの足場として作成された。抗菌性銀スルファジアジンをしみ込ませたこのHA-ゼラチンスポンジはラットの上皮損傷モデルの治癒を促進した。
HAとコラーゲンの複合物は、この2つの成分を酢酸水溶液で凝固させ、グリオキサールあるいは過沃素酸酸化デンプンジアルデヒドを介して架橋して調製した。得られた素材はコラゲナーゼに抵抗性を示し線維芽細胞の増殖を可能にした。HAとコラーゲンからなる他の組成物としては乾燥したHA/コラーゲン凝固物をポリエチレンオキサイドとヘキサメチレンジイソシアナートで架橋して調製された。
また、ハイドロキシルアパタイト-コラーゲン-HAの複合素材が、HA溶液にハイドロキシルアパタイト粒子を添加し水に懸濁したコラーゲン線維と混和して調製された。ハイドロキシルアパタイト90%、コラーゲン9.2%、HA 0.8%(w/v)の組成からなる最終製品は生体適合性で機械的強度があり、骨欠損の充填物として使用された。17 また多孔性コラーゲン-HAマトリックスはコラーゲンと過沃素酸酸化HAを架橋して調製され、骨形成を促し成長因子の搬送や、移植用細胞を支持するマトリックスとして有用性が期待できる。
人工皮膚の素材(コラーゲン-ゼラチンスポンジ)にHAを取り込ませると肉芽組織の侵入を促進し、皮膚移植を支えるより適した移植ベッドを作る。コラーゲンマトリックスに共有結合したHAに関する多くの研究から、線維芽細胞培養におけるコラーゲン収縮を有意に抑制し、皮膚代替物やティシューエンジニアリング用バイオマテリアルにおいて、HAが重要な役割を担っていることを示唆している。
C.HA-ポリカルボキシル酸ポリマー
多くの天然ポリマーおよび合成ポリマーには多重で規則的に並んだカルボキシル酸を持つものがある。これらには、全グリコサミノグリカン、ペクチン、アルギン酸、カルボキシメチルセルロース(CMC)、ポリアクリル酸があげられる。これらのポリマーとHAをブレンドし、以下に記載する架橋化学を施すと複雑で新次元の、化学修飾によりHAを組み込んだハイドロゲルが得られる。
アルギン酸のゲル形成の特性(金属キレート形成による)はHAとブレンドしたときのハイドロゲルの形成を促進した。このようにして、アルギン酸HAゲルはアルギン酸-HA混合物にカルシウムイオンを拡散させて調製された。アルギン酸:HAの比が1:1のゲルは充分な機械的特性を示した。この組成物は生体適合性ポリマーのキャリヤーとして、また滑液中で安定なため関節外科手術に適用される。
生体吸収性膜![]() が術後癒着防止用の生体吸収性物理的バリヤーとして開発された最初のHA製品である。Genzyme社の研究者はこの素材を二種の陰イオン性ポリマーHAとCMCを混合し、カルボジイミドを介して修飾調製した。18 陰イオン-陽イオンによる物理的に会合したネットワーク構造は比較的もろいバイオマテリアルを作り出す。
が術後癒着防止用の生体吸収性物理的バリヤーとして開発された最初のHA製品である。Genzyme社の研究者はこの素材を二種の陰イオン性ポリマーHAとCMCを混合し、カルボジイミドを介して修飾調製した。18 陰イオン-陽イオンによる物理的に会合したネットワーク構造は比較的もろいバイオマテリアルを作り出す。![]() は1996年にFDAにより承認され、現在では多くの外科手術への適用が許可されている。
は1996年にFDAにより承認され、現在では多くの外科手術への適用が許可されている。![]() の使用は全体を被覆する操作が可能な部位に限定される。多くの場合癒着部位が予測出来ないか到達が困難である場合が多いのでその代替物が求められている。また
の使用は全体を被覆する操作が可能な部位に限定される。多くの場合癒着部位が予測出来ないか到達が困難である場合が多いのでその代替物が求められている。また![]() は手技が難しく多くの外科医には受け入れられていない。より柔軟な
は手技が難しく多くの外科医には受け入れられていない。より柔軟な![]() IIが間もなく利用可能となろう。
IIが間もなく利用可能となろう。
最後にHAとコンドロイチン硫酸(CS)のブレンドしたものが創傷治癒および薬剤放出に適用するために研究をされてきた。各ポリマーは前述のヒドラジンの化学を用いまずADH誘導体に転換した。次にHA-ADHとCS-ADHの混合物をPEGジアルデヒドで架橋した。この物質は創傷治癒に必要な時間を短縮するための素材の開発に有力な候補である。
D.HA含有共重合体
機械的強度を最適にし、薬剤のデリバリーや生体での安定性に最適な条件を得るために種々のHA含有共重合体が調製されてきた。たとえば、ポリL-リジン(PLL)を主鎖としてDNAとの結合部を持ち、細胞特異的リガンドを持つHA鎖を側鎖とした櫛状の高分子両性電解質共重合体が、肝臓の洞様内皮細胞を標的に調製された。HAの還元端とPLLのε-アミノグループを、シアノボロハイドライドナトリウムを用いる還元アミノ化反応により共有結合し櫛状共重合体(PLL-graft HA)を得た。19 このポリカチオン性のPLL骨格はHA鎖が存在してもポリアニオン性のDNAに選択的に結合した。さらにPLL-graft-HA-DNA複合体は疎水性PLL-DNAがフリーの水和したHAにその外側を取り囲まれた多層構造を形成しているのかもしれない。フリーHA鎖との複合体の形成は、複合体を標的細胞に向わせるのに必須と思われた。
PEG-grafted-HAの共重合体は水溶性カルボジイミドを用いメトキシ-PEG-ヒドラジドにHAを結合させ調製された。このグラフト共重合体は水溶性ペプチドの搬送用に開発された。例えばインスリンはPEG"相"と分配していて分子間の相互作用によりインスリンのコンフォーメーション変化を防いでいる。このことは薬物の漏出を抑制し、分解をコントロールしてインスリンを放出する。
E.HA-キトサン
HAにも存在するN-アセチルグルコサミンのホモポリマーであるキチンの脱アセチル化により、ポリアミンの多糖キトサンが得られる。HAとキトサンのグルタミン酸塩の混合物はモデル薬剤にゲンタマイシンを用い粘着性のあるミクロスフェアとして調製された。HAとキトサンのグルタミン酸塩の組み合わせは、HAの潜在的な粘着特性とキトサンの浸透作用の増強を合わせもった性質をもたらした。
完全に脱アセチル化したキトサンとコンドロイチン硫酸およびヒアルロン酸を混合すると高分子電解質の複合体を形成する。この複合体は酸性の溶媒中でも作られ、広い範囲のpH領域で安定である。細胞への接着性や酵素に対する分解性が調べられた。キトサンはHAおよびコンドロイチン硫酸の酵素的加水分解を防いだが、純粋のキトサンが細胞接着、細胞増殖、創傷治癒にもっとも優れた効果を示した。
G.HAブレンド
多くの合成ポリマーはバイオマテリアルへの応用に優れた機械的特性を有しているが、生体適合性では不十分で問題とされている。反面、HAのような生体適合性ポリマーは時として機械的特性はいまひとつの性質を持っている。合成高分子に生物学的高分子をブレンドすると個々の高分子の望ましい特性を併せ持つ混合素材を生み出す可能性がある。特に、HAは良好な物理化学的特性と機械的強度、生体適合性を保持した体内浸透性分子ネットワークを作り出すために他の物質とブレンドされてきた。多くの場合、化学的架橋は必要としない。例えばポリビニルアルコール(PVA)とポリアクリル酸(PAA)がコラーゲンあるいはHAとブレンドされた。HA/PAAスポンジは混合した水溶性ポリマーを凍結乾燥して調製し、130℃の真空状態で"架橋"した。このプロセスの化学反応は不明でまだ解明されていない。HA/PVAのハイドロゲルは異なる混合比で水に溶解し8回凍結融解を繰り返し調製された。
HAは有用でユニークな物理化学的特性と生物学的機能を合わせ備えているので、新規な生体適合性および生体分解性の高分子を調製する際の重要な出発材料となっている。本総説はHAの修飾における化学反応と、HAをもとにしたバイオマテリアルと、HAで修飾した表面の潜在的な医療応用に焦点をあてた。重要な新しい製品は既に市場に出回っており、HAから誘導されたバイオマテリアルを用いた医療用具と、新しい医薬品の承認と導入が今後10年の間に増加すると予想される。
謝辞;
私は1990年から2000年の間に、このプロジェクトを手伝ってくれたJing-wen Kuo, Tara Pouyani, Dale M. Marecak, James F. Marecek, Koen P. Vercruysse, Yi Luo, Michael R. Zeibell, Kelly R. Kirkerに謝辞を述べる。また多くの共同研究者、特にDavid A. Swann, Gerald A. Harbison, Eva A. Turley, Anthony Day, Steven D. Grayにも深謝する。私の研究室に対する研究費の支援はMedChem, Inc., The Center for Biotechnology at The University at Stony Brook, Clear Solutions Biotech, Inc., The University of Utah, the Center for Biopolymers at Interfaces (UUtah), the Department of Defense, the National Institutes of Health により行われた。