
Tony Dayは構造生物学者で、この7年間ヒアルロン酸-タンパク質相互作用の研究を行ってきた。彼はOxford大学で1985年に化学専攻で学士を、続いて1988年に生化学で博士を授与された。彼の博士研究はヒトの補体系を調節するfactorHの構造の研究を主に行なった。1991年から1998年まで彼はArthritis Research Campaign Research FellowとしてIain D. Campbell教授(Oxford大学、生化学)の研究室で研究し、この間にヒアルロン酸結合タンパク質に興味を持つようになった。この研究は多くのヒアルアドヘリン(hyaladherin)にみられるドメインであるリンクモジュールの三次元構造の初めての決定につながった。Day博士は現在Medical Research Council's Immunochemistry Unit (Oxford)のSenior Scientistであり、タンパク質-ヒアルロン酸相互作用の分子的基礎の理解と、細胞外マトリックスの再構成や白血球の接着におけるTSG-6(炎症に関連したヒアルアドヘリン)の役割解明を目的とした研究に従事している。
ヒアルロン酸は脊椎動物において広範な生物学的役割を担っている。たとえば、結合組織の不可欠な構造成分として働きa、細胞の分裂や移動(たとえば発生過程において)が可能なゆるく水和したマトリックスをつくりb、免疫細胞の接着を仲介しc、そして細胞内シグナル伝達を活性化するd,e。このような広範な機能活性はヒアルロン酸の単純な構造からすると驚くべきことかもしれない。しかし、それは多くのヒアルロン酸結合タンパク質(しばしばヒアルアドヘリンとよばれる)がそれらの組織発現、細胞レベルでの局在、特異性、アフィニティや制御における有意な違いを示すという事実に起因する。タンパク質によるヒアルロン酸認識の分子的基礎と、これが生体内でどのように調節されるかの解明はこの重要な多糖の生物学的役割を理解する上で鍵となる要素であろう。
a このシリーズのHardinghamの総説を参照
b このシリーズのTooleの総説を参照
c このシリーズのStrong and de la Motteの総説を参照
d このシリーズのKnudson and Knudsonの総説を参照
e このシリーズのTurley and Harrisonの総説を参照
多くのヒアルロン酸結合タンパク質はリンクモジュールという共通のドメインを持ち、それがリガンドとの結合に関与する(Fig.1)。リンクモジュール(または、プロテオグリカンタンデムリピートと呼ばれる)1は、1つの免疫グロブリンドメインと2つの隣接したリンクモジュールからなる軟骨リンクタンパク質で初めて記述された。この分子配置はコンドロイチン硫酸プロテオグリカンであるアグリカン、バーシカン、ニューロカン、ブレビカンのG1ドメインでも見つかっている。Fig.2に示すように、アグリカンはヒアルロン酸とリンクタンパク質によって安定化された巨大な複合体を形成し、関節軟骨に耐圧機能を付与しているa。アグリカンの代わりにバーシカン、ニューロカン、ブレビカンが配置された同様の会合体は、皮膚、血管壁、脳など多くの他の組織の構造的強度に関与していると考えられる。免疫グロブリンドメインは多分リンクタンパク質-プロテオグリカン相互作用に関与し、一方リンクモジュールはヒアルロン酸との結合を仲介する。
a このシリーズのHardinghamの総説を参照
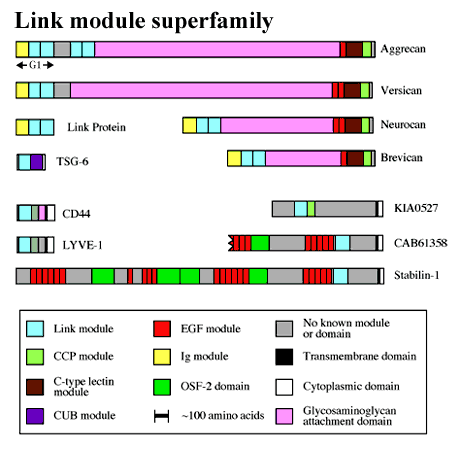
Fig. 1 リンクモジュールスーパーファミリー
遍在するヒアルロン酸レセプターであるCD44は接着、細胞表面における細胞外マトリックスの構築、代謝(たとえば、軟骨において;Fig.2)や炎症におけるリンパ球の移動の仲介などを含む広範な機能を有するd。CD44には10のバリアントエキソンが異なった組み合わせで選択的にスプライシングされることにより多くのアイソフォームが存在し、それら全てでひとつのリンクモジュールがタンパク質のN-末端近くにある。CD44とは別に、リンクモジュールスーパーファミリーでヒアルロン酸レセプターとして明らかに同定された唯一他のメンバー(Fig.1)にLYVE-1があり、この分子は最近、その発現がリンパ管内皮に限られたタンパク質として見出され、ヒアルロン酸代謝に関与しているかもしれない2。
d このシリーズのKnudson and Knudsonの総説を参照
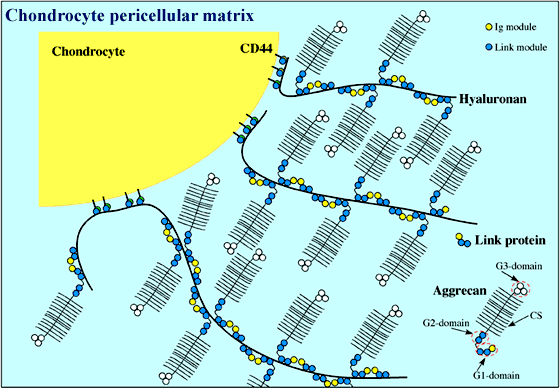
Fig. 2
軟骨細胞外マトリックスは、リンクタンパク質とアグリカン分子が、中心のヒアルロン酸の線維に沿って交互に整列した巨大な多分子複合体よりなる。このような複合体のうちいくらかは、ヒアルロン酸レセプターのCD44を介して軟骨細胞表面にアンカーされ、軟骨に耐圧特性を与えている。アグリカンは3つの球状ドメイン(G1,G2,G3)と約100本のコンドロイチン硫酸鎖が結合した部位からなるプロテオグリカンである。
Tumor necrosis factor-stimulated gene-6 (TSG-6)のタンパク質産物は、リンクモジュールをひとつ持ち、炎症刺激(たとえば、関節炎患者の関節部位において)に応答して分泌される3。TSG-6は白血球の移動の調節に関わるといわれ、その発現パターンから細胞外マトリックスの再構成に関与するらしいことが示唆されている。たとえば、軟骨におけるTSG-6はヒアルロン酸-タンパク質会合体の形成を阻害し、会合体の解離を促す、あるいはCD44の機能を調節するのかもしれない(Fig.3)4,5。ある組織においては(たとえば、卵丘細胞-卵細胞複合体の拡大において)、TSG-6はインターαトリプシンインヒビター(IαI)と会合でき、このようなTSG-6/IαI複合体はヒアルロン酸鎖を架橋することにより細胞外マトリックスを安定化するのかもしれないf。TSG-6タンパク質の役割はまだほとんど解明されていないが、そのヒアルロン酸結合能とそれらの構造的基盤については多分いくつかのヒアルアドヘリンの中でもっとも研究が進んだものであろう(後述)。
f このシリーズのSalustriとFülöpの総説を参照: O Carrette, R V Nemade, A J Day, A Brickner and W J Larsenらにより論文投稿中
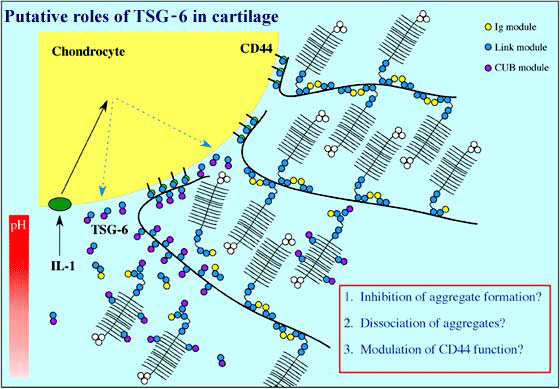
Fig. 3 TSG-6の軟骨における推定上の役割。
TSG-6は炎症時(たとえばリュウマチ様関節炎)、軟骨細胞によって分泌され、ヒアルロン酸、コンドロイチン4硫酸、アグリカンのG1ドメインなど軟骨成分と相互作用しうるので4,5、細胞外マトリックスの再構築に関与するかもしれない。たとえば、TSG-6は新たに合成されるアグリカンのG1ドメインとコンドロイチン4硫酸鎖に結合することによって、軟骨複合体の形成を阻害するかもしれない。また、ヒアルロン酸の構造やCD44機能の調節を変化させることによって、存在している会合体の解離に関与するかもしれない。TSG-6のヒアルロン酸、アグリカン結合活性はpH依存的である;このことから関節軟骨に存在するpH勾配による機能調節があるかもしれない。この点について、炎症時には軟骨細胞の表面部位においてpHの明らかな低下があると考えられる4。
Fig.1に示すように、いくつかのリンクモジュールスーパーファミリーの新しいメンバー(すなわち、stabilin-1, CAB61358とKIA0527)はすべて細胞表面タンパク質のようである。Stabilin-1 (accession code AJ275213)とCAB61358 (不完全な配列に対するaccession codeである)は非常に似たドメイン構成を持ち、これらのタンパク質のリンクモジュールは、両者ともTSG-6のそれと約50%の相同性を示す。しかしながら、それらのヒアルロン酸結合特異性に関するデータはまだ得られていないので、それらがヒアルアドヘリンかどうかは不明である。脳からクローニングされたKIA0527 (accession code AB011099)についても同様のことがいえる。Fig.4を見て分かるようにリンクモジュールを持たないヒアルロン酸結合タンパク質の数が増えつつある。これらのほとんどはそのアミノ酸一次配列のレベルでは相関は認められない。これらのタンパク質のヒアルロン酸結合部位に関するデータは、RHAMMレセプターeを除いてほとんどないのでこの総説では触れない。
e このシリーズのTurleyとHarrisonの総説を参照。
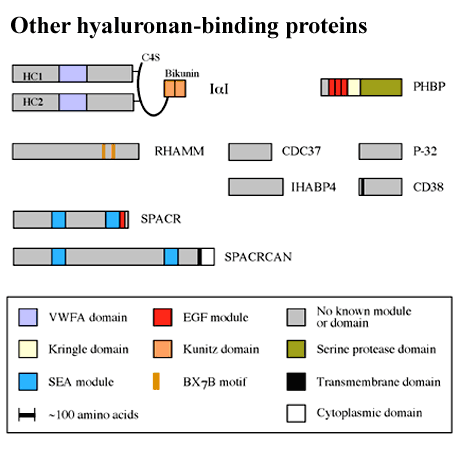
Fig. 4 他のヒアルロン酸結合タンパク質。
BX7Bモチーフはヒアルロン酸結合に関与する証拠があるRHAMMにのみ示されている。
リンクモジュールは4つのシステイン残基がCys1-Cys4とCys2-Cys3のパターンでジスルフィド結合した約100アミノ酸のドメインである(Fig.5)。ヒトTSG-6のリンクモジュールの三次元構造は溶液中の核磁気共鳴スペクトル解析によって決定された1。それは2つのαへリックスと2つの3重逆平行のβシート構造よりなる(Fig.6)。Fig.5のalignmentに見られるように(4つのシステインを含む)多くのアミノ酸残基はリンクモジュールスーパーファミリーを通じて高度に保存されている。β5ストランドの突出部は別として、二次構造を構成している部分に挿入や欠失はない。変化のある部分は主に露出したループの長さに影響を与えるだけである。というわけでこの構造からリンクモジュールスーパーファミリー全体としての「共通折りたたみ」構造が明確になった。実用的な面からみて、これはTSG-6リンクモジュールで見られる三次元構造は、他のスーパーファミリーメンバーのコンピューターモデルを作成するための原型として用いうることを意味する6,7。この良い試みとしてKIA0527のリンクモジュールは普通にはないシステイン残基の配置(Fig.5)を持つにも関わらず、Fig.7に示すようにうまくコンピューターモデリングが行なえた。

Fig. 5 Fig.1に示したタンパク質のリンクモジュールのMultiple sequence alignment。
LP,リンクタンパク質; A, アグリカン; B, ブレビカン; V, バーシカン; STAB-1, Stabilin-1; 61358, CAB61358; 0527, KIA0527. 配列はラット(R)由来であるブレビカンを除きすべてヒト由来である。システイン残基は黄色で、そして、他の高度に保存された(たとえば、配列の2/3は同一である)残基はピンクで示されている。これらの残基はリンクモジュールコンセンサス配列(CON)を形成する。TSG-6で決定された二次構造要素 (SS)の位置はalignmentの下に示す (a=α-へリックス, b=β-ストランド, ^ = 突出部)。
![]() enlarged Figure 5.
enlarged Figure 5.
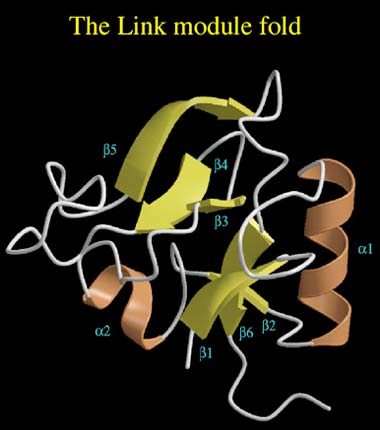
Fig. 6 リンクモジュールの折りたたみ構造。
この構造は二つのαへリックス(茶)と二つの三重βシート(黄)よりなる。シートI はβ1、β2、β6ストランドよりなり、一方、シートII はβ3、β4、β5よりなる。
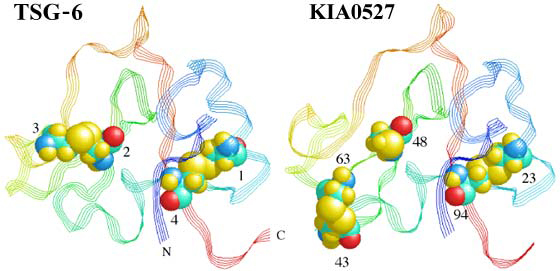
Fig. 7 TSG-6とKIA0527のリンクモジュール。
KIA0527のリンクモジュールはTSG-6リンクモジュールの座標と、Fig.5からのこれらのタンパク質のPairwise alignmentにもとづいてモデル化した(A J Day未発表)。TSG-6は保存されたCys1-Cys4とCys2-Cys3の間でジスルフィドブリッジをもつ典型的なリンクモジュールスーパーファミリーのメンバーである。KIA0527のモデルにおいて保存されたCys-2(48番残基)はCys3が無いのでフリーなSH基である。一方、二つの付加的なシステイン(43番、63番残基)がジスルフィド結合を形成しうる。このようにシステインの配置が普通でないにもかかわらず、TSG-6構造に模してモデルできるという事実は、この構造がリンクモジュールの共通折りたたみ構造を表わしていることの良い指標となる。
三次元構造を解明するために使われたリコンビナントのドメインは機能的にも活性があることが分かり1,4,5,8、TSG-6においてひとつのリンクモジュールで高親和性のヒアルロン酸結合に十分であることが示された。CD44の場合はこれと異なり、約160アミノ酸のヒアルロン酸結合ドメインを持つCD44は、ひとつのリンクモジュールにN-、C-末端の延長がジスルフィド結合によって結合している。このような延長は正しいおりたたみと機能的活性とに必要である(Fig.8)9,10。リンクタンパク質、アグリカン、そして他のアグリカン様プロテオグリカンでは、より大きなドメインが利用され、これらのタンパク質は全てヒアルロン酸結合部位に隣接した2個のリンクモジュールを有する(Fig.1)。リンクタンパク質とアグリカンにおいて、両方のリンクモジュールがリガンド結合に関与する11,12。従ってリンクモジュールスーパーファミリーは、それらのヒアルロン酸結合ドメインの大きさをもとに、Fig.9,10に示されるように3つのサブグループに分けることができる。このドメインの大きさは概して認識されるヒアルロン酸の長さと関連があるようである。例えば、6糖(HA6)と10糖(HA10)はそれぞれTypeAとTypeCドメインのヒアルロン酸の高親和性結合に最小限必要な長さである8。CD44へのヒアルロン酸の結合はHA6またはHA10のどちらかによって競合されるが、それはCD44を発現する細胞の種類による。
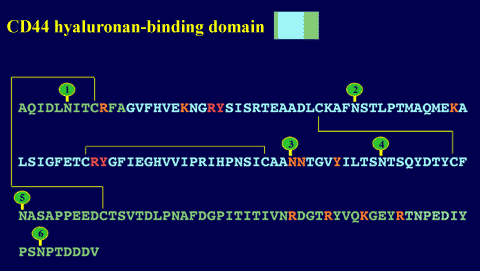
Fig. 8 CD44のヒアルロン酸結合ドメイン。
このドメインは約160アミノ酸の長さで、リンクモジュール(青)とN-,C-末端の延長(緑)がジスルフィド結合によってつながった構造よりなる。ヒアルロン酸結合にとって必須または重要なアミノ酸残基はそれぞれ赤とオレンジで示す。6つのN結合型グリコシル化部位は緑の線のついた丸印で示した。
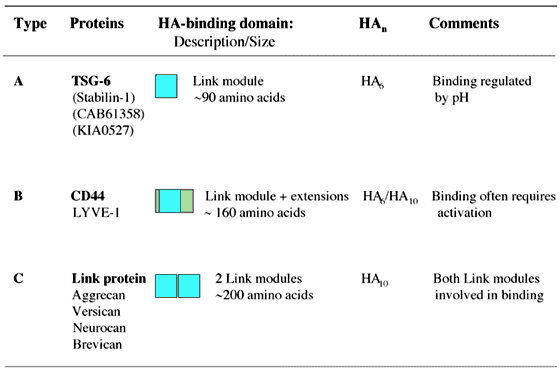
Fig. 9 リンクモジュールサブグループ。
リンクモジュールスーパーファミリーはそれらのヒアルロン酸結合ドメインの大きさをもとに3つのサブグループ(Type A, B, C)に分けることができ、それらはおおまかに認識されるヒアルロン酸(HA)の最小サイズに関連する7,8。太字で強調されたタンパク質はそれぞれサブグループの原型となるメンバーである。LYVE-1はCD44と同様、Type Bのヒアルロン酸結合ドメインを持っているようで、リンクモジュールに隣接した付加的なジスルフィド結合につながる配列を持つ2。括弧の中に示されるタンパク質はまだ、ヒアルロン酸結合タンパク質であるとは証明されていない。
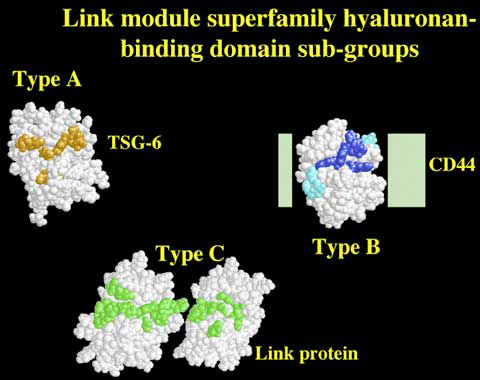
Fig. 10 TSG-6、CD44、リンクタンパク質のType A, B, Cのヒアルロン酸結合ドメインの構造、またはモデル。
TSG-6の1つのリンクモジュールであるType Aドメインの三次元構造のみが今日までに決定されている。ヒアルロン酸との相互作用を仲介するアミノ酸残基をオレンジ色で示すg。CD44とリンクタンパク質において示されたリンクモジュールはTSG-6の相当部をもとにしてモデル化した。CD44においてN-とC-末端の延長部(緑長方形)の構造は現在不明である。しかしながら、これらはリンクモジュールと緊密に接触するサブドメインを形成するようである7。CD44リンクモジュールのリガンド結合には必須、または重要なアミノ酸をそれぞれ濃青または淡青で示す6。Type Cドメインに関しては二つのリンクモジュールの相対的配置はまだ決定されていない。そこで、1つの可能性の配置のみ示す。リンクタンパク質のヒアルロン酸との相互作用に関わると推測されるアミノ酸残基は緑で示す(A J Day未発表)。
CD44のヒアルロン酸結合に関わるアミノ酸残基は部位特異的突然変異導入法により決定された6,9。Fig.8に見られるように、機能的に重要なアミノ酸はリンクモジュールと隣接する配列の両方に存在する。リガンドと結合する(リンクモジュール中の)アミノ酸残基は分子上で連続する平面を構成する(Fig.11)。リンクモジュールの同じ面がTSG-6におけるヒアルロン酸結合に関与しており、このことはリガンドと相互作用する表面の配置はスーパーファミリーを通じて保存されていることを示している8。これらの研究から、リンクモジュールをもつタンパク質において結合に関与するアミノ酸残基は一次構造の異なった部位から持ち寄られ、そして折りたたまれた構造がリガンドに結合する表面を生み出すのに必要であることは明らかである(Fig.12)。直線上の一次配列のモチーフ(たとえば、RHAMMに見つかったBX7Bペプチド)はリンクモジュール-ヒアルロン酸相互作用には関与しないようである8。
e このシリーズのTurleyとHarrisonらの総説を参照。
g D J Mahoney and A J Day 論文執筆中
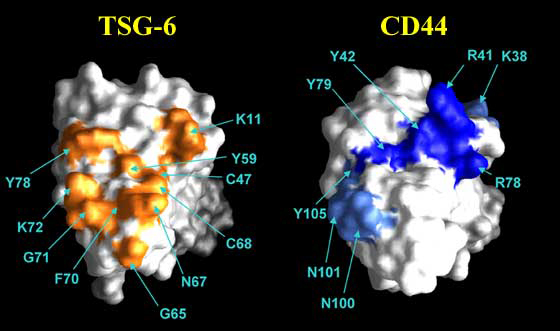
Fig. 11 TSG-6とCD44のヒアルロン酸結合部位。
これらのタンパク質のヒアルロン酸結合部位はリンクモジュールの同一面にある。HA8の結合に関わるTSG-6リンクモジュール上の表面に露出したアミノ酸をオレンジで示す8。部位特異的突然変異法により直接ヒアルロン酸との相互作用に関わるアミノ酸残基と、リガンド結合により引き起こされたコンフォメーション変化で影響を受けるアミノ酸残基との区別が可能となったg。リガンド結合に必須または重要なCD44リンクモジュールのアミノ酸残基はそれぞれ濃青または淡青でそれぞれ示す。
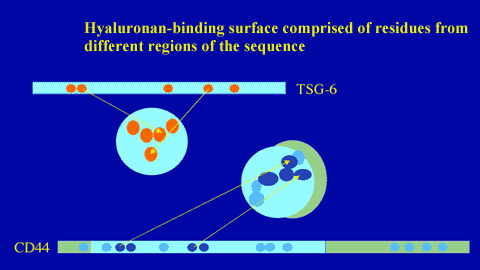
Fig. 12
ヒアルロン酸結合表面はタンパク質の配列の異なった部位のアミノ酸残基によって形成される。
TSG-6とCD44のヒアルロン酸結合部位はリンクモジュール表面の同様の位置にあるが(Fig.11)、この二つのタンパク質の結合に関与するアミノ酸残基と一次配列の位置の詳細に関してはいくつかの大きな違いがあるようである。CD44とTSG-6のリンクモジュール配列を、他の全てのスーパーファミリーのメンバーと比較すると、ヒアルロン酸結合の分子的な詳細(すなわち、相互作用ネットワーク)はそれぞれのタンパク質で異なっているようである。これは、異なったヒアルロン酸結合ドメイン(上記)のサブタイプがあり、特異性と調節に他の多くの違いが同様に有るということから驚くことではないだろう。たとえば、TSG-6はコンドロイチン-4-硫酸に高い親和性で結合するが、このグリコサミノグリカンはアグリカンやリンクタンパク質によっては認識されない。
化学修飾を用いた研究によって、アグリカンとリンクタンパク質のヒアルロン酸への結合にグリコサミノグリカンのカルボキシル基とイオン結合を形成する塩基性アミノ酸が主要な決定要因であることが示された8。このことはCD44の場合もまた同様で、2つのアルギニン残基(Arg41とArg78)がリガンド結合に決定的な役割を担っている6,9。さらに2つのチロシン(Tyr42とTyr79)はCD44の機能的な活性に必須で(Fig.11);Tyr79をフェニルアラニンに変異させると機能的活性が破壊され、このことは、その水酸基が糖との重要な水素結合を形成することを示している6。3つのリジン、4つのアルギニン、2つのアスパラギンと1つのチロシン(Fig.8にオレンジで示す)を含むCD44の他のアミノ酸はまた、ヒアルロン酸結合に関与すると考えられているが重要度は低い。結合に関係するアミノ酸残基の数が多いことは、その広範な相互作用のネットワークにより、ヒアルロン酸との会合が維持されることを示している。このエネルギー状態は明らかに微細にバランスがとられ、1つの水酸基やイオン性相互作用の消失が結合をなくすのに十分でありうる。このことはTSG-6の場合も同様で、塩基性と芳香属基を含む5つのアミノ酸が重要な機能的役割を持つことが同定されているg。今日までに、ヒアルロン酸-タンパク質結合の熱力学的解析はTSG-6のリンクモジュールだけが測定されたが、その中で相互作用を誘導する主要なエネルギー的寄与は大きな発熱的なエンタルピーである8。結合に見られる熱容量の小さな変化は、大きな疎水性の表面の領域を埋め込んでしまうというよりは、明らかな極性または電荷を帯びた部分を形成する分子間の境界領域にあると考えられる。イオン性会合が重要であるということは明らかであるが、非イオン性相互作用(たとえば、水素結合とファンデルワールス力)もまた、結合エネルギーに重要な寄与をしているようである15。このことはリジンに加え、3つのチロシンと1つのフェニルアラニンが結合に重要な役割をもつことを示した部位特異的突然変異導入の結果と一致するg。
g D J Mahoney and A J Day 論文執筆中
BX7Bモチーフ(Bはリジンまたはアルギニンでは、酸性アミノ酸を除く任意のアミノ酸)で示される塩基性アミノ酸のクラスターがヒアルロン酸とRHAMMeの間の相互作用に関わっていると提案された。BX7B様の一次配列は他の多くのヒアルアドヘリン(例えばIαI、SPACR, SPACRCAN, CD38, CDC37, P-32, IHABP4: Fig.4)に存在するが、これらのタンパク質において、それがヒアルロン酸結合を仲介することを示すデータはない。このような塩基性アミノ酸の配置はタンパク質の一次構造の中できわめて一般的である。従って、BX7Bモチーフの存在はタンパク質がヒアルロン酸に結合するであろうことの指標として用いられるべきではなく、また、BX7Bモチーフはヒアルアドヘリンにおけるリガンド結合活性に必要な部位であると推測されるべきでもない。
e このシリーズのTurleyとHarrisonらの総説を参照。
リンクモジュールスーパーファミリーの他のメンバーとは異なり、TSG-6とヒアルロン酸の相互作用は非常にpH依存的で(Fig.13)、pH6に最大結合があり、pHが上昇すると劇的に結合の減少が起こる4。このことは、有意なpHの勾配を有する組織ではTSG-6のリガンド結合能を調節するのに役立つかもしれず、例えばTSG-6を発現している炎症を起こした軟骨などである(Fig.3)。この珍しいpH依存性の構造的基礎はまだ完全には理解されていない。しかしながら、pH6とpH8の間では、TSG-6のリンクモジュールの構造の変化は明らかに検出されない15。ひとつの可能性としては、pHの上昇がヒスチジン残基の電荷状態を変化させ、重要な結合相互作用の消失をおこさせるという可能性がある。
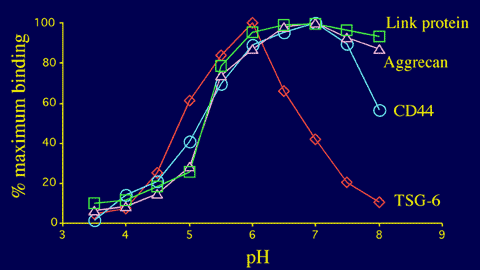
Fig. 13 リンクモジュールスーパーファミリーの4つのメンバーのヒアルロン酸結合活性におけるpHの影響。
TSG-6リンクモジュールとヒアルロン酸の相互作用のpH依存性はCD44 (A A Parker, S Banerji, D G Jackson & A J Day, 未発表データ)、アグリカン、リンクタンパク質のそれとは異なる。
CD44は多くの細胞種(たとえば、リンパ球細胞)で非機能型として存在し、ヒアルロン酸結合能を獲得するにはいくつかの活性化の過程を必要とする。CD44活性の調節は多くの因子が関わっている可能性がある複雑な問題点である。これらはCD44を発現している細胞種、翻訳後修飾(たとえば、グリコシル化)、スプライシングによるアイソフォーム、細胞内骨格系への結合、細胞表面での分子クラスター化/レセプター密度、細胞質ドメインのリン酸化などがあるd,14,16。これらの多くはすでにこのシリーズでレビューされているのでd、ここではグリコシル化の役割のみ議論しよう。Fig.8に示すように、ヒトCD44のヒアルロン酸結合ドメインは6つのN-結合型糖鎖が付加される部位を含んでいる。この領域を大腸菌で非グリコシル化型として発現させる、または、部位特異的突然変異導入法により、グリコシル化は正しい折りたたみや機能的活性にとってこの位置のどれも必要でないことが示された。しかしながら、グリコシル化はCD44とヒアルロン酸の相互作用を調節する主要な機能の一つであり、細胞種、細胞の活性化の状態によりレセプターの異なったグリコシル化がある。リンクモジュールに隣接した配列上の1つめと5つめのグリコシル化部位から突然変異導入によりN結合型糖鎖を除くと「誘導可能な」細胞種でのCD44を恒常的な活性型に変換させることができる16。このことは特定の糖構造がヒアルロン酸結合部位を覆い隠すことができるということを示すものかもしれない。もう一つの可能性は、あるN-結合型糖鎖はレセプターのクラスター化を阻害する、または、タンパク質を非結合型の構造に固定してしまうということである。CD44の調節の分子的基礎はいったんヒアルロン酸結合ドメインの三次元構造が判明すれば、より明確になるはずである。たとえば、これによりヒアルロン酸と相互作用する表面に関連するグリコシル化部位の位置が明らかになるであろう。
d このシリーズのKnudson and Knudsonの総説を参照
リンクモジュールはC型レクチンドメインととてもよく似た折りたたみ構造をしている1。Fig.14のように、これらのドメインは同一なトポロジーをもち、同様のニ次構造の要素と疎水性のコアを共通に安定化する多くのアミノ酸残基を持っている。これらのドメインの糖結合の様式はあきらかに異なっているが(すなわち、C型レクチンはCa++依存的様式で結合するが、リンクモジュールのヒアルロン酸相互作用は金属イオンに依存しない)、リガンドが結合する表面の位置は非常に似ている6。また、両ドメインは、炎症時の血管内皮への白血球のrollingを仲介する。従って、それらが進化的な共通の起源を持つことは非常にありうることである。C型レクチンドメインは多くの非脊椎動物のタンパク質にも存在するが、リンクモジュールはサメを含む脊椎動物でのみしか同定されていない17。このことはリンクモジュールは多分、約4億年前、軟骨魚類と硬骨魚類/陸上の脊椎動物の分岐以前のいつかにC型レクチンから進化したのであろう。興味深いことに、LeeとSpicer18はヒアルロン酸の合成能は後生動物の進化の過程においては比較的新しい改革であるという仮説を立てた。たとえば、ヒアルロン酸合成酵素はナメクジウオでは見つかっているが、ショウジョウバエの遺伝子にはこのような酵素はコードされていないh。というわけで、リンクモジュールとヒアルロン酸は進化の過程でほぼ時を同じくして出現した可能性がある。
h このシリーズのSpicerとMcDonaldの総説を参照。
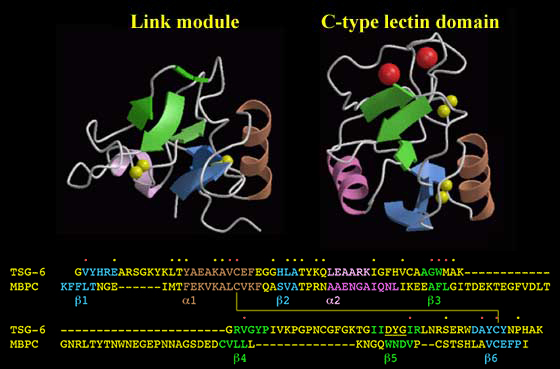
Fig. 14 リンクモジュールとC型レクチンドメイン。
これらのモジュールは同一のトポロジーを持ち、非常に似た二次構造の構成からなる。ヒトTSG-6のリンクモジュールとヒトマンノース結合タンパク質C鎖 (MBPC)のalignmentから二次構造の要素は同等のアミノ酸配列位置に見つかることがわかる。黄/赤の点は同一または保存的置換のアミノ酸の位置を示す。二つのドメインの疎水的な内部構造はよく似ていて、C型レクチンドメインのコアとなるアミノ酸残基はリンクモジュール(赤点)のそれと同等のアミノ酸配列位置に見つかる。これは、それぞれのモジュールでジスルフィド結合によって結合しているCys1とCys4の保存されたシステイン残基を含む。この構造の間の大きなな違いは、二つのループの長さである。リンクモジュールはβ3とβ4 ストランドをつなぐ短いループをもつが、C型レクチンドメインではCa++イオン(大きな赤い球)をキレートできるアミノ酸残基を含む約35アミノ酸の領域が存在する。同様にリンクモジュールにおいてβ4とβ5 ストランドの間の14アミノ酸残基のループはレクチンドメインより短い。リンクモジュールのβ5 ストランドはFig.5に示すように突出部(下線)で中断されているので二つのパートに分かれている。
ここ数年のうちにヒアルロン酸-タンパク質相互作用に対する我々の理解は大きな進歩を遂げた。しかしながら、この知識はまだまだ不十分で、我々がこの驚くべき多糖の生物学の基礎になる分子的機序を解明しようとするために、異なったタイプのヒアルロン酸結合ドメインとそれらのリガンド複合体の三次元構造を決定するさらなる研究が必要である。