
著者は、1957年に名古屋大学から理学博士号を取得した後、1957-1959年の間、セントルイス市のワシントン大学医学部薬理学教室で博士研究員として研究、1962年に名古屋大学理学部化学科教授に就任し生物化学を担当した。1989年、愛知医科大学分子医科学研究所(現所長:木全弘治博士)に移り、現在は同研究所の客員教授としてプロテオグリカンの研究および水谷糖質科学財団の活動に参加している。1960年以降約15年間、鈴木博士は共同研究者らと集中的にグリコサミノグリカン鎖の構造と生合成の研究を行い、それらの研究の中からコンドロイチナーゼABC、コンドロイチナーゼAC、コンドロ-4-スルファターゼ、コンドロ-6-スルファターゼ、ケラタナーゼ、β-D-キシロシド(コンドロイチン硫酸鎖生合成プライマー)など、多くの新しい試薬と技術を生み出した。
1934年にMeyerとPalmerがヒアルロナンを発見して間もなく、Meyerの研究グループは、2型肺炎双球菌(type 2 pneumococcus、別名:Streptococcus pneumoniae)の抽出液にヒアルロナンを低分子化する酵素活性があることを明かにした。その後、多くの研究者によって、Clostridium(クロストリデイウム)、Micrococcus(ミクロコッカス)、Streptococcus(ストレプトコッカス)、Propionibacterium(プロピオン酸菌)、Peptococcus(ペプトコッカス)、Strptomyces(ストレプトミセス)などに属するいろいろな菌種からヒアルロナン分解酵素が発見されている。これらの中に病原性細菌が多く含まれているのは、それらの菌がひき起こす感染症の因子を解明するのに、ヒアルロナン分解酵素の研究は避けて通れないという状況があるためである。これらの酵素にはもうひとつ別の顔がある。それは、すでにこのシリーズで紹介されてきたように、受精、細胞分化、細胞移動、組織形態形成、炎症、創傷治癒、がん転移でのヒアルロナンの役割を研究する有効な試薬としての顔である。
細菌およびストレプトミセス(放線菌)から分離されたヒアルロナンリアーゼ(EC4.2.2.1)は、その作用様式が他の生物種から分離されたヒアルロニダーゼ(正式には、ヒアルロノグルコサミニダーゼ;EC3.2.1.35)と異なる。どちらもN-アセチルβ-D-グルコサミンとD-グルクロン酸を結ぶβ-1,4グリコシド結合を切断するが、後者が加水分解を触媒するのに対して、前者は脱離反応を触媒する (Fig.1)。その結果、前者は非還元末端にΔヘキスロン酸をもつ不飽和オリゴ糖を生成する。この不飽和構造は紫外線を吸収するので、それを利用して反応生成物を簡単に検出、定量することができる。一方、これらの生成物の末端還元基に2-アミノピリジンあるいは2-アミノアクリドンなどの蛍光標識をつければ、ヒアルロナン、コンドロイチン、コンドロイチン硫酸鎖混合検体からリアーゼ分解で生成する飽和単糖と飽和2糖(非還元末端から生成)も、不飽和Δ2糖(鎖内部の2糖繰り返し部分から生成)も合わせて、ナノグラムレベルの微量で分離、定量することができる。1 これら単糖、2糖の分離にはHPLCやポリアクリルアミドゲル電気泳動が使われている。
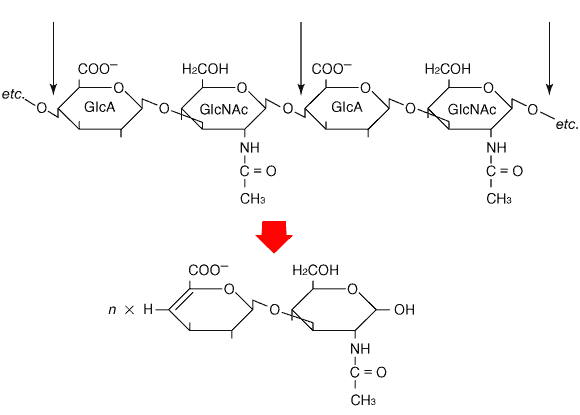
Fig. 1 ヒアルロナン鎖の2糖繰り返し構造と、リアーゼ(エリミナーゼ)切断による不飽和2糖の生成。
細い矢印は酵素によって切断される結合を示す。式を簡単にするため、グルクロン酸(GlcA)残基の2-、3-位とN-アセチルグルコサミン(GlcNAc)残基の4-位にある水酸基は省略した。
Fig.2には各種ヒアルロナンリアーゼの特異性が示されている。もっとも特異性が高いのはStreptomyces hyalurolyticusから精製した酵素でヒアルロナン以外のグリコサミノグリカン、例えばコンドロイチン、コンドロイチン4 / 6-硫酸、デルマタン硫酸、ケラタン硫酸、ヘパラン硫酸、ヘパリンには全く作用しない。2 一方、Streptococcus dysgalactiaeとPeptococcusから精製された酵素は弱いながらもコンドロイチンおよび(あるいは)コンドロイチン4 / 6-硫酸に対する活性をもっている。3 第3の型はArthrobacterから精製され“コンドロイチナーゼAC1アルスロ”という商品名で市販されている酵素である。この酵素はヒアルロナンをもっとも速く分解する一方で、コンドロイチンとコンドロイチン4 / 6-硫酸をそれぞれ2/3および1/3の速度で分解する。4 “コンドロイチナーゼABC”(Proteus vulgaris NCTC 4636から精製)と“コンドロイチナーゼAC-Ⅰフラボ”(Flavobacterium heparinum ATCC 13125から精製)と呼ばれている市販酵素は、ヒアルロナンにも作用するが、その速度はコンドロイチンおよびコンドロイチン4/6-硫酸に対する分解速度よりもはるかに低い。5,a したがって、複数のグリコサミノグリカンより成る検体をリアーゼ消化によって分析する場合には、起原の異なるリアーゼの特異性の違いによって生ずる混乱を避けるため、何らかの相補的な技術を併用することをすすめたい。
a “コンドロイチナーゼABC”という商品名で知られる酵素標品が示す活性は、エンドリアーゼとエキソリアーゼの共同作業によるものである。6 このエンドリアーゼは“コンドロイチナーゼABC、プロテアーゼフリー”という商品名で市販されている。
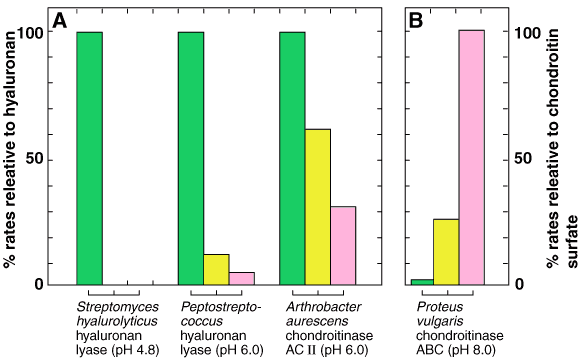
Fig. 2 起原の異なるヒアルロナンリアーゼとコンドロイチナーゼの基質特異性。
A;ヒアルロナンの分解速度(green bars)を100として、コンドロイチン(yellow bars)とコンドロイチン4/6-硫酸(pink bars)それぞれの分解速度をパーセントで示す。それぞれの反応pHは括弧内に示されている。B;コンドロイチン4/6-硫酸の分解速度を100として、Aと同じようにヒアルロナンとコンドロイチンの分解速度をパーセントで示す。
Streptomyces hyalurolyticusのヒアルロナンリアーゼ(生化学工業製品)とgroup B Streptococcus agalactiae 3502のヒアルロナンリアーゼを比べてみると、前者がエンド型でヒアルロナン鎖の内部を好んで切断しつつ最終的にΔ6糖とΔ4糖の混合物を与えるのに対して、後者はまずヒアルロナン鎖をランダムに切ってから、生成した糖鎖断片それぞれを(非還元末端から)逐次2糖単位ごとに切断しΔ2糖を与える。7 おもしろいことに、この酵素はヒアルロナンのみでなく、ある種のコンドロイチン硫酸鎖(ラット軟骨肉腫をパパインとプロナーゼで消化して作ったもの)にもゆっくりとした速度で作用する。このコンドロイチン硫酸標品は、一本の鎖あたり平均5個の2糖単位が硫酸基を欠如しており、Streptococcusのヒアルロナンリアーゼは、Fig.3に示すようにコア蛋白との結合領域に近接して少なくとも2つ存在する非硫酸化2糖クラスターの部分を特に好んで切る性質がある。これは、この酵素がコンドロイチン硫酸プロテオグリカンの構造解析にとって貴重な試薬となる可能性を示唆している。また、コア蛋白との結合近傍を好んで切断する能力からみて、この酵素をもっている細菌は宿主に感染したあと、その組織を破壊侵入する力が強いことが推測される。
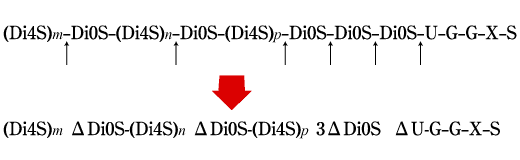
Fig. 3
軟骨肉腫のプロテオグリカンから調製したコンドロイチン硫酸鎖上の繰り返し2糖単位、GlcA-GalNAc4S(Di-4Sと略)とGlcA-GalNAc(Di-0Sと略)の分布とgroup B Streptococcusヒアルロナンリアーゼによる分解。m, n, pは、Di4S連続構造の2糖繰り返し数。U, G, X, Sは、鎖の還元端側にあるコア蛋白との結合領域の糖残基とアミノ酸残基で、それぞれグルクロン酸、ガラクトース、キシロース、セリンを示す(Bakerらの論文7にならって作成)
これまでに、Streptococcus agalactiae、type 23 Streptococcus pneumoniae、Staphylococcus aureus、Propionibacterium acnesそれぞれに属する菌種からヒアルロナンリアーゼの完全な遺伝子あるいは遺伝子の一部分がクローニングされている。8 これらの中でもっとも新しい報告では、 Streptococcusヒアルロナンリアーゼ遺伝子“hylB 4755“の完全配列が決められている。この遺伝子は、アミノ酸30より成るシグナル配列をもった1072アミノ酸ポリペプチドをコード化する。 hylB 4755の異形発現は、それ自身がもつプロモーターによって効率よく行われ、完全な酵素蛋白分子(118kDa)が生成する。この酵素蛋白は、以前にS. agalactiae 3502株とtype 23 S. pneumoniaeそれぞれから得られた遺伝子がコード化する酵素と高いホモロジーを示すが、後二者はいずれも5’-末端側を欠如した不完全遺伝子である。
面白いのは、上記のS. pneumoniae不完全遺伝子が発現する89kDa断片(開始点が正常でない下流翻訳の産物)でもヒアルロナンリアーゼ活性を示すことである。さらに付け加えておきたいのは、S. agalactiae 3502株からクローニングされた不完全な遺伝子“hylB 3502“を用いて得られた酵素では、その活性に関与するアミノ酸残基としてHis-567が同定されており、それに相当するHis残基がhylB 4755蛋白にも含まれていることである。これらの結果は、かなり以前に報告されている下記の観察ともよく一致している。 group A streptococciから精製した(天然の)ヒアルロナンリアーゼをメチレン青存在下で光酸化にかけると、ヒスチジン残基含量が減少するのに比例して酵素活性が低下する。さらに、ヒスチジン残基のイミダゾール環をエキソ攻撃するアルキル化剤TPCKとの反応でも酵素活性が低下する。9 Fig.4は、ヒアルロナンリアーゼの作用機構として、ヒスチジン残基のイミダゾール環がウロン酸残基のC-5からプロトンを引きぬく働きをするという想定で画いたものである。このようなプロトン引きぬきの可能性をもつアミノ酸残基は他にもあると思うが、今のところヒアルロナンリアーゼ反応に直接関与するという証拠は報告されていない。
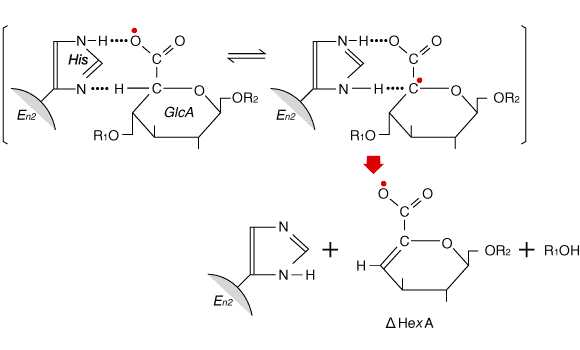
Fig. 4
ヒアルロナンリアーゼ(Enz)と基質との反応メカニズムにヒスチジン残基が関与する可能性9。酵素分子上の活性塩基(His)は、基質のグルクロン酸残基(GlcA)をカルベン酸型互変異性中間体(C5に不対電子2個![]() をもつ)に変える。この中間体はグルコサミン残基との結合を切ることによって安定な△不飽和構造に移行する。
をもつ)に変える。この中間体はグルコサミン残基との結合を切ることによって安定な△不飽和構造に移行する。
これまでに、Staphylococcus aureus 1801のヒアルロナンリアーゼと、Arthrobacter aurescens、Flabvobacterium heparinum、Proteus vulgarisそれぞれのコンドロイチン硫酸リアーゼ(コンドロイチナーゼ)が精製され結晶化されている。そのうちF. heparinumのコンドロイチナーゼAC10とコンドロイチナーゼB11の結晶解析が報告されている。その結果によれば、コンドロイチナーゼAC分子は2つのドメインから成り、N-末端側ドメイン(〜300アミノ酸残基)ではα-ヘリックス(全部で12本)が主体となって2層の馬蹄形を作っている。 一方、C-末端側ドメイン(〜370アミノ酸残基)はすべて4層のβ-シート構造をとっている。Fig.5(M. Cygler博士から恵与)にこの酵素分子の外形を示す。N-末端側ドメインに沿って大きな溝があり、その内部には高濃度の塩基性残基(例えば、His225、Arg288、Arg292、Lys298、Lis299)によってコンドロイチン硫酸との結合に関与しそうな陽性電荷表面が存在する(Fig.5A)。また、この溝には高い保守的配列をもった芳香性残基(例えば、Trp126、Trp127、Tyr234)がいくつか存在する(Fig.5B)。これは、コンドロイチナーゼAC(Arthrobacter)と基質との結合反応に疎水的相互作用が重要であるとする以前の生化学的実験データと一致する。10 コンドロイチナーゼBの結晶構造は、コンドロイチナーゼACのそれとは対照的に、ペクチン酸リアーゼやポリガラクチュロナンヒドロラーゼ型の折りたたみβ-ヘリックススーパーファミリーに属する。11 今後さらに、ヒアルロナンリアーゼやそれらに関係のある酵素群の突然変異や結晶解析の研究がすすめば、多糖リアーゼ群の理解はより深くなり、それらリアーゼ群の生物学的機能の研究が一段と促進されることになろう。
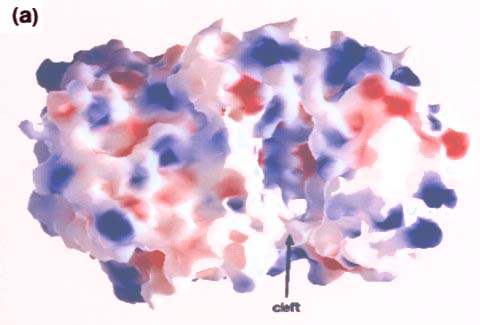
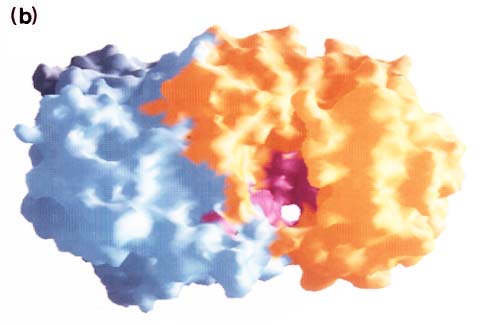
Fig. 5 コンドロイチナーゼACの分子表面。馬蹄形分子の溝(cleft)の上にあるN-末端α-ヘリカルドメイン側から見た図。
向かって右側がα-ヘリカルドメイン、左側はβ-シートドメイン。(a)分子表面の静電ポテンシャル分布(GRASP10使用)。赤色は陰性電荷。青色は陽性電荷。溝(cleft)の内側表面は全体的に陽性であるが、極めて強い陰性領域が少し存在する。(b)保守性の高い残基の分布。α-ヘリカルドメインをオレンジ色、β-シートドメインを淡青色、高保守性残基を深紅色で示す。溝の内側に高濃度の保守性残基がみられる。Miroslaw Sygler博士(Biotechnology Research Institute,Montrè,Québec, Canada)の好意により転載。
はじめにも述べたように、ヒアルロナンリアーゼの最終生成物は、主としてΔヘキスロニド-N-アセチルグルコサミンである。ただしStreptomyces hyalurolyticusヒアルロナンリアーゼは例外で、Δ4〜6糖が最終生成物である。これらΔ2糖産生微生物の多くは、その2糖からα-ケト酸とN-アセチルグルコサミンを生成するβ-グルクロニダーゼをもっている(Fig.6)。12
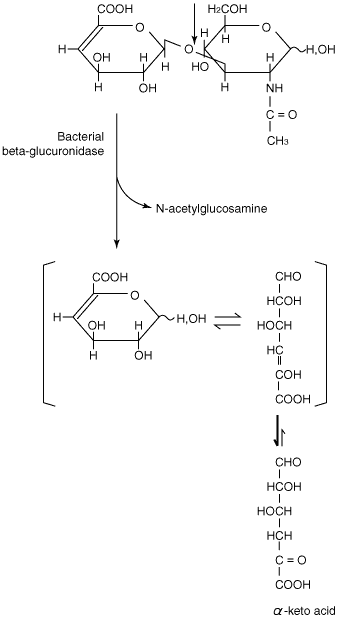
Fig. 6 細菌の△グルクロニダーゼが触媒するN-アセチルグルコサミンとα-ケト酸生成反応。
したがって、これらの細菌、とりわけヒト結腸の微生物叢に存在する細菌にとって宿主の粘膜層や食物中に存在するヒアルロナンは良い炭素〜エネルギー源である。Bacteroides thetaiotaomicron 5482はそのような結腸生息細菌の一つであるが、その野生株から、トランスポゾン挿入によって得られた変異株“CS4”は、ヒアルロナンやコンドロイチン硫酸を栄養源として生長することができないにもかかわらず、前もってそれら多糖をリアーゼで分解して得られるΔ2糖を利用して生長する能力をもっている。13 このCS4変異は、細菌細胞の外部細胞膜に存在する非酵素蛋白をコード化する単一遺伝子“CSUF”の変異によって導かれたものである。この結果からみて、ヒアルロナンやコンドロイチン硫酸は、まず一種類あるいは複数種類の外部細胞膜蛋白質(トランスポーター)に結合してペリプラスムへ移行し、そこでヒアルロナンリアーゼやコンドロイチナーゼによる低分子化をうけるものと思われる(Fig.7)。
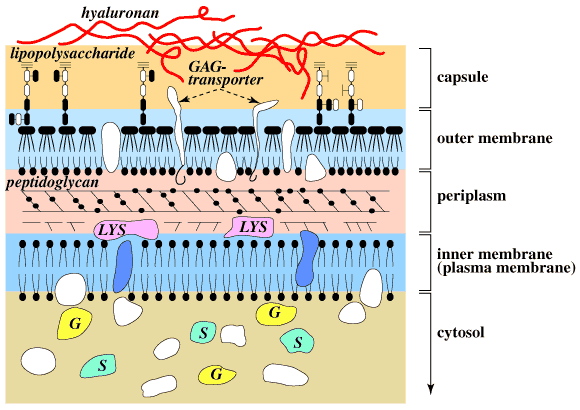
Fig. 7 グラム陰性菌表面の概略図。
菌の表面は2重膜構造からなり、内膜と外膜の間には細胞壁ペプチドグリカンを含むペリプラスム層がある。外膜の表面はリポ多頭の莢膜でおおわれ、ムコイド株ではさらにヒアルロナン莢膜がその外側をおおう。莢膜からペリプラスムにまたがってグリコサミノグリカントランスポーター(GAG transporter)が分布し、グリコサミノグリカンリアーゼ群(LYS)は、ペリプラスム内に分布する。これらリアーゼによって作られる生成物をさらに分解するスルファターゼ群(S)やグリコシダーゼ群(G)は細胞質ゾルに存在する。
侵襲性感染や重い病気(例えば急性リウマチ熱)をひきおこす細菌ムコイド株(例えばgroup A streptococci)の多くが、ヒアルロナンに富む莢膜でおおわれていることから、そのようなヒアルロナンは宿主細胞表面のヒアルロナン結合分子群(例えばCD44)に結合するリガンドではないかとか、宿主の免疫系による貪食作用に対する擬装因子ではないかという仮説が出されている。14 一方では、病原性細菌のヒアルロナンリアーゼが、宿主に感染した細菌の組織侵入性を促進したり、正常な免疫細胞の防御機構を破壊する菌力因子の一つではないかという仮説もある。ヒアルロナンとヒアルロナン分解酵素の双方が、このように重複した機能をもつというのはどう説明したらよいのだろうか? 宿主の粘膜層では、いろいろな神経ペプチド、免疫サイトカイン、プロテオグリカンなどを媒体とする神経〜免疫相互作用が営まれている。b 細菌のヒアルロナンリアーゼあるいはその作用によって生成するオリゴ糖が、神経〜免疫相互作用を攪乱することによって炎症前段階あるいは病因性効果をもたらすというスペキュレーションも興味をそそるものがある。
b ラット小腸のマスト細胞(その他の免疫細胞の一部も)には神経細胞が接近して存在し、神経ペプチド(ニューロテンシンなど)の作用、逆伝導性神経刺激、ストレスケージへの幽閉などによってマスト細胞の活性化がおこる。15
病原性細菌の感染過程で、細菌ヒアルロナンとヒアルロナンリアーゼがどのような役割を演じているかを知り、その特徴を明らかにするには、まだ多くの研究が必要である。ヒアルロナン合成酵素とヒアルロナンリアーゼ群それぞれの遺伝子クローンが実験に利用できるようになれば、感染症での機能の解明は大きく前進するであろう。ヒトの胃腸管、呼吸器、泌尿生殖器表面を広く覆う上皮粘膜は、外側に多くの微生物や病原物質、内側に豊富な神経免疫ネットワークをかかえる極めてデリケートな機能的界面である。15 微生物のヒアルロナン莢膜とヒアルロナンリアーゼに対する理解がより深くなれば、このような粘膜の神経免疫スーパーシステムの機能解明、そしてそれらが関わる健康と病気のプロセスを制御する新しい遺伝学的手法、診断と治療法の発展に寄与することになろう。
謝辞
ご協力をいただいたVincent C. Hascall博士、杉浦信夫博士、矢田俊量博士に感謝いたします。