
氏名: Thomas N. Wight
Thomas N. Wightはメイン大学で学部学生として過し、ニューハンプシャー大学で大学院生として研究し、1972年にPh.D.を授与された。シアトルのワシントン大学の病理学科でポストドクとして過した後、1974-1978年にはニューハンプシャー大学に職員として戻った。博士は1978年ワシントン大学病理学科に戻り、現在はここの病理学教授である。博士の長年にわたる血管生物学でのプロテオグリカンとヒアルロン酸の役割についての研究の結果、現在この研究分野における世界をリードする研究者としての位置を確実なものとしている。博士はアメリカ心臓協会のEstablished Investigatorの称号を得、またNIH研究費の審査委員をつとめた。
Wight博士はアメリカ心臓協会およびアメリカ糖尿病協会のメンバーであり、Arteriosclerosis、Thrombosis and Vascular Biology; the Journal of Histochemistry & Cytochemistry; Glycoconjugate Journalおよび Archives of Biochemistry and Biophysicsの編集委員である。博士はプロテオグリカンとヒアルロン酸に関して120以上の論文を発表している。
血管は、動脈と静脈の枝分かれした系を通して血液を心臓から運び出し、さらに心臓へ運搬する機能を担っている。大および中サイズの動脈は、三層から成っており、それは内膜、中膜および外膜である(Fig.1)。各層は、ヒアルロン酸(以下HAと略記する)と他の分子がからみ合い架橋されてできる細胞外マトリックス(ECMと略記)中に、細胞が埋め込まれて形成されている。三つの層は全て、その細胞とECM組成が相互に異なっている。最内層にある内膜は、内皮細胞から成り、これは下部にある色々なECM分子の混合物(基底膜と呼ばれている)に付着している。基底膜の下にはECMの薄い層があり、ここにはところどころ平滑筋細胞が存在する。中膜は、帯状の弾力組織である内弾性板により内膜から分けられている。この層は同心円状に並んだ平滑筋細胞から成り、帯状のエラスチンと少量のECMで分けられている。最も外側にある外膜は、高密度のECMに埋め込まれた結合組織細胞(線維芽細胞)のおおいから成る。
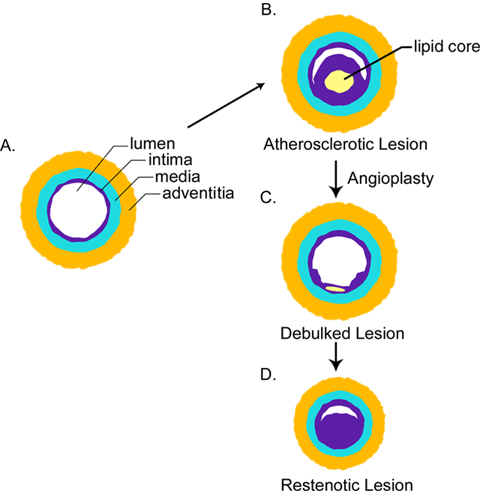
Fig. 1 アテローム性硬化と再狭窄に見られる構造変化
A:正常動脈. B:脂質コア(黄色)と著しく肥厚した内膜(紫)を含んだアテローム性硬化動脈. C:動脈の再開通のためのバルーン血管再形成術によって除かれたアテローム病変. D:新しい内膜増殖および/または動脈収縮のため再閉塞した再狭窄病変。
HAは全ての血管中に存在し、前述したような層状の構造を示す動脈においては、内膜と外膜で豊富であるが、中膜にはまばらにしか存在しない。HAの量は血管の種類と年齢に依存している。例えば、さい帯動脈のようなヒト胎児血管は、全グリコサミノグリカン(GAGと略記する)の40%をHAとして含むが、大動脈のような大人の動脈では、全GAGのたった4〜6%がHAである。胎児血管における高含量のHAは、疎に水和した血管のECMを創り出し、柔軟性を提供している。この柔軟性は、大きく変化する機械的な力にさらされた血管が、伸び切って適度な限界まで達することを可能にしている。HAによって生み出された、ゆるく、隙間のあるECMは、血管細胞が、動脈と静脈の形成過程で各層へ移動し、振り分けられてゆくことを可能にしている。
動脈のHA含量は、動脈の機能上の必要に応じて変化する。例えば、HAは誕生時における動脈管の閉鎖に重要な役割を演じている。動脈管は胎児の血管で、かなりの割合の血液を肺循環へバイパスして右心系から体循環へ短絡させる。誕生時に、この血管は閉じられ、血液は右心系から肺へ流れはじめる。この閉鎖の準備中に、内皮細胞は多量のHAを合成し、内皮下に蓄積する。1 HAはこの層で膨張圧力を生じ、それによって組織が拡張し、下にある平滑筋細胞の移動と増殖を促進することになる。
これらの変化により血管壁が厚くなり、その結果閉鎖される。これらの変化はアテローム性動脈硬化症や再狭窄の血管で起る病理的変化とは同じではない(以下参照のこと)。
HAはアテローム性動脈硬化と血管再狭窄で異なった病期に蓄積する。2-4 アテローム性動脈硬化症は筋肉性および弾力性の両方の動脈に起る疾病で、一生のうち数十年にわたって進展する。この病変は動脈の内膜に限定して起り、細胞、ECMおよびコレステロール運搬リポプロテインのような血漿性分子の蓄積により、この層が肥厚することが特徴的である(Fig.1)。動脈硬化部位は、ECMや細胞それにカルシウムの沈着によって囲まれたリピドの核をもつ、隆起した病斑から成っている。時間と共にこの病斑は大きくなり破裂し、血液凝固と血管をふさぐ血栓の形成へ導かれる。病斑形成の全ての段階を一つの仮説では説明できないが、アテローム性動脈硬化の一貫した特徴はHAを含むECM成分の過剰な蓄積である。
HAは病斑の全ての層に存在し(Fig.2)、バーシカンのような他のHA結合性分子が存在する場所によく見られる。しかしながらこれらの研究からは、病変部位の進展においてHAの蓄積は初期に起るのか後期に起るのか、またHAは、動脈硬化部位の形成に与る変化を制御しているかどうかは明確になっていない。
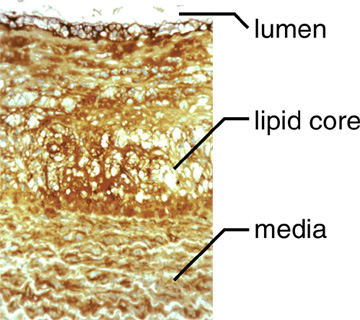
Fig. 2 ヒアルロン酸に対するプローブで染色した非ヒトの霊長類のアテローム性硬化病変
ヒアルロン酸は病変部位全体に存在している。
これらの疑問を解明するため、研究者達はこの疾病の発病に関っている時間的および空間的現象を再現するモデル実験動物に関する仕事を開始した。3 何年か前に、高脂肪食を与えられた動物にバルーンカテーテルで血管を傷つけると予測でき、時間に依存した形でアテローム性動脈硬化病変がもたらされることが分った。この病変はこれらの動脈の内膜に発生し、平滑筋細胞とマクロファージの数が増え、ECMが蓄積するという特長を有する。血管損傷に続くECMの変化は非常に特異的で、特徴ある分子を含んでいる。例えば、傷害の発生している部位でHAが増加し、そこには平滑筋細胞の移動と増殖が活発に見られる3 (Fig 3)。
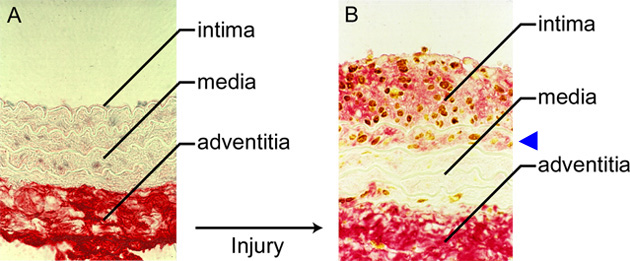
Fig. 3 ラット頸動脈の実験的損傷
A:ヒアルロン酸(赤)および増殖細胞(PCNA)(茶)に対するプローブで染色した正常ラット動脈。 外膜にヒアルロン酸の蓄積が認められる。 B:バルーン損傷7日後, ヒアルロン酸(赤)の蓄積および細胞増殖(茶)により内膜が肥厚している。 中膜の第一層内のヒアルロン酸の沈着と増殖細胞に注目(矢印)。3
これらの初期の変化は、HAと結合する分子のバーシカン、HA受容体のCD444 、TSG-65 、更にHAと結合しECMの安定化を助ける低分子物質の変化を伴っている。これらの研究から、HAはアテローム性動脈硬化の進展において、平滑筋細胞の増殖と移動に影響を与えることが示唆された。
実験動物で正常血管をバルーンカテーテルで傷つけることが、動脈硬化を起こす空間的、時間的パターンの研究方法となっているが、同様な手技がヒト患者のアテローム性動脈硬化病変の治療に血管外科医によって使われているのは皮肉である。手術操作はバルーンカテーテル用具を用いてほとんど閉塞した血管のアテローム班を割ったり、裂いたりして再開通を行うもので、これは「経皮経管冠動脈形成術」として知られている(Fig.1)。この処置により狭窄していた血管腔はうまく拡大するが、6-12ヵ月後にしばしば再狭窄を起こし、再度の手術が必要になる。この再閉塞の過程は再狭窄と呼ばれ、平滑筋細胞の移動と増殖の増大による新生内膜の成長やECMの蓄積および、“再構築”(これは復元および/またはれん縮によって生ずる血管収縮を説明する言葉として使われている)の組み合わせによって起こると信じられている。このプロセスにより動脈の内腔は狭窄する(Fig.1)。このような病変の存在は10年以上前から認識されていたが、再狭窄を抑制するために立てられたいくつかの治療はほとんど成功しなかった。これらの失敗は部分的には、これらの病巣形成にひそむ生物学的メカニズムの理解が不十分であったことは明白である。
ヒトの再狭窄病変の綿密な検討から、沢山のランダムに分布した平滑筋細胞を有する病変部にはHAが豊富であることが分った(Fig.4)。このHAに富んだ部位にはバーシカンのようなHA結合分子も含まれるが、コラーゲンのような他のECM分子は見られない。6 しかしながらバーシカンとHAに富んだ部分の隣りにはコラーゲン・リッチ領域がある。これらの変化を起こす連鎖のメカニズムを確定することはむずかしいが、実験動物の研究からコラーゲンに富んだ領域は古い病変部または再構成が既に起った病変部位であり、HA・リッチの再狭窄病変部位は新しく形成された内膜であると推測したいところである。この再構成は創傷治ゆに見られるHAリッチマトリックスからコラーゲンリッチマトリックスへの置換と同様であるかも知れない。どんな過程であれ、病変部の発生は組織容積の変化が見られ、これは部分的にはECMの性質に影響される。
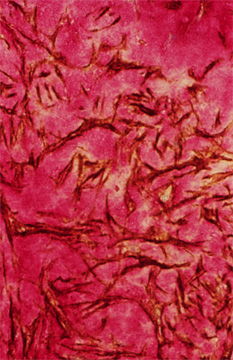
Fig. 4
ヒアルロン酸(赤)および平滑筋細胞のアクチン(茶)に対するプローブで染色したヒトの動脈の再狭窄部位。
この病変部位の平滑筋細胞を囲んでいるヒアルロン酸の「池」に注目。
HAに富んだ組織は水を保持し膨潤する。再狭窄病変部の急速な膨張は、HAとその会合した分子によってつくり出された浮腫性変化に大きく依存する。HAが失われたり分解したりすると、水が排除され組織が縮少して、動脈周囲が縮まる。こうしてこの転換は、水を含んだECMが瘢痕化し、これが動脈壁を縮めて引きしめ、その結果血管内腔を縮小させるという過程をもたらす。HAで飽和したコラーゲンゲルは平滑筋細胞があるとより強く縮少することが示された。(脚注:Bowman Gray School of Medicine, R. Gearyの私信)このような結果は再狭窄における組織再構成の時、HAが血管の縮少に影響を及ぼすことを意味する。再狭窄病変は、治ゆしない創傷であるのか、治ゆの別の相にある創傷なのかはまだ不明である。
HAは病変部を形成する他の細胞の基質としても働くようだ。例えば単球やリンパ球は初期の炎症反応の一つとして血漿から病変部へ移行する。これらの細胞はHAに対するレセプターをもっており、HA投与によってレセプターがブロックされると、進行中の病変部への蓄積が妨げられる。7 これらの炎症性の細胞の存在はアテローム性動脈硬化病変部の重症度に強く影響すると考えられているので、HAまたはその結合分子は病変の進行を阻止することをねらいとした有用な分子であることが示唆される。
HAは動脈壁に内在する内皮細胞、平滑筋細胞および外膜の線維芽細胞により合成される。他の型の細胞におけるように、動脈の平滑筋細胞の分割と移動が促進されると、HA合成は増強される。これらの発見に加えて、傷ついたり再狭窄した動脈では、HAの“池”が分裂し、移動している平滑筋細胞を取り囲んでいるという観察から、HAは平滑筋細胞の増殖と移動に重要な役割を果していることが示唆される。実際培養中の、分裂し移動している平滑筋細胞の顕微鏡下におけるビデオ撮影から、細胞の周りのHAリッチ外被は細胞が移動し増殖するに従い膨張することが分った8 (Fig.5)。
この細胞周囲マトリックスは、平滑筋細胞表面のレセプターと共にHAとその結合分子により形成される。これまでに同定された二つのHA結合レセプターは、CD44 4 とRHAMM(Receptor for Hyaluronan-Mediated Motility)である。9 競合するHAオリゴ糖、またはレセプターをブロックする抗体の使用により、HAがこれらのレセプターに結合するのを妨害すると、細胞周囲外被の形成と動脈平滑筋細胞の増殖と移動が阻害される。 8,9
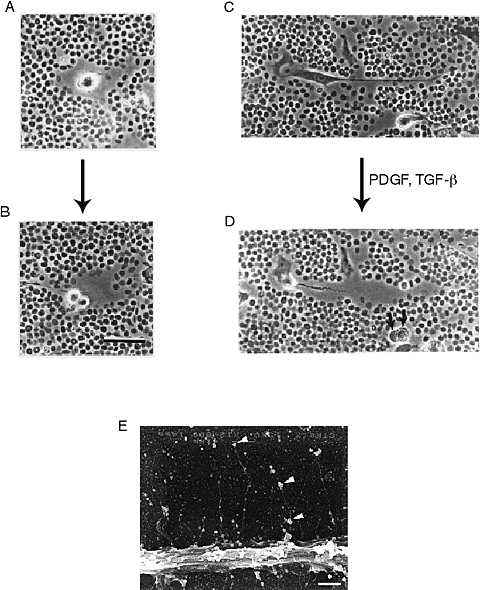
Fig. 5
粒子排除アッセイにより観察した分裂し(A, B)、移動しつつある(C,D)ヒト平滑筋細胞のビデオ撮影による画像。このアッセイでは、ヒアルロン酸に富んだコートの輪郭を描き出すため固定赤血球を用いている。このコートはこれらの細胞が分裂や移動している時に顕著であることに注目。 A,B,C,D画像中の横棒は20ミクロン。 E:カバーグラス上で培養したヒト動脈平滑筋細胞にルテニウムレッド染色を施した走査型電顕像。ルテニウムレッド陽性顆粒(矢印)に結合して、細胞表面から伸展しているヒアルロン酸(と推定される像)を示している。 横棒は10ミクロン8
平滑筋細胞の増殖と移動を促進するPDGFのようなサイトカインは、細胞周囲外被の形成とその後のバーシカンとHAの相互作用を促進する(Fig.6)。これらのコンプレックスは細胞接着を不安定にし、細胞の形状変化を促すと考えられている。細胞が移動し分割する能力を制御するのは、接着しようとする力とそれを阻止しようとする力の間のバランスによることは疑いのないところである。
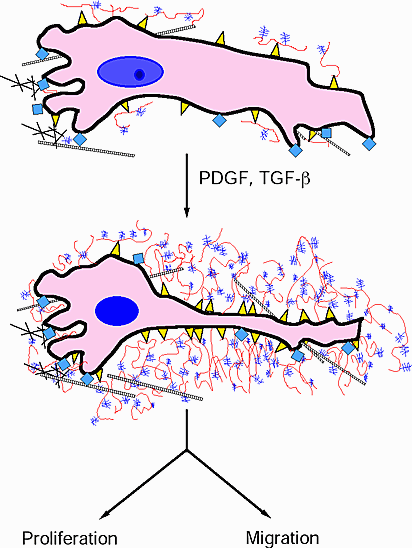
Fig. 6
図はヒアルロナン/バーシカン会合体に富んだ細胞コートの形成の想像図で、細胞増殖および/または移動を発現するためにPDGFまたはTGF-beta処理を施している。 ヒアルロナンは赤で、バーシカンは紫で、ヒアルロナンレセプターは黄で、インテグリンは青で、コラーゲンは網目で表わしている。
さらに、これらの相互作用は細胞の生存に決定的なものであり、細胞が生きるか死ぬかを決定するようだ!アポトーシスによる死が誘導された細胞はそのCD44レセプターを捨て去る。それに加えて、あるタイプの細胞では、CD44を抗体でブロックするとアポトーシスが誘導されることから、CD44とHAの、細胞の生存能力維持における役割が示された。
内皮細胞もまたHAを合成し、平滑筋細胞におけるのと同様にHAがこのタイプの細胞の増殖と移動に影響を与えることが分った。HAの分解物(すなわち短いオリゴ糖)は内皮細胞の増殖と移動の強い促進剤である。さらに、HAの断片はin vivoで新しい血管の形成を促進する(angiogenesis)。10 ここにはHAのレセプターが関与しているように思われる。例えば、CD44に対する抗体でブロックするとオリゴ糖による新しい血管の成長誘導が阻害される。HAの断片はまた、内皮細胞脈管形成表現型のECM分子であるIおよびVIII型コラーゲンの合成を誘導する。HA断片が内皮細胞へ結合すると、細胞増殖と移動に関与したいくつかの中間的応答遺伝子の一時的な発現が開始されることから、HAの分解産物により特異的な細胞シグナル伝達が誘導されることが示唆された。この点について、HAオリゴ糖は平滑筋細胞では増殖と移動を阻害するのに、内皮細胞ではなぜ促進するのかは明らかでない。これらの差の理由を解明することは、血管の細胞生物学におけるHAの重要性についてのわれわれの理解を大変深めることになるだろう。
HAは重要で、なお研究の十分にされていない、血管細胞表現型の細胞外マトリックス(ECM)分子エフェクターである。アテローム性動脈硬化症と再狭窄におけるHAの重要性は明らかである。しかしながらHAが、血管細胞の生物学的性質と、これらの疾病に関与している事象を、どのようなメカニズムで制御しているかはまだ残された問題である。さらに、西欧では他のどんな疾病よりも患者数の多い、動脈硬化と再狭窄の発生を阻止する戦略として、HAと/またはその関連分子を標的とすることに注目しなければならない。