
氏名: Bryan P. Toole
Bryan P. Toole はオーストラリアのMelbourne大学で理学士を、Monash大学で生化学の Ph.D.を取得した。Dennis Lowther教授の研究室における彼の Ph.D.の研究では、現在はデコリンと命名されているデルマタン硫酸プロテオグリカンを単離精製し、生理的条件下でデコリンとコラーゲンが相互作用することを最初に証明した。1968年、博士はボストンのMassachusetts General HospitalとHarvard Medical SchoolのJerome Gross博士の研究室でポスドクとしての研究に取り組んだ。ここで博士は、再生と胚の発生過程でヒアルロン酸が、運動性増殖細胞を取り囲み、相互作用することを示した。1972年、博士はHarvard大学に自分の研究室を創設して胚発育とガンにおけるヒアルロン酸と細胞の相互作用、およびヒアルロン酸レセプターの生化学的性質の究明に取り組んだ。1980年、ボストンのTufts大学Health Sciences Campusの解剖学と細胞生物学の教授として着任し、1985-1992年の間、学部長を務めた。現在、博士は同大学Health Sciences Campusの組織学の教授(George Bates Professor)であり、細胞、分子および応用生物学専攻課程の責任者でもある。博士の研究室は、形態形成とガンにおけるヒアルロン酸と細胞の相互作用、さらにガン転移時の、マトリックスメタロプロテイナーゼの制御における腫瘍と基質細胞相互作用の役割に研究の焦点をあてている。
ヒアルロン酸(以下HAと略記する)は、ほとんどすべてにおいて変わっている。にもかかわらず、その並外れた特質は、非常に単純な化学構造に由来している。HAは一律にくり返す直鎖状のグリコサミノグリカン(以下GAGと略記する)で、グルクロン酸と N-アセチルグルコサミンから成る二糖が2,000-25,000連なったものである:
[β-1,4-GlcUA-β-1,3-GlcNAc]n
化学的には明らかに単純であるにもかかわらず、HAはその合成のメカニズム、サイズおよび物理学的性質において、他のGAGとは異なっている。HAのこのような性質は、本シリーズのこれまでの総説に既に述べられている。今回のテーマは、HA生物学におけるもう一つのユニークで重要な側面、つまり細胞挙動に対する影響について扱う。
HAが発見されてから数十年の間、その主な機能は、組織に生物物理的性質および恒常性維持を賦与することにあると考えられてきた。しかしながら、1970年代に胚の発育、組織再生および腫瘍発生のような動的細胞システムについての研究がなされたことから、今日われわれが理解しているようにHAが細胞挙動にも重要な役割を持つことが知られるようになった1,2 。これら初期の研究より、細胞はHAに富んだ細胞外マトリックス内で分裂し移動すること、またマトリックスにおけるHAの濃度と構成が劇的に変わると、組織や器官の分化を伴う細胞の変化を併発することが発見された。
細胞がHAリッチマトリックスに囲まれていて起こる動的な現象の顕著な例としては、以下が挙げられる。
・間充織細胞が初期角膜基質に侵入して成熟角膜を形成する
・神経冠細胞が神経管から移動して抹消神経系の神経節を形成する
・硬節細胞が脊索に接近および包囲し、脊椎を形成する
・心臓弁の形成過程において枕細胞が心内膜から心筋層へ移動する
・脳の発育過程において、ニューロンとグリアの前駆体が移動し増殖する
・胚の四肢の発育、サンショウウオの四肢再生、腱の再生および胎児の創傷治癒の過程で、間充織細胞は分割し、移動する
・ 腫瘍細胞の成長と浸潤1,2
これらの系では細胞の増殖と移動により、はっきりした組織や器官への分化に先がけて、通常は適当な数と位置での細胞の集合がまず導かれる。形態形成のこの段階で、細胞周囲のHAの濃度は低下し、その後に分化が起こるために必要不可欠な細胞間相互作用の開始を促すことができるように再配置される。その例としては、胚の四肢における筋肉や軟骨の形成前に起こる細胞の凝縮などが挙げられる(第6章)。
HAが細胞の移動を促進する一つの手段は、細胞周囲に水和した経路を創出し、細胞性または繊維性バリアーを細胞が貫通しやすくすることである。これはまた、有糸分裂の間に細胞の球状化も促進するようだ。引き続いて起こるHA濃度の低下により、細胞外マトリックスの容積が減少し、分化に先立って細胞がより密着するようになる。しかしながら、これらの物理化学的効果に加えて、上述した研究は、胚および腫瘍細胞表面上のHAレセプターの存在の発見と、HAが細胞挙動に直接的で絶大な影響を及ぼすことを断定的に証明していくことになる、現代的研究の急増へとつながった1-3。
前述した胚の発育と組織修復に関する初期の研究から、HAは細胞挙動に直接的に影響を与えることが強く示唆された。その結果、細胞表面にHAレセプターの存在が探索され、発見されたのである。その後の研究により、細胞表面上の二種類のHAレセプター、CD44 とRHAMM2-5 の分子的特性の完全解明につながった。これについては以下に簡単に述べるa。
a CD44 については Cheryl Knudson、RHAMM2-5については Eva Turley の総説が、今後このシリーズに登場の予定。
CD44 は広く分布している細胞表面糖タンパク質で、単一の遺伝子によりコードされているが、選択的スプライシングの結果、多数のアイソフォームとして発現される。最も単純で、最も広く分布しているのが標準アイソフォームと呼ばれCD44sである(造血系アイソフォームまたは CD44H とも呼ばれる)。CD44sは膜貫通、細胞質および細胞外領域を含み、これは CD44 の全ての膜結合型アイソフォームに共通している (Fig. 1)。
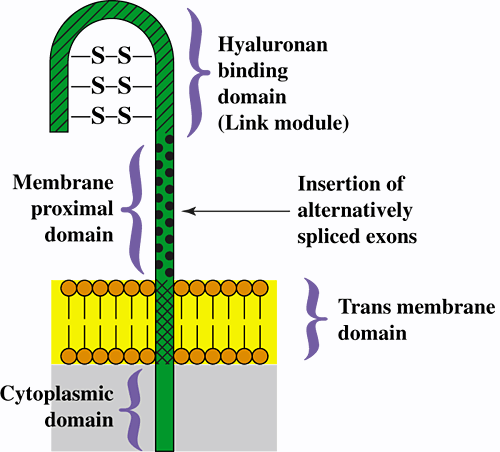
Fig. 1 基本型 CD44のタンパク質領域をあらわしたCD44の構造モデル。
矢印で示した位置には、約10個の交互にスプライスされた変種エキソンの多様な組み合わせ産物が挿入されており、無数のCD44異型を生み出している。CD44の細胞外領域は高度かつ多様にグリコシル化され、細胞質領域のセリン残基の幾つかはリン酸化の受容体にもなる。
CD44sの細胞外領域は二つの主な領域を含んでいる;
(1) N末端領域は「リンクモジュール」であり、多くの HA 結合タンパク質に見られるものとよく似ている。この領域はHAの結合サイトとして推定されているが、結合には分子の他の領域から数多くのプラスおよびマイナスな影響も受ける。例えばグリコシル化、選択的スプライシング、二量体化、細胞膜での集合、そして細胞質領域の一貫性などである4。
(2) 膜に隣接する領域は、HA結合領域と膜貫通領域の間にある。ほぼ10個のエキソン産物の種々の組み合わせは、膜に近い領域内 (Fig. 1) の一箇所にスプライシングされ、それにより異なる生理的性質と、HAに対して様々な結合力を示す無数のCD44異性体が生じる。
選択的スプライシングはまた、RHAMMの数種の異性体を発生させ、これらは細胞内型と細胞表面型の異性体を含んでいる。しかしながら、RHAMM は「リンクモジュール」領域をもたないが、HA結合の可能性を持つモチーフ、すなわち直鎖配列 B(X7)B を含む二つの領域を有している。ここでBは塩基性アミノ酸、Xは非酸性アミノ酸を示す。この配列はほとんどのHA結合タンパク質に存在し、少なくとも部分的にはそのHA結合能力を担うものとされている。
細胞表面のHAとCD44またはRHAMMとの相互作用は、HAの細胞に対する多くの効果を取り次いでいるので、その効果が細胞内シグナルに変換される生化学的メカニズムについて、現在いくつかの研究グループにより精力的に研究がなされている。これまで多くの有望な知見が発表されているが、これらの相互作用が惹起するシグナル伝達経路、細胞骨格の再配列については、現時点では統一の見解は出されていない。
数種の細胞は、高度に水和したHA依存性の細胞周囲マトリックス、または「コート(被膜)」をもっている。培養下では、これらのマトリックスを従来の光学顕微鏡で見ることは困難である。しかしながら、被膜は粒子を排除することにより間接的ではあるが、簡単に視覚化でき、その厚さは通常5-10ミクロンである(Fig. 2)。
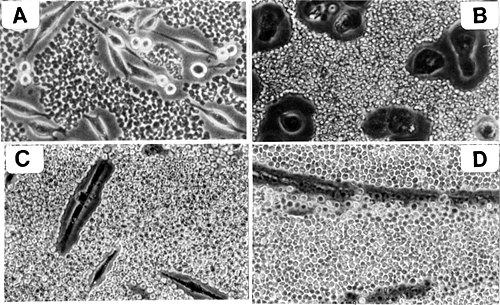
Fig. 2 HA依存性の細胞周囲マトリックス。
ラットの線維肉腫細胞を取り巻く巨大な細胞周囲マトリックス(A)、鶏胚軟骨細胞(B)および鶏胚筋原細胞(C)。マトリックスは粒子(固定された赤血球)排除により可視化されている。これらの細胞をHAに特異的なヒアルロニダーゼ゙で処理するとマトリックスは除去される(図省略)。写真CとDは筋原細胞(C)が融合して筋管を形成する際(D)、筋肉発育期に生じる細胞周囲マトリックスの消失を示している。
これらの細胞周囲マトリックスでは、数多くの細胞が活性を発現し、また様々な状況下で細胞活動に影響を及ぼしている。例えば組織の形成または修復において、このようなマトリックスは高度に水和した流動性の細胞周囲の環境を提供する。この環境の中であれば、完全に分化した組織で通常見られる、高度に構造化された繊維性マトリックスの妨害を受けることなく、他のマトリックス成分の集合と、成長因子、分化因子の提供が可能となる。したがって、筋肉と軟骨の前駆細胞、胚のグリア細胞、神経冠細胞、さらにはいくつかの胚の上皮細胞までをも含む、様々な胚間充織細胞には顕著な細胞周囲マトリックスが見られる。時として、例えば軟骨などでは、細胞周囲マトリックスは細胞を保護し、分化組織の固有性に寄与する独特な構造成分となっている。
細胞周囲マトリックスの機能と組み立てについては、軟骨細胞を中心に精力的に研究され、三つの特徴に依存していることが示された6,7。
(1) その整合性はHAに依存している。したがって細胞周囲マトリックスをもった細胞を、HA特異的なヒアルロニダーゼで処理すると、その構造は破壊される。
(2) 軟骨細胞の細胞周囲マトリックスの組み立てと密度は、HAとプロテオグリカン(以下PGと略記する)のアグリカンとの特異的相互作用に依存する。
(3) HAは細胞表面につながれている必要がある。
異なる細胞型へのHAのつなぎ方は二つの独立したメカニズムによって起こる。すなわち、細胞表面(Fig. 3A)の特異的HAレセプター(例えば、CD44)への結合によるか、または細胞膜の細胞質面にあるHA合成酵素または関連タンパク質と、合成された「新生」HAとの細胞膜を貫通した相互作用である(Fig. 3B)。軟骨細胞の場合、HAはCD44との相互作用により細胞膜表面につなぎとめられている。
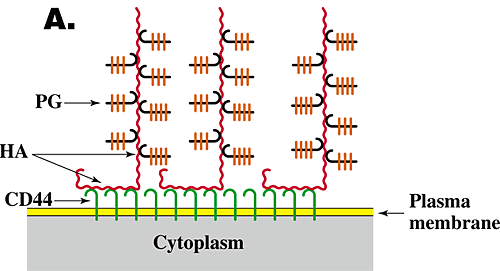
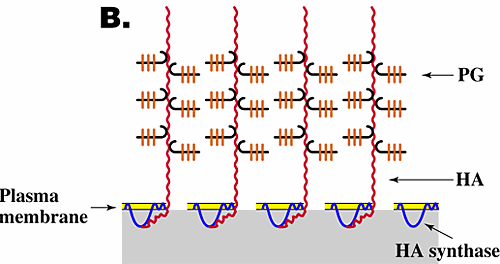
Fig. 3 HA依存性の細胞周囲マトリックス構造モデル。
本文で論じているように、被膜の形成には通常HAが細胞表面に繋がっており、PGがHAに結合していることが必須である。HAの細胞表面への繋留は、細胞表面のCD44(A)かHA合成酵素(B)の膜貫通部分との相互作用によって生じる。
細胞周囲マトリックスを持つ多くの胚細胞において、HAはHA合成酵素に結合していることにより、繋ぎ止められていると考えられている。実際に、細胞周囲マトリックスを欠く細胞に対しては、HA合成酵素の遺伝子導入をするだけで、マトリックスの形成を誘導するのに充分である場合もある。しかしながら、合成酵素につながれたHAがPGへの結合もなく、細胞周囲マトリックスを生みだしているかどうかは不明である。理論的には、十分に高密度のHA分子が細胞表面に繋留されていれば、それらは細胞表面から突き出た、拡張した配列または「ブラシ」を形成し、自己相互作用により連続した網目構造を成すはずである。そうすればこの配列は、そのようなマトリックスを形成するのに充分であろう。しかしながらPGを加えると、マトリックスの密度が高まるために、その安定性の増大につながると考えられるため、細胞周囲マトリックス形成の促進を支持することは明白である7。インターα−トリプシンインヒビターや TSG-6(tumor necrosis-stimulated gene 6)のような他のHA結合タンパク質が含まれると、この場合もまたHA鎖を架橋することにより細胞周囲マトリックスを安定化させるであろう。
胚器官の形態形成時における、再生と治癒の間、または腫瘍発生のような病理的過程で、移動し増殖する細胞を囲むマトリックスは、HA濃度が高まり、前章で述べた細胞周囲マトリックスに似てくる。これらの細胞事象にHAはどのように影響を与えるであろうか? in vitroとin vivoでなされた多くの研究により、現在のところわずかではあるが、この質問に光明がさしてきた。
HAリッチマトリックスが細胞増殖を促進する重要な方法は、有糸分裂の際、細胞の球状化を容易にする、水和した細胞周囲層を提供することである。HA合成酵素活性は細胞周期により変動し、有糸分裂時にピークとなることが示された。こうして、有糸分裂時に細胞表面にHAが押し出されると、水和した微小環境が創り出され、これにより分裂した細胞の分離し、球状化を促進する。この考えを支持するものとして、HA合成を阻害すると、細胞が球状化し分離する直前に、有糸分裂での細胞周期停止へ導かれることが示された8。
第2章で述べたように、HAリッチマトリックスは水和した経路を創り、侵入細胞の貫通に対する細胞性あるいは繊維性のバリアーを分離する。それに加えて、細胞周囲のHAへのPGの結合度合いの変動によるこれらマトリックスの密度の調整は、移動の停止を制御する可能性がある。たとえば、硫酸化PGはin vitroおよびin vivoにおいて、神経冠細胞の移動と神経突起成長に対するバリアーとして働く。神経冠細胞では、この阻害はPGと細胞表面HAとの相互作用に依存しており、これが細胞周囲マトリックスの密度を高め、これによりマトリックスは細胞移動を誘導から阻害する方向に転換する6。
以前に述べたように、細胞周囲HAは、増殖と移動により細胞が正しい数で的確な位置に集合した後で、細胞表面との相互作用の変化に伴い、その濃度がしばしば低下する。このような変化は、ときに分化に必要な細胞間相互作用の惹起を積極的に促す。HAに誘導された細胞の凝集が最初に観察されたのは、少量のHAをリンパ腫細胞またはマクロファージに添加したところ、これらの細胞の凝集がおこったこと実験や、内在性のHAを形質転換した線維芽細胞から除去するか、これらの細胞に高濃度の外来性HAを加えると、その凝集が阻害されるという実験であった。これらの発見から、細胞表面のHA(添加するのが内在性または外来性を問わず)は、隣接細胞のレセプターとの相互作用により、細胞同士を架橋すると理解された。したがって、このHAを取り除くと凝集はブロックされるだろう。過剰のHAを添加すると、全てのレセプターがHAにより占有され、やはり架橋をブロックするであろう(Fig. 4)1,2。HAに誘導された細胞凝集は、幾つかの胚組織(第6章とFig. 5参照)の分化において初期の細胞凝縮の形成をもたらすのである。
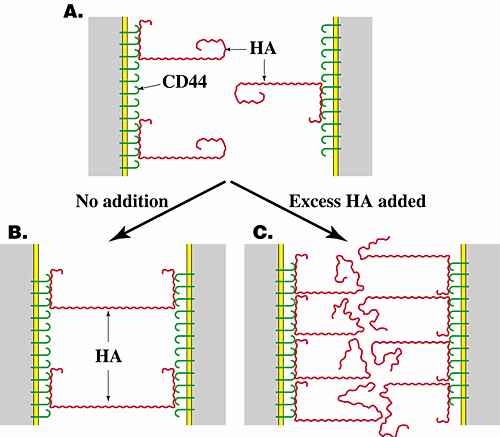
Fig. 4 HA媒介による細胞凝集。
HAはCD44のようなHA受容体を持つ細胞を架橋し、細胞凝集を引き起こす(B)。もし細胞をヒアルロニダーゼ(図省略)または過剰のHA(C)で処理すると凝集は阻害される。
適切な水和環境の提供や、細胞を架橋するのに加えて、細胞表面レセプターとHAの相互作用は、細胞の移動、増殖または分化を促進するシグナル伝達経路を創始する。何人かの研究者は、in vitroにおける細胞移動はHAの存在下で促進されること、三次元コラーゲンゲル中への侵入はHA合成に依存すること、そして細胞移動の阻害は、HAそのものの分解もしくはいずれの(CD44またはRHAMM)レセプターへのHAの結合をブロックすることの結果として起きることを証明した。HAとRHAMMとの相互作用により、接着点のキー成分であるp125FAKを含むいくつかのタンパク質のチロシンリン酸化が促進され、その結果接着点の代謝と細胞移動の促進がもたらされる。HAと細胞表面のCD44との相互作用もまた、グリオーマやメラノーマ細胞といったいくつかの腫瘍細胞において、細胞移動を促進する。こうしてHAとどちらかのレセプターとの相互作用は細胞移動を促進することができるが、その相対的重要度は細胞の型または他の生理的要因に依存するように見える。同様にHAとCD44またはRHAMMとの相互作用は、種々のタイプの細胞での細胞増殖に関するシグナル伝達経路を刺激する。それにもかかわらずこれらの推定経路の詳細は、細胞増殖についても移動についても明確になったとはいえない。
胚の四肢の発育についてなされたいくつかの研究は、細胞周囲のHA濃度と組織化の調整が、in vivoでの分化に至る、いくつかの事象に影響するという実例を示した(Fig. 5)2,9 。初めに、四肢の発育の各段階における、細胞を分離するHAリッチマトリックスの容積は、分化の進行段階と著しく相関する。初期の四肢中胚葉細胞は、in vivoにおいて広いHAリッチマトリックスに囲まれて分離されており(Fig. 5A)、培養下では多量のHA依存の細胞周囲マトリックスを示している。この段階の細胞周囲HAは、レセプターを介さずに細胞表面に結合しており、HA合成酵素との膜を貫通した相互作用で細胞につながれているように見える(Fig. 3B)。 細胞周囲マトリックスは初期の中胚葉細胞の分離を保っており、これは表面結合ポリマーの予測した行動と矛盾しない。すなわちその絶え間ない動きにより、並べられた表面上のポリマー分子は組み合わない7 。前節で述べたように、この水和した細胞周囲マトリックスは、四肢組織の初期の間充織前駆体の増殖と移動を促進するであろう。このプロセスは、筋肉の分化のケースで直接的に証明された。この場合、筋原細胞をHAに常時さらしておくと、増殖と移動は支持されるが、分化は阻害されることが示された。
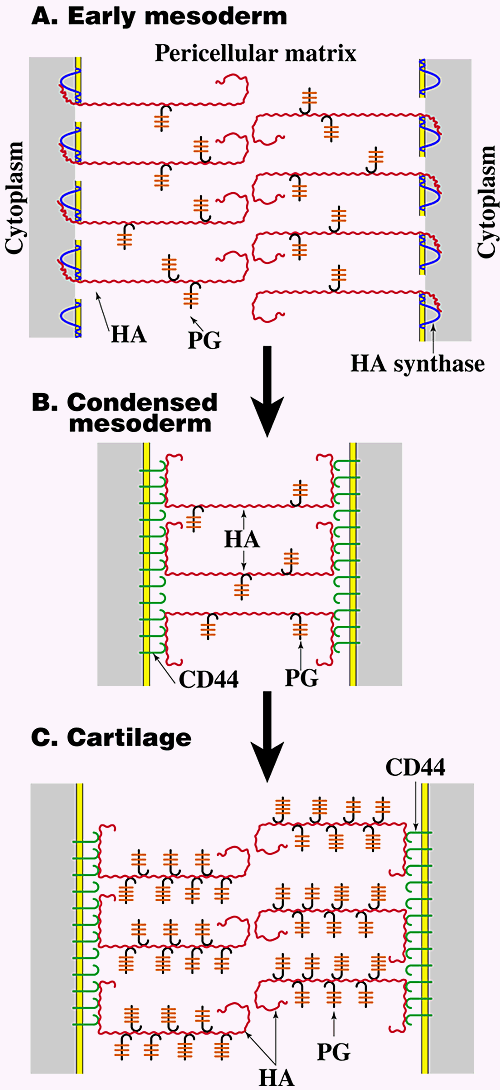
Fig. 5 胚四肢発育中のHA−細胞相互作用。
本文中で論じているように、早期中胚葉(A)は大きな細胞周囲マトリックスに囲まれているが、そのHAは細胞膜を貫通するHA合成酵素との相互作用によって細胞表面上に繋留されていると考えられる (Fig. 3B参照)。この段階では、細胞周囲マトリックスのPGは主としてバーシカンであり、比較的低濃度で存在する。軟骨や筋の分化に先立つ中胚葉凝縮の際(B)に、ライソゾームのヒアルロニダーゼレベルが上がり、細胞間HA濃度は著しく低下して、HAレセプター(主としてCD44)が中胚葉細胞表面に現れて、HAがそれらと多価の相互作用を通じて、凝縮した中胚葉の細胞同士を架橋する(Fig. 4B参照)。軟骨分化(C)の際は、HAはCD44に結合したままであるが、この時は主としてアグリカンからなるPG濃度が劇的に上昇し、大きな細胞周囲マトリックスが Fig. 3Aに示したように再形成される。
前節で述べた四肢発育の初期段階の後で、中胚葉は凝縮する。すなわち、将来軟骨と筋肉に分化する部位において、細胞間マトリックスの容積が減少する。このことは、培養下の中胚葉細胞が、水和した細胞周囲マトリックスを形成する能力を失う時期と一致している。この時、中胚葉細胞のライソゾームのヒアルロニダーゼのレベルが上昇し、細胞間マトリックスから多くのHAが除去される。細胞間の容積はこのようにして減少する。しかしながら、一部のHAはレセプターとの相互作用を通して引き続き細胞表面に保持され、多価相互作用を通じて凝縮した中胚葉の中で架橋が成立している(Fig. 5B)。 架橋は前節で述べたのと類似した方法で起こっている(Fig. 4)。同様の事象が、例えば皮膚や歯のような他の発育中の組織において、中胚葉凝縮の初期段階に起きている。
凝縮した四肢中胚葉から軟骨へのさらなる分化(Fig. 5C) は、in vivoでの広範囲なマトリックスの形成と、培養下においても同様にHA依存性細胞周囲マトリックス形成の能力有している。しかし、HAはCD44との相互作用により細胞表面に繋がれており (Fig. 3A)、PG濃度は初期の中胚葉細胞を取り囲んでいたマトリックスよりもずっと高い。こうして分化した軟骨細胞の細胞周囲マトリックスは、形態形成上よりもその構造上の役割を反映して、初期の中胚葉細胞よりも密度が高くなるであろう。
軟骨から長管骨への分化の際、肥大化軟骨細胞を囲う小窩はHA濃度が非常に高く、骨の成長に伴い、HAによってもたらされる膨張圧力によってこの小窩の拡大が起こり、侵食領域では、HAはCD44を介したエンドサイトーシスにより除去される10。HAのCD44を介した吸収は、例えば真皮や肺のような他のいくつかの組織の分化においても、重要なステップとなっている。
筋肉の分化については、単核の筋原細胞も、in vivoではHAリッチマトリックスから切り離された状態で培養すると、大きな細胞周囲マトリックスを作る。そして凝縮、融合して筋管を作る過程で、これら細胞周囲の被膜は失われ (Fig. 2C, D)、その後に続く、分化に必要な、密接な細胞の相互作用を可能にする。
多くの悪性固形腫瘍は、高レベルのHAを含んでいるが、この高レベルでのHA発現は、数種のヒト癌腫では分化の低さと生存率の低下と相関している。腫瘍における高含量のHAは、腫瘍細胞そのもの、または腫瘍細胞とそれを取り囲む間質細胞との間の相互作用によって、間質細胞により生産増加が誘導されることによりもたらされるのであろう11。
腫瘍の成長と転移には、HAとHAレセプターが関係していると、数種の腫瘍についての実験で証拠が得られている3,12-14。しかし、この相互作用が、腫瘍細胞の挙動に影響するメカニズムは未だ明確になっておらず、現在非常に活発な研究がおこなわれている。詳細は不明だが、この相互作用をうまく操作することにより、数種の腫瘍で成長、転移が強く阻害され得る。抗CD44抗体、水溶性CD44、水溶性RHAMM、ヒアルロニダーゼそしてHAのオリゴマーは全て、モデル動物の腫瘍において成長と転移を効果的に阻害した。
例:
(1)HAオリゴマーを投与することにより、HAポリマーとCD44、RHAMMとの相互作用に中和的に働いたため、in vivoにおいてマウスメラノーマの成長を抑制した12。
(2)マウス線維肉腫細胞を、体外で可溶性RHAMMに接触させて、体内に戻すと、腫瘍の成長と転移が抑制された13。
(3)マウス乳ガン細胞に可溶性CD44の遺伝子を導入すると、腫瘍細胞がアポトーシスを起こしやすくなり、肺転移における小結節の形成を完全に阻害した;この阻害に関しては、HAが結合しない変異型可溶性CD44を遺伝子導入に使った場合は起こらなかった14。
HAは細胞外マトリックスだけでなく、細胞周囲環境の物理的、化学的性質においても、中心的役割を演じていることは、明らかである。HAの、ネットワークを形成し、粘弾性と電荷を有する性質は、多くの組織の生物力学的性質と恒常性の維持に重要である。HAとタンパク質、PGとの特異的相互作用は、細胞外マトリックスの構造的性質にとって固有のものである。そしてHAは細胞周囲、細胞表面の重要な成分で、他の巨大分子との相互作用を通して、多くの形態形成、再生および病理的プロセスにおいて、細胞の挙動の制御に深く関わっている。
これらの細胞領域における研究は急速に進歩している。その中でも特に興味深いものを以下に記す。
(1) 細胞が動的過程にある時、HA合成酵素が部分的に関わるとされる事象、つまり細胞周囲環境の特性を調整する事象での役割、同様、酵素活性と細胞内シグナル伝達経路の間の調整時に関する研究
(2) 種々の細胞事象における、HAポリマーサイズの制御とその重要性に関する研究
(3) 細胞外と細胞内の間のシグナル伝達において、CD44やRHAMMのような細胞表面HAレセプターが関与すること、そして細胞挙動におけるこれらの信号の役割に関する研究
(4) 病気における治療法としての、HAと細胞の相互作用のうまい利用法についての研究