
氏名:Andrew P. Spicer
Andrew Spicerはイギリスとアメリカの両国で育った。彼は常に生物学に対する情熱を持ち続け、その範囲は昆虫の収集、飼育および鳥類学から、彼が研究上の興味を注いでいる糖鎖生物学とマウス遺伝学にまで及んでいる。彼は1993年王立ガン研究基金とUniversity College in LondonからPh.D.を授与された。その時の博士論文における研究は、マウスにおける上皮性ムチンであるMuc1に焦点をあてたものであった。1992年に博士は米国に渡り、アリゾナ州ScottsdaleのMayo Clinicで、彼のPh.D.指導教官であったDr. Sandra Gendlerが研究室を立ち上げるのを手伝った。1994年にはそこのDr.John McDonaldの研究室でポストドクとなった。彼のこのポストドクでの研究からヒアルロン酸生物学における大きな発見が導かれた。——それは脊椎動物のヒアルロン酸合成酵素を遺伝情報としてもつ遺伝子ファミリーの同定であった。1997年8月博士はカリフォルニア大学のRowe Program in Geneticsおよび生物化学科内に助教授として独立した研究室を発足させた。彼の研究室は、胎児の発育と成人組織におけるヒアルロン酸および他のグリコサミノグリカンの役割を研究するモデルとして、マウスを用いて脊椎動物のヒアルロン酸合成酵素の研究を続けている。

氏名:John A. McDonald
John McDonaldはSouth Florida大学に学んだが、ここでは故Dr. Jerome O.Krivanekが動物学主任教授として影響力を及ぼしていた。McDonald博士は1970年生化学におけるPh.D.をRice大学から、1973年にはM.D.をDuke大学医学部から授与された。マサチューセッツ州ボストンのthe Peter Bent Brigham Hospitalとメリーランド州ベセスダのNIHで臨床訓練の後、博士は1979年ミズーリ州セントルイスのWashington University Medical Schoolで教授陣に加わった。1985年から1991年まで博士は医学と細胞生物学の教授で、Washington大学医療センターBarnes Hospitalの呼吸器および重症医療科の部長を勤め、臨床訓練プログラムと研究業績のめざましい展開を指揮した。1991年に博士はアリゾナ州Scotts daleのMayo Clinicに研究所長として就任し、基礎と臨床研究を結集させて大きく発展させた。
McDonald博士の最も主要な研究室は、細胞外マトリックスの構成における細胞表面のインテグリンレセプターの重要な役割を初めて解明し、フィブロネクチンの詳しい生物学的マップを明確にした。博士はまた、ヒト肺疾患における構造的再編と、肺の成長および心臓病におけるマトリックスレセプターの役割を理解する上で貢献した。近年になり博士の研究室は、この総説の対象である真核生物のヒアルロン酸合成酵素ファミリーの研究を開始した。
ヒアルロン酸(以下HAと略記)は、N-アセチル-D-グルコサミン(GlcNAc)とD-グルクロン酸(GlcA)からなる、二糖のくり返したポリマーである。ほとんどのグリコサミノグリカンは細胞内のゴルジネットワークで合成され、タンパク質に結合している。これに対し、HAは細胞膜で作られどんなコアタンパク質とも結合していない(レビューはRef. 1,2参照)。生化学および細胞生物学的研究により、HAは細胞膜の内側の面で合成されることがわかった。成長しているポリマーは、合成されるに伴い細胞の外側へ押し出される(Fig.1)。3 細胞の外側で、HAはヒアルロン酸結合タンパク質(アグリカンやバーシカンのようなレクチカンファミリーを含む)やインター-α-トリプシンインヒビターとコンプレックスを作って、細胞を取り巻く外被を形成する。この外被は組織培養液に、固定した赤血球細胞のような微粒子を添加することにより、組織培養で成長している哺乳動物細胞の周りに見ることができる。この微粒子が細胞培養ディッシュの底に沈むと、大きなサイズで負電荷をもつHA外被により細胞膜から排除される(Fig.1)。細胞を取り巻くHA外被の組み立てと存在が、血管平滑筋細胞のようなある種の細胞の移動および/または増殖に必要であろうということが示されてきた。a
a Tom Wightによって解説される予定の将来のトピックス。
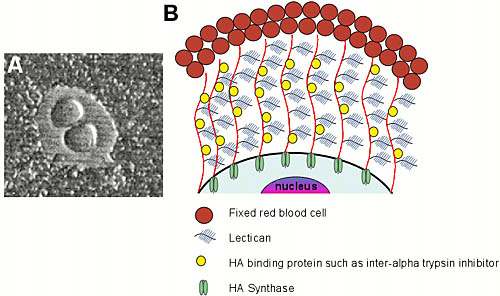
Fig. 1 真核生物細胞ではHAの合成は細胞膜でなされる
(a) 微粒子排除法によって示したHAによる細胞周囲の外被
固定したヒツジ赤血球を培養皿に加え、単層の細胞上に沈めた。赤血球は細胞を取りまく外被の大きなサイズと電荷により、細胞膜から排除される。外被は二つのやり方で形成される。その一つは、活発にHAを合成している細胞が、新しく作ったポリマーを細胞膜を通して押し出し、ここでHA結合タンパク質とコンプレックスを形成する。もう一つは、HAを活発に合成しないが高親和性の細胞表面HAレセプターを有する細胞は、他から供給されたHAと、HA結合性PGで細胞外被を組み立てることができる。
(b) 脊椎動物におけるHAの生合成と細胞外被形成の模式図
この図では、HA合成酵素依存的にHAによる外被を形成する細胞のみが示されている。
HAが細胞膜で作られるということは、必要な酵素の装置は細胞膜の内側かまたは膜部分に存在していることを示しているのであろう。それゆえ哺乳動物のHA合成酵素を、HA合成細胞の細胞膜から可溶化し部分精製する試みがなされた。しかしながら、1996年になるまではHA生合成に含まれる酵素の同定に向けてほとんど前進はなかった。1996年にはいくつかの研究室が別々に、HA合成酵素を遺伝情報としてもつ新しい遺伝子の同定を報告した(Ref.2の総説)。今回の総説でわれわれは、真核生物のHA合成酵素として最初と見なされている分子クローニング以来、この急速に進展している分野でなされた進歩を概説する。
HA合成酵素に関する専門用語についての注釈Streptococcus pyogenesのようなA群連鎖球菌での、活性化された二つのUDP-糖からのHA合成は、hasAまたはspHASという一つのタンパク質の作用によりなされる。3 さらに精製されたhasAタンパク質はin vitroでHA合成酵素活性を有している。4 したがって一つのタンパク質がβ-1,3とβ-1,4という二つの異なったグリコシド結合の形成を触媒できる。ここでβ-1,3はグルクロン酸塩からN−アセチルグルコサミンへの間の結合であり、β-1,4はN−アセチルグルコサミンからD-グルクロン酸塩への結合である。この能力は一つの遺伝子、一つのタンパク質、それに一つの機能という古典的ドグマに反するものである。この一つのタンパク質は、その前駆体からHAを合成できるという強い証拠を有するだけでなく、また細胞膜を横切って成長するポリマーの輸送作用にも関与していることを示す証拠もある。
アミノ酸配列分析によると、hasAの一次アミノ酸配列は、根瘤に集落を作る根瘤菌(Rizobium)の結節形成因子(NodC)酵素や、酵母と他の菌類のキチン合成酵素を含むβ-グリコサミニルトランスフェラーゼとある程度の相同性を有することが示された。それに加えてこれらの酵素は、脊椎動物発生のモデル生物であるXenopus laevis(アフリカツメガエル)の、DG42と呼ばれる以前同定されたcDNAといくらかの相同性をもっている。われわれおよび他の研究者達は、このようなシークェンス同等性を利用して、一般に脊椎動物のHA合成酵素とみなされているタンパク質のcDNAを同定し、単離するためのdegenerate PCR法戦略をたてた。二つの関連した推定HA合成酵素の遺伝子Has2とHas3 cDNAがヒト、マウス、ニワトリ、アフリカツメガエルおよびゼブラフィッシュで同定された。5,b アミノ酸配列は異種間で高度に保存されていた。また発現クローニング法により、さらにHas1と呼ばれる推定の脊椎動物由来HA合成酵素がマウスとヒトで同定された。ここではcDNAクローン含有物がHA合成酵素欠損細胞に注入され、形質転換細胞は、HA合成活性を獲得した細胞を同定することによりスクリーニングされた。つい最近われわれは、脊索動物のナメクジ魚(Amphioxus)で最初の無脊椎動物におけるHA合成酵素遺伝子を同定し、b HAの生合成が脊椎動物に進化する前からあったことを証明した。HAを合成する能力は、脊索を含めてより進んだ体の計画を作り上げる能力と平行して進化したのであろう。
b Spicerら、投稿準備中
アミノ酸配列解析によると、全ての真核生物および連鎖球菌のHA合成酵素は、複数の膜横断ドメインをもった細胞膜タンパク質であることを予測させる。比較的大きな細胞内ドメインで分けられた、二つのN末端側細胞膜横断ドメインと、C末端側の細胞膜横断ドメインがあり、比較的大きな細胞内ドメインはこのタンパク質の触媒活性に対応するシークェンスを含むと推定される。3 この構造はNodCや植物のセルロース合成酵素(CelAs)のような、関連したβ-グリコサミニルトランスフェラーゼの推定構造に非常に似ている。さらにアミノ酸配列比較から、これら全てのタンパク質の細胞内ループと推定される部分に不変の残基があることが同定され、5これが触媒活性に要求される領域であることを示している。真核生物のHA合成酵素、キチン合成酵素およびセルロース合成酵素の各遺伝子は共通の先祖をもち、その後枝分かれ進化を通して発展したということが想像できるだろうか? ヒトとマウスでは3種類のHA合成酵素があり、それぞれ関連性はあるが異なった遺伝情報が組み込まれ、異なった染色体上に存在する。これらのタンパク質はアミノ酸配列で55-71%の相同性を有している (Fig. 2).

Fig. 2 複数の脊椎動物HA合成酵素アミノ酸配列の比較
マウス(m)、ヒト(h)、およびXenopus laevis(x)のHas1、Has2、およびHas3のアミノ酸配列を比較した。ここにはXenopus laevis has1(DG42)のアミノ酸配列の要約した図を示す。赤色で強調した残基は、今日までに同定された全ての脊椎動物HA合成酵素の間で保存されているアミノ酸を示す。(全長アミノ酸比較データを見るには下をクリック。)全長アミノ酸比較データにおいて、着色した矢印は、無脊椎動物および脊椎動物のHA合成酵素遺伝子の部分的断片をクローニングするのにうまく使えた、degenerate PCRプライマーに対応するそれぞれ保存されたアミノ酸領域を示す。(ここをクリック)
哺乳動物とアフリカツメガエル(Xenopus laevis)のHAS遺伝子の構造研究により、HA合成酵素遺伝子ファミリーは、遺伝子複製の後分岐するという過程を通して進化したことが示された。全ての脊椎動物HAS遺伝子は、少なくとも一つのイントロンの位置については同じである(Fig. 3)。さらに保存された遺伝子構造と胚における発現パターンによると、Has1遺伝子はXenopus DG42遺伝子の、哺乳動物における相当物または相同遺伝子であるようだ。したがって、われわれはDG42をXenopus has1(xhas1)と命名し直すことを提案した。5
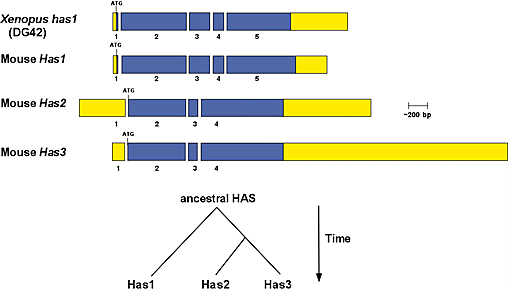
Fig. 3 脊椎動物HA合成酵素遺伝子の構造相関性と、ファミリーを作る基となったと推定される遺伝子重複現象
マウスHas1、Has2およびHas3遺伝子とXenopus has1(DG42)遺伝子の全体の遺伝子構造を比較するために、保存されているエキソンとイントロンの境界で整列させた。オープンリーディングフレームは青で示し、5′と3′の非翻訳部分は黄色で示した。翻訳開始コドン(ATG)と停止コドン(TGA,TAA)の各位置を示した。遺伝子構造の保存に基づいて、脊椎動物のHAS遺伝子ファミリーは、二つの引き続いて起こった遺伝子重複事象から生じたことが提案された。この事象は硬骨魚の進化より先行していた。第一の事象で祖先のHA合成酵素遺伝子が複写されて二つの遺伝子が作られ、これがHas1と祖先型のHas2系列のもととなった。祖先型のHas2遺伝子はその後複写され、Has2とHas3遺伝子のもととなった。
真核生物のHA合成酵素はStreptococcus pyogenesのHA合成酵素のspHASとアミノ酸配列が約25%相同である。しかしながら利用できるデータによると、細菌のHA合成酵素3は真核生物の宿主からの水平的遺伝子転移によりHAを合成する能力を獲得したとは考えられない。HASオペロン内のspHASのオープンリーディングフレームの位置と、他種細菌の同様なオペロンにおける関連多糖カプセル合成酵素のオープンリーディングフレームの位置に基づけば、spHASタンパク質は他の多糖カプセルの合成酵素から進化したように見える。
Fig. 4に示したように、hasオペロンにおいて、hasAの後にはhasB (UDP-グルコースデヒドロゲナーゼ)およびhasC (UDP-グルコースホスホリラーゼ)が続いている。hasオペロンと他の多糖カプセル合成オペロンの関係が示してある。Streptococcus pneumoniaのcap3オペロンはセルビュウロン酸カプセルの合成に必要である。hasオペロンと同様に、cap3オペロンはグリコシルトランスフェラーゼ(cap3B)、UDP-グルコースデヒドロゲナーゼ(cap3A)およびUDP-グルコースホスホリラーゼのオープンリーディングフレームからなる。しかしグリコシルトランスフェラーゼとUDP-グルコースデヒドロゲナーゼのオープンリーディングフレームはhasオペロン内のこれらの位置とは逆転している。これらのオペロンの構成はE.Coli K5カプセルのオペロンとも似ている。
各酵素のアミノ酸数で示したサイズが、各酵素間の計算されたアミノ酸配列相同性(オレンジ色で示す)とともに示されている。(1) hasオペロンにおけるhasAオープンリーディングフレームの位置 (2) hasオペロンと他の多糖カプセル合成酵素オペロンの構成が似ていること (3) hasAタンパク質とcap3Bタンパク質のサイズが似ていること (4)原核生物、真核生物およびウイルスの各グリコシルトランスフェラーゼとの間でhasAの全体のアミノ酸配列が同等であること。以上のような多くの証拠に基づくと、hasAは真核生物宿主からの遺伝子の水平転移によったのではなく、他の細菌の多糖カプセル合成酵素の背景の中で進化した可能性が高い。
このことは真核生物のHAS遺伝子と原核生物のHAS遺伝子は独立しており、機能に基づいて平行して一点に集中する進化の例に相当することを示す。
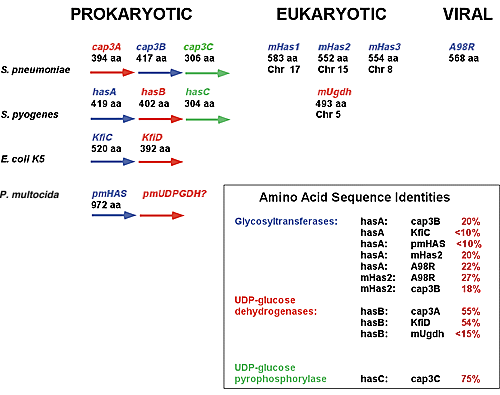
Fig. 4 原核生物、真核生物およびウイルスのHA合成酵素の間の進化における関係の推定
大きな矢印は細菌オペロン内のオープンリーディングフレームを示す。関連した活性をもつ酵素群は同じ色で強調してある。グリコシルトランスフェラーゼは青で、UDP-グルコースデヒドロゲナーゼは赤で、またUDP-グルコースピロホスホリラーゼは緑で示す。m,マウス; Chr,クロモソーム。マウスHas遺伝子とUDP-グルコースデヒドロゲナーゼ(Ugdh)遺伝子のマッピングされた各染色体を示した。
最近Paramecium bursaria chlorellaウイルスのA98Rオープンリーディングフレームに組み込まれた、最初のウイルスのHA合成酵素遺伝子が報告された。6このタンパク質は脊椎動物のHASタンパク質とアミノ酸配列が約50%相同であり、in vitroで事実HA合成酵素活性を発現する。さらにこのウイルスを感染させた藻類がHAを合成した。これは植物界におけるHA産生の最初の証明である。このウイルスと脊椎動物のHA合成酵素は互いにアミノ酸配列の相同性が特に高いので、この遺伝子は真核生物から水平転移によりウイルスが獲得したと思われる(Fig. 4)。機能を有するHA合成酵素は原核生物において、二つの方向から進化したように見える。
最近報告されたPasturella multocidaのHA合成酵素(pmHAS)12はhasAや真核生物のHA合成酵素とアミノ酸配列の相同性がなく、細菌性のリポポリサッカライド合成酵素により密接に関連している。それでもこのタンパク質は高分子量HAの合成を推進することは明らかである。UDP-グルコースデヒドロゲナーゼのオープンリーディングフレームはpmHASの下流にあるらしいことが示されている。12
今日までHA生合成の欠損による遺伝病はヒトまたはマウスでは見つかっていない。ヒトのHAS1遺伝子はヒト染色体(Chr)19q13.3-13.4に、マウスの相同遺伝子(Has1)はマウスChr17に位置している。ヒトHAS2はChr8q24-12に、マウスの相同遺伝子(Has2)は対応する領域のマウスChr15にある。ヒトHAS3はChr16q22.1に、マウスの相同遺伝子(Has3)はマウスChr8に位置する。7
真核生物HA合成酵素の分子としての同定に先立って、いくつかの研究室で哺乳動物細胞培養モデルを用いたHA生合成と、制御経路の役割の研究がなされた。これらの研究により初めて、HA生合成は細胞膜で起こることが証明された。ポリマーの合成は膜の内側表面で起こり、生成物は膜を通して細胞の外側へ押し出されるか、移送される。3 線維芽細胞の培養においては、HA生合成の速度は一部は細胞密度により、したがって細胞の増殖期によって制御されている。低い細胞密度では合成速度は高く、細胞の運動性や増殖速度が高い。高い細胞密度では、細胞増殖能は下がり、HA生合成は止まる。
フォルボールエステルのようなプロテインキナーゼCの活性化剤は哺乳動物細胞でHA生合成を増加させることができる。cAMP依存性のキナーゼを促進する化合物もHA生合成を増やす。活性化はde novoタンパク質合成とは全く独立しており、すでに存在していた酵素が活性化されたことを示している。哺乳動物細胞培養モデルにおいて、TGF-βスーパーファミリーとPDGFファミリーもHA生合成を促進する。この促進作用は部分的にはde novoタンパク質合成に依存するもので、HA合成遺伝子発現の増加が含まれるだろうことを示しているが、プロテインキナーゼCによる内在タンパク質の活性化にも依存している。8 意義深いのは、各HASタンパク質の細胞質内ループと推定される部位にプロテインキナーゼCリン酸化サイトのコンセンサス配列があることから、HASタンパク質の活性は部分的には直接のリン酸化によって制御されていることを示していることである。
三つの脊椎動物HA合成酵素の間の機能的関連性は何であろうか?哺乳動物HA合成酵素のどの一つを発現させても、哺乳動物細胞系でHA生合成が導かれることから、それぞれが合成酵素として独立に機能することを示している。それに加えて、アフリカツメガエル(Xenopus laevis)のHA合成酵素DG42(xhas1)をパン酵母で発現させると、酵母細胞はin vitroで細胞膜にHA合成活性を示した。9 したがって、HASタンパク質は単独の形で、HA合成と成長するポリマーの移送をする能力がある。このことから次に、spHASタンパク質で推定されたように、真核生物のHASタンパク質も、そこを通して成長するHA鎖が押し出されるような、細孔またはチャンネルを形成するであろうことが示される。こうして提案された細孔の性質を解明するにはさらなる研究が必要であるが、X線照射による失活の研究によると、spHASは細胞膜で単量体で機能していることが示された。3
各HASタンパク質は真核生物細胞においてHA合成を触媒できるが、その酵素としての性質は異なっている。cこの異なった酵素的性質が生理的な機能の差の底に潜んでいるのだろう。5 Has3は本質的にHas2より触媒活性が高く、次にHas2はHas1より本来高活性である。さらにin vitroにおいて、各HASタンパク質により産み出されるHAプロダクトのサイズを分析すると、HA鎖の長さは何らかの理由で、発現された各HASタンパク質により決められることが示された。Has1とHas2両タンパク質は同様の長さのHA鎖を合成し(2x106 Daまで)、一方Has3はより短く<2x105 Daから3x105 Daの範囲のHA鎖を作る。異なった長さのHA鎖は細胞の行動に異なった影響を与える。非常に短いHA鎖は細胞増殖を促進し、またシグナルのカスケードを開始することが証明され、これらは血管新生と炎症応答に関与しているようだ。高分子量HA鎖は反対の効果を有し、細胞増殖を阻害する。短いHA鎖は、例えばヒアルロニダーゼや酸化物により、細胞外HAが分解されることによっても産生される。 異なったHASタンパク質が異なった平均鎖長のHAを合成するという発見(Fig.5)は、別のレベルでの制御を追加した。これらの様々なポリマーの長さの機能的重要性はまだ未解明である。
c Itano, N., Yoshida, M., Lenas, P., Yamada, Y., Spicer, A.P., McDonald, J. A., and Kimata, K., 投稿中
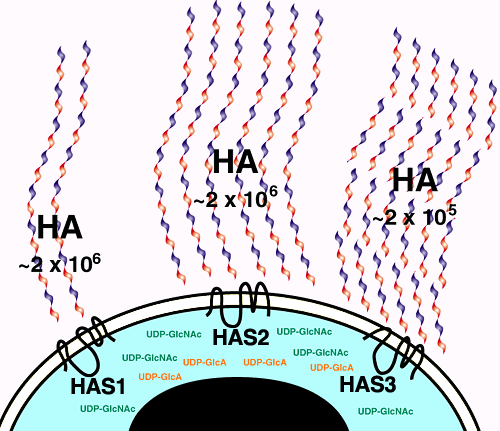
Fig. 5 各HASタンパク質の発現によるHAの量と分子量の制御
哺乳動物の細胞培養で発現された脊椎動物のHAS酵素の生化学的性質の解明により、哺乳動物の各HA合成酵素の間の類似点と差が明らかになった。その差をこの模式図に描いてある。Has1は少量の高分子量HAを製造する。Has2は非常に多量の高分子量HAを作る。Has3は最も合成活性は高いが、低分子量のHA鎖を製造する。酵素活性におけるこの差の生理的な重要性についてはまだ知られていない。
脊椎動物のそれぞれのHASタンパク質の酵素活性に明らかに差があるのは、細胞質内のループと推定される部分にある特定のアミノ酸残基に関係しているようだが、この残基はそれぞれのHASタンパク質のタイプの間では変動するが、同タイプについてはゼブラフィッシュからヒトまで、種を通じて一定である。酵素活性速度および/またはHA鎖長を規定しているアミノ酸配列の同定は、やがてわれわれに、特定の細胞内またはin vitro系で特定の長さのHAを所定量だけ合成する、特注のHAS酵素を創り出すことを可能にしてくれるだろう。
真核生物のHA合成酵素は、原核生物のHA合成酵素(spHAS)および根瘤菌のNodCタンパク質(キトオリゴ糖合成酵素)と同じ程度のアミノ酸配列相同性を有している。真核生物のHASタンパク質は菌類のキチン合成酵素とは相同性が比較的少ない。キチンはN-アセチルグルコサミンのβ-1,4ホモポリマーであり、真菌類の細胞壁成分および節足動物や甲殻類の外骨格として最もよく知られている。Xenopus DG42とキチン合成酵素のアミノ酸配列の相同性から、研究者はこのタンパク質の酵素的機能を推測したくなる。実際脊椎動物HA合成酵素遺伝子ファミリーの分子的同定がなされる前には、in vitro転写—翻訳という方法で発現したとき、DG42(xhas1)はキトオリゴ糖合成活性は示すが、HA合成活性は有しないことが証明されていた。しかしながらDG42がパン酵母に発現されたときには逆のことが起こった:つまりHA合成活性は示したがキトオリゴ糖合成活性はないことが証明されたのである。9
その後、ゼブラフィッシュ胚の界面活性剤による抽出物が、in vitroでキトオリゴ糖合成活性を有することが証明された。さらにこの活性は、Xenopus DG42タンパク質のN末端に対するポリクローナル抗血清で免疫沈降反応をすると、選択的に除去できた。10 したがってこれらのデータは、HA合成酵素ファミリーのあるメンバー(または全てのメンバー)は、ある環境下では短いキトオリゴ糖を、他の環境下ではHAポリマーを合成できるだろうことを示している。現在のところ、単一のHASタンパク質がいかに制御されたら、これらの関連性はあるが異なった生体ポリマーを合成できるのか、を想像するのは難しい。
脊椎動物におけるキチンの存在は論争の的であるが、最近脊椎動物の発生において、キトオリゴ糖が存在するという直接的証明がなされた。11 重要なことは、これらのキトオリゴ糖は発生における狭い期間にだけ検出されたことである。脊椎動物の発生におけるキチンオリゴ糖の機能的重要性を推測するのは興味深い。根瘤菌の根瘤形成因子の場合に類似した信号の役割を連想させるが、しかし我々は、能力の高いリポキトオリゴ糖の信号を創り出すためには、一連の修飾酵素が必要であるだろうことを予想する。今現在、キトオリゴ糖の生合成に真核生物のHA合成酵素が関与する可能性と、これらの糖のポリマーが脊椎動物の発生において、重要な生物学的意味をもつかどうかについては、依然論争のトピックスとして残っている。
マウスは、自然発生の変異や、トランスジェニックおよび遺伝子破壊の方法を用いた、哺乳動物遺伝子の機能的研究のためのモデル動物に最適である。in vivoにおけるHAの生合成に対する、三つのHA合成酵素の寄与を評価し始めるに当たり、我々はマウス胎児幹細胞のジーンターゲッティング法を使って、マウスのそれぞれのHAS遺伝子を壊すか、ノックアウトを行った。以前にわれわれは、三つのHAS遺伝子が、発育中の胎児でも大人の組織でも、時間的発現パターンが異なることを証明した。このことと、関連するが異なる酵素活性を証明したin vitroデータから、各HASタンパク質はin vivoにおいてHAの生合成に高度に特異的役割を果たすことが示された。三つのHASタンパク質のうち最も活性の低いHas1は高分子量HAの合成を行う。こうしてHas1は多くの型の細胞で、低いが必要なレベルのHA生合成を維持する役割を演じているのだろう。Has2は胎児の発生を通じて広く発現されている。これはHas1より著しく高活性で、また高分子量HAを合成する。高分子量HAを多量に生産することは、組織の構造と容積に大きな影響をもつだろう。したがってHas2によるHA合成は、組織の膨張と成長を含む発生プロセスに重要な役割を演じると推定される。Has3は胎児の発育過程では遅れて、また多くの大人の組織で発現される。これは三つのHASタンパク質のうちで最も高活性だが、短いHA鎖を合成する。Has3の発現により多量の低分子量HA産生が活性化され、これにより自動的に細胞周囲にマトリックスが作られたり、または細胞表面HAレセプターと相互作用し、これが細胞の行動変化へと導くシグナルカスケードへの引き金となるのだろう。
Has1とHas3活性の欠損したマウスは生存能力があるが、d,e Has2の欠損したマウスは、この変異が胎児の発生において致死性であるため得られていない。これらの胎児は卵黄嚢と心臓の欠損を含む重大な発生上の欠陥をもち、HAをほとんど欠いている。f したがって正常の胎児の発生には、Has2に依存したHAの生合成が必要であるが、Has1やHas3による合成は必要とされない。
d Itano, N., Spicer, A. P., Camenisch, T., McDonald, J. A., and Kimata, K., 投稿準備中
e Spicer, A. P., Nguyen, T. K., and McDonald, J. A., 投稿準備中
f Spicer, A. P., Brehm-Gibson, T., Camenisch, T., Kubalak, S., and McDonald, J. A., 投稿準備中
それではHas1とHas3のHA生合成における役割と、in vivoにおける機能は何であろうか?現在Has1とHas3欠損表現型の研究が始まっている。いくつかの発現型は、例えば関節不全や他の骨格の障害、または免疫関連の機能障害等に関連して、年令とともに生じてくる可能性がある。それに加えこのシステム中に、ある程度の機能的埋め合わせが組み込まれるかも知れない。この可能性は、両系統のマウスを交配することにより、Has1とHas3の両方の機能が欠損したマウスを作ることにより容易に評価できる。
真核生物のHA合成酵素の同定と性質解明は、HA生物学の分野に革命を起こした。今ではわれわれは、本質的にどんな哺乳動物細胞も、また多分どんな真核生物細胞も、単に一つの遺伝子を発現させるだけで、HA生合成の工場に変えることができる。われわれはまた、マウスHAS遺伝子をin vivoで遺伝的に巧みに操作することによって、発生や疾病に伴った過程におけるHAの役割を研究することができる。脊椎動物では、HA生合成は三つの、関連はあるが別々の酵素によって推進されている。三つのHAS遺伝子における差のある転写、酵素反応速度における固有の差、および作られたHAの鎖長の差の組み合わせにより、生物にとってHAの合成と機能に関する精密な制御がもたらされているのである。
〔謝辞〕この研究は以下の基金の支援を受けてなされた、すなわち、 National Research Service Award 1 F32HL09311-01 (to A.P.S.)、American Heart Association, Arizona Affiliate, Beginning Grant-In-Aid Fellowship AZGB-19-96 (to A.P.S.)、 March of Dimes Birth Defects Foundation Basil O'Connor Starter Scholar Award (to A.P.S.)、NIH grant RO1AR44689 (to. J.A.M.)、それに the Mayo Foundation for Medical Education and Researchである。