
氏名:Timothy E. Hardingham
Timothy E. HardinghamはBristol大学で生化学を専攻し、そこで1968年にPh.D.を授与された。彼はその経歴の大部分をロンドンのKennedy Institute of Rheumatologyで過ごし(1968-94)、ここでHelen Muirと、プロテオグリカンおよび関節軟骨について研究した。この研究からヒアルロン酸が、軟骨プロテオグリカンであるアグリカンの凝集において、重要物質となっていることが明らかにされた。博士は1978年に英国生化学会からColworth Medalを授与され、またその後の消耗性関節疾患に関する業績により、1989年の変形性関節症研究に対するRoussel International Prize for Research on Osteoarthritisおよび1991年のCarol Nachman Prize for Rheumatologyの共同受賞者となった。現在博士はManchester大学生物科学部のWellcome Trust Centre for Cell-Matrix Researchで生化学の教授として、細胞外マトリックスのプロテオグリカンとヒアルロン酸の機能について研究している。博士は英国マトリックス生物学会の会長であり、また国際マトリックス生物学会のメンバーである。現在、1998年9月に英国Leicesterで開催されるヒアルロン酸シンポジウムのオーガナイズをしている。
軟骨は高度に特殊化した組織であり、高等脊椎動物においては、成長段階で長管骨の鋳型を形成し、成熟してからも選ばれた部位に、特に関節の重量負荷部表面に残存する。軟骨細胞は軟骨容量のわずか2-3%しか占めず、組織の大部分は高度に組織化され、広がった細胞外マトリックスより成り立っている。この組織の重要な生体力学的性質は、細胞外マトリックスの複合構造の結果としてもたらされ、以下の2つより成る。
1) 組織の形態と張力的性質を形成するコラーゲン線維(主にタイプII、VI、IXおよびXI)の密な網目構造
2) 浸透圧により組織内に水を引き入れ、コラーゲン網目構造に膨張圧力を及ぼす高濃度のプロテオグリカン(主にアグリカン)1
伸長できないコラーゲン網目構造内に、圧縮した形でアグリカンを保持することで膨張圧力を生み、それが最小の変形で圧縮荷重に耐える理想的な組織をつくり、丈夫で弾力のある荷重支持表面としての機能を支えている(Fig. 1).
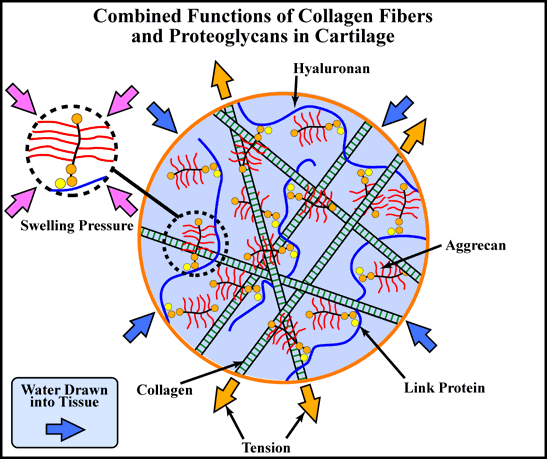
Fig. 1 軟骨におけるアグリカンの機能
軟骨に対する荷重は、コラーゲン線維網目構造による張力と、高濃度アグリカンによる浸透膨張圧力によって支持されている。
アグリカンはヒアルロン酸、リンクプロテインとともに超分子的凝集体を形成することにより軟骨基質内に固定されている。軟骨中のアグリカンは、溶液中における完全に広がった状態の15%以下の容積しか占めない(点線のアグリカン参照)。
アグリカンは単一の遺伝子によってコードされた高分子量(約25万)のコアタンパクをもつプロテオグリカン(以下PGと略記する)で、主に軟骨組織に発現している1。これは3つの球状と、2つの伸張したドメインを有している(Fig. 2)。

Fig. 2 アグリカンの構造
アグリカンは3つの球状ドメイン(G1、G2、G3)と、2つの伸張領域から成っている。この2つの伸張領域はG1とG2の間の部分と、主要なグリコサミノグリカン結合部分である。GAG結合部位は可変なケラタン硫酸部位と、アミノ酸配列パターンで区別される、2つのコンドロイチン硫酸部位(CS-1とCS-2)から成る1。リンクプロテインのドメイン構造も示したが、これはアグリカンのG1ドメインと似ている。凝集体において、アグリカンのG1ドメインはヒアルロン酸と結合し、これはリンクプロテインによって安定化される。
これは主に2種類のグリコサミノグリカン鎖、即ちコンドロイチン硫酸(以下CSと略記する)とケラタン硫酸(以下KSと略記する)から成る約90%の糖質を含み、高度にグリコシル化されている。各アグリカンはそれぞれ約20 kDaのCSを約100本含有し、これらは4-硫酸、6-硫酸または通常その両方を含んでいる。KSはより少なく(60本以下)、また長さも短い(5-15 kDa)。CS鎖がすべて球状ドメインの2と3の間の長い伸張ドメインに結合しているのに対し、KSは広範囲に分布している。これはG2ドメインのC末端に接したKSリッチ領域に最も多く存在しているが、両方の伸長ドメインと、G1およびG2ドメインにも結合している。アグリカンはまた、数は変動するが、O結合型糖鎖とN結合型糖鎖も含んでいる。O結合型糖鎖はKSのタンパクへの結合部と同様な構造を有し、生合成においていくつかのO結合型糖鎖は伸長し、硫酸化されてKSとなるようだが、ほかのものは伸長しない。伸長してKSになる比率と、合成される鎖の長さのばらつきが、種々の軟骨から得たアグリカンにおけるKS含量に大きな差が見られることの原因であろう。
アグリカンの一次遺伝子産物であるコアタンパクは、こうして軟骨細胞により色々な程度にグリコシル化されて分泌され、生成巨大分子は幅の広い組成を示す1。これらは常に高いグリコサミノグリカン(以下GAGと略記する)含量を示すが、その糖鎖の数は変動し、またその鎖長と硫酸化パターンも多様である。多くの因子がGAG鎖とオリゴ糖の合成に影響を与えるのは明らかであるが、アグリカンの組成が、組織の部位と年齢や、軟骨細胞に作用する成長因子とサイトカインの分布範囲などといかに関連しているかについては十分わかっていない。
アグリカンタンパクの3つの球状ドメインは、種々の脊椎動物種間で高度に保存されたアミノ酸配列を含むが、伸張したドメインはそれに比べ余り保存されていない。例えば動物種によってKSリッチ領域の長さには相当のばらつきがあるが、この領域でさえヒトにおいてかなりの多形性が存在する。このことはアグリカン中のGAGのわずかな変化は、その主要な機能にほとんど影響しないが、球状構造の機能はアミノ酸配列の変動に、より敏感であることを示している。G1とG2ドメインは類似した構造を持つ一方(以下に述べる)、G3ドメインは明らかに違っており、4つの全く異なったタンパクモジュールを有する。すなわち補体制御タンパクモチーフと、2つの選択的にスプライシングされたEGF様配列、そしてカルシウム依存性哺乳類C型レクチンモチーフである。G3ドメインのレクチンとしての性質は検出されているが、天然のリガンドはまだ同定されておらず、マトリックス組織中におけるこのドメインの本当の機能はまだ明らかになっていない。
Sam PartridgeとMartin Mathewsの研究室における1950年代後期から1960年代初期の研究により、軟骨由来のPGは大きな凝集体を形成することが示唆されたが、HascallとSajdera2がグアニジン塩酸を解離的溶媒として導入したことで、このプロセスの詳細が解明されるようになった。彼らは大きなPG凝集体が各単量体へと可逆的に解離することを証明する条件を確立した。その頃、Helen Muirと私は、PGモノマーの溶液に少量(約1%)のヒアルロン酸(以下HAと略記する)を加えると、粘度が劇的に増加することを示すことにより、HAが凝集体をつなぎとめている3重要な成分であることを確認した。アグリカンとHAの結合が当初はまったく予想されなかったのは、1つのポリアニオンと別のポリアニオンとの結合は、その電荷による反発力からまずあり得ないと考えられたからである。その当時、巨大分子を用いた研究は、使える技法だけでなく、アグリカンとHAが非常に稀薄な溶液以外では並外れて非理想的な生物物理的挙動を示すこともあって限度があった。
しかしながら、凝集を促進するHAの効果は、DNA、アルギン酸、CSまたはデキストラン硫酸等の他のポリアニオンによっては生まれなかったので、非特異的ポリアニオン効果によるものでないことが示された。実際その後に続く、HAの10糖(くり返し2糖;-GlcA-β1,3-GlcNAc-β1,4-の5単位)が相互作用に要求される最小単位だという証明から、凝集はアグリカンのコアタンパクの機能によることが確立された。こうしてアグリカンは、同定されたHA結合タンパク質ファミリーの最初のメンバーとなった4。今では更に3つのHA結合PGがクローニングされており、それらはバーシカン、ニューロカンそれにブレビカンである(Fig. 3)。これらは全て、アグリカンの球状ドメインに類似した配列を含み、HA結合PGファミリーを形成している1。
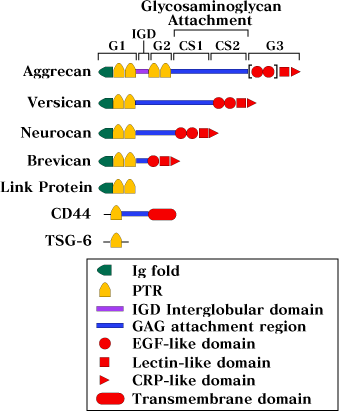
Fig. 3 アグリカンに関連したHA結合タンパクファミリー
PGであるアグリカン、バーシカン、ニューロカン、ブレビカンと、細胞表面HAレセプターであるCD-44およびマトリックス分子のTSG-6とリンクプロテイン等のドメイン構造の模式図。
アグリカンにおける [ ] は、選択的にスプライシングされたEGF様ドメインを示す。
アグリカンのN末端球状G1ドメインは、HAに高い親和性を持つレクチン様結合部位をもち、凝集の形成を可能にしている。HAは分子量数百万にもなる、長くて枝分かれのない鎖なので、各鎖は多数のアグリカンと結合して、分子量として数千万にもなる凝集体を形成することができる(Fig. 4)5。各アグリカンのHAへの結合は、リンクプロテインと呼ばれる小さな糖タンパク質(45 kDa)によってさらに安定化されている4, 6。
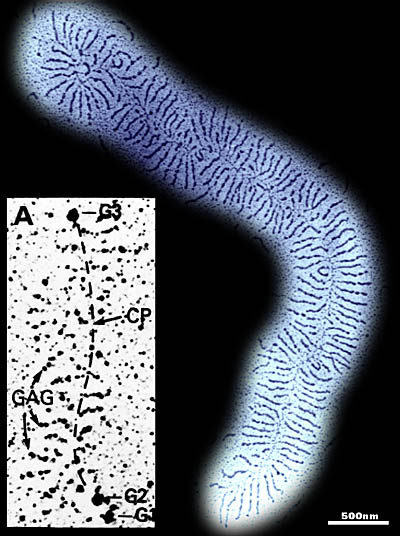
Fig. 4 アグリカンとHA、リンクプロテインとの凝集体の電子顕微鏡写真
A)牛胎児骨端軟骨から得たアグリカン標品5で、チトクロームCでコントラストをつけニトロセルロース上に伸展させたもの。主軸はHA鎖(約5 µmの長さ)で約200のアグリカン(とリンクプロテイン)が結合している。

A(挿入図)および、B-D)
ロータリーシャドウ法によるアグリカン標品で球状タンパクドメインを示したもの(Morgelin et al., 1988)
B)コンドロイチナーゼABCでコンドロイチン硫酸を除去したアグリカン。これはG1ドメインでHAに結合し、矢印で示したG3ドメインはHAから離れた非結合領域にある。
C)リンクプロテインのない状態でアグリカンのG1-G2断片がHAに結合したもの。標品はG1-G2断片を過剰に含み、HA上に最大密度(12 nmに約1個)で結合している。G2ドメインはHAに結合できず、HA鎖から離れたままである。(矢印は高次らせんの存在する可能性のある部位を示す)
D)CにおけるようにG1-G2で飽和した凝集体だが、リンクプロテインの存在下で形成させたもの。HAに結合しているタンパクの密度はリンクプロテインにより増しているが、間隔は変わらず、G2ドメインはHA、リンクプロテインとの結合に含まれていない。
アグリカンのG1ドメインは3つのタンパクモチーフを含んでおり、それはイムノグロブリンループ(Ig-fold)と、2つのHA結合モチーフ(またはリンクモジュール、あるいはプロテオグリカンタンデムリピート=PTRとも呼ばれる)である。リンクモジュールは、PGのすべてのHA結合ファミリーとリンクプロテインにタンデムに存在するが、同時に単一コピーとして細胞表面HA結合レセプターのCD44と、炎症性サイトカインにより合成が誘導される分泌マトリックスタンパク質であるTSG-6中にも存在する。TSGから得たリコンビナント(組み換え体)リンクモジュールの3次元構造は、NMRによって決定され糖結合モチーフの哺乳類C型レクチンに関連していることが示された(Fig. 5)7。
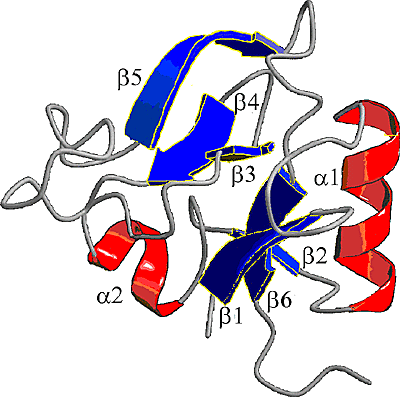
Fig. 5 HAに結合するリンクモジュールのNMRによる構造モデル(Kohda et al., 1996)
モデルはTSG-6リンクモジュール組み換え体についてNMRで求めたもの。これは2つのα-ヘリックス構造(α1とα2)と2つのアンチパラレルβ-シート構造(β1-6)が、大きな疎水コアの回りに配置されたものから成る。この構造は哺乳類C型レクチンと似たところがある。
リンクプロテインは、Igループと2つのリンクモジュールを含んでいることからアグリカンのG1ドメインと非常に似た構造を有し、これらは共通の先祖遺伝子を持つことを示している。アグリカンのG2ドメインの構造は、これもまたG1とリンクタンパクに関連した構造を持つゆえに興味深く、未解決の問題を提起している。これはIgループを欠いているが、リンクモジュールの2つのコピーを持っている。しかしながら、G2ドメインにはHA結合活性は全く見られず、したがって凝集体の形成において、この第2のHA結合部位がどんな役割を果たしているのかを理解するのは困難である。
アグリカンのHAへの結合はKd=2×10-8と高い親和性を示し4 、pH 6-9の範囲で最も高く、それより低いpHでは解離が起き、pH 3では全く結合しない。pH約7で25℃から加温していくと、約65℃まで可逆的に解離していく。より高い温度では、G1ドメインはゆっくり非可逆的に変性するが、80℃においても約115分の半減期をもつ。生理的pHの生理食塩水中では、プロテアーゼに対して抵抗性を示す。グアニジン塩酸、尿素それにチオシアン酸カリウムのような多くの変性試薬にさらした後、G1ドメインは回復する。これはまたエタノール、アセトンまたはエーテルのような溶媒で処理しても失活せず生き残る。G1ドメインのジスルフィド結合を還元すると、HAへの結合は効果的に消えるが、還元した後でも非変性条件下で再酸化すると、結合活性は大きく回復する。これらの性質すべてから、G1ドメインの本来の構造は変性に対して抵抗性があり、そして熱力学的にも大変有利な構造をもち、変性状態から効率的に形態が回復するのである。アグリカンのG1ドメインはこのように、細胞外マトリックスでの長い寿命に適し、丈夫で安定した構造をしているようだ。
凝集構造におけるリンクプロテインは、2つのリンクモジュールを介したHAとの相互作用と、Igループを通してのG1ドメインとの相互作用の両方による3成分複合体の形成により、アグリカン-HA結合4, 6 を強化している。こうしてリンクプロテイン存在下に形成された凝集体は、生理的なイオン強度とpHの下では著しく解離しない。熱安定性も増し、55-60℃の範囲ではリンクプロテインで安定化された凝集体は解離しないが、より高い温度では、リンクプロテインは非可逆的に変性するようだ。リンクプロテインはG1ドメインよりグリコシル化の程度が低いので、精製すると不溶性になる傾向がある。リンクプロテインのIgループとG1ドメインの間の相互作用は、アグリカンをHA鎖に固定させ、本来の凝集体構造の3成分からなるコンパクトなユニットを形成しているように見える。リンクプロテインに対するポリクローナル抗体は、元のままの凝集体においてよくリンクプロテインを検出できないことから、この主要エピトープは本来の構造においては隠されていることを示している。これに対しG1ドメインに対するポリクローナル抗体は、凝集体において通常G1エピトープと支障なく反応でき、この場合はエピトープがもっと利用しやすい位置にあることを示している。
アグリカンは軟骨細胞により絶えず合成・分泌されており、他の分泌タンパク質と同じ細胞内合成経路をたどる4。mRNAは膜結合リボソーム上で翻訳されて粗面小胞体=RERへと移行し、引き続きゴルジに移動して主要なO-グリコシル化とGAG鎖合成が起こる。GAGは分泌前に起こる高度な協調過程の一部としてアグリカン上に迅速に合成されるようだ。分泌前における細胞内での完成分子の貯蔵はない。リンクプロテインはグリコシル化が少なく、GAG鎖をもたないが、これも同様な細胞内経路に沿って合成される。しかしながら、HAは細胞内の同じコンパートメント内では合成されず、細胞質膜に局在すると思われる合成酵素により作られ、直接細胞外マトリックスへ分泌される。アグリカンとリンクプロテインは、こうして軟骨細胞により細胞外マトリックスへ分泌されて初めてHAと出会う。したがって凝集は、アグリカンを高次構造に組み立てるために細胞外で進められる。このことは、軟骨細胞外マトリックス中にアグリカンが留まるのに好都合なので、この過程は組織の生体力学的性質を支えるのに、マトリックスにアグリカンを高濃度に維持する上で重要な役割を果たしているといえる。
凝集について化学量論的に得た結論によると、HAを、結合するアグリカンで飽和状態にすると、その重量比は約1対140であった。これによればHAに結合している各アグリカン(平均分子量約200万)に対するHAの最小分子量は約7,000である。これは、各アグリカンがHAの32-36糖分の長さを占め、もし伸ばした場合約17 nmになることを示している。
GAG鎖にコントラストをつけるため、単層フィルム上に調製した凝集体の電子顕微鏡写真(クラインシュミット技法)によると、中央のHAフィラメントに非常に多くのアグリカンモノマーが結合していることが示された(Fig 4)5 。各モノマーの間の平均スペースは25 nmであったが、アグリカンをもっと高濃度に調製するとこれは約18 nmまで短縮された。球状タンパクドメインを示すためにロータリーシャドウ法で視覚化した標品において、精製G1ドメインは最小スペース12 nmでHAに結合していたが、より低い飽和密度ではG1ドメインはより広い間隔で配置され、共同的結合の証拠は見られなかった8。アグリカンのG1-G2画分を単離してHAと結合させ、ロータリーシャドウ法の画像で見ると、やはり最小間隔が約12 nmであった。この複合体では、G2ドメインは常にG1ドメインと、またHAからも離れたままであった。リンクプロテイン存在下では、G1-G2の充填密度は変わらなかったが、HA鎖上で離れた球状複合体としてではなく、連続した被覆物として現れていた。HA上での連続したタンパク被覆物の出現は、元の損なわれていない凝集体標品のロータリーシャドウ法においても見られ、このことはHA鎖に沿った、隣り合わせたG1ドメイン-リンクプロテイン複合体の間でいくらか共同的会合が起きていることを暗示しているようだ。
ロータリーシャドウ画像におけるその長さが21+/-3 nmとかなり一定であることから、G1とG2ドメインの間の伸長部分は強固であると考えられる8。この領域はKSをいくらか含み、これが伸展構造に寄与しているようだ。しかしこの部位には、アグリカンに対するプロテアーゼの攻撃の対象部位も含まれ、これは細胞外プロテアーゼによる正常時、およびサイトカイン刺激時の分解のどちらにおいても重要である1。この部分での蛋白分解により、凝集体から大きなGAG結合領域を伴ったG2ドメインが遊離される。凝集体構造中のHAにG1ドメインとリンクプロテインはぎっしり詰まっていることにより、プロテアーゼに対して抵抗性を示し、加齢とともに組織中においてG1とリンクプロテインに覆われたHAが次第に増加するようになる。
これらは高齢のヒト軟骨抽出物では明白である。なぜならば、その組織中のG1ドメインの半分しか大きなアグリカン分子の成分に残っていないと推定されてきたからである。ここで興味深いのは、若くて成長中の軟骨のHA含量はアグリカンの約1%であり、これは最大密度において全てのアグリカンを結合して大きな凝集体にする最適の量であることである。これから軟骨におけるHAとアグリカンの合成と代謝は密に調整されていることも暗示される。加齢に伴って軟骨中のHAは次第に増え、アグリカン量のほぼ10%にもなる。この増加は、少なくとも部分的には、HAの大部分が蓄積したアグリカンのG1ドメイン断片とリンクタンパクにより占められることにより起こる。
軟骨における凝集は、非常に巨大な細胞外分子を組み立てるメカニズムであり、これによりCSやKSのようなポリアニオンをコラーゲン線維の細かい網目構造に組み込み固定している。これが非常に重要なのは、組織の生体力学的性質を維持するためだけでなく、軟骨細胞がそのマトリックスを初めに確立し拡張する際に、最初の成長時の組織の形を決めているためである。PGのHA結合ファミリーの他のメンバーは、軟骨とは生物物理的性質が非常に異なった細胞外マトリックス中に見られる。バーシカンは皮膚の真皮と大動脈の中膜に見られるが、ここでは「固定」は主要な機能ではないらしい。これらの「軟らかい」結合組織は軟骨よりもより多くのHAを含んでおり、このことは凝集がより小さな分子集合の形成に好都合となっていることを暗示している。
そのようなマトリックスにおいてもHAの代謝は非常に活発で、大変速い代謝回転速度をもつようだ。それにもかかわらず、これらのより細胞に富んだ組織では、細胞外マトリックスコンパートメントは軟骨よりも小さく、このマトリックス中における成分の濃度はなお非常に高いと考えられる。凝集によって作り出される超分子組織化はしたがって、局所組織の性質、マトリックスと細胞の相互作用、そしてマトリックス内における大分子の拡散に対して、大きな影響を持ち続けていると考えられる。また、G3様ドメインのレクチン結合のような、PGの他の相互作用の性質も軟骨の場合に見られた以上にマトリックスの組織化に寄与しているのではないだろうか。軟骨以外の組織については、凝集の研究はこれまでほとんどなされておらず、我々はそのすべての生物学的機能について知るべきことは多い。
脊椎動物組織の細胞外マトリックスにおいて、HAはPGファミリーを大きな、可溶の、多分子からなる凝集体に組み立てる骨格として進化を遂げた。凝集は、HAに対して高度に特異的なレクチン様相互作用を含み、1つの型のポリアニオンと他のポリアニオンを組み立てる珍しい例をもたらす。PGと類似した構造をもつ小さなリンクプロテインは、凝集体を安定化させるのに重要である。リンクプロテインとPGのHA結合に関与する「リンクモジュール」は、CD-44やTSG-6のような他のタンパクにも見られる。その構造は特定され、哺乳類C型レクチンファミリーに関連していることが示されたが、その糖質結合活性がCa++依存性ではなかったことは異なる点であった。リンクモジュールを含むタンパクは、高等動物の細胞外マトリックスにおけるHAの主要なリガンドである。