 |
スルファタ-ゼは様々な分子の硫酸エステル結合を加水分解する酵素である。ヒトでは17種のスルファターゼ遺伝子が確認されており、多くはリソソームに局在する。リソソーム局在スルファターゼ群は、酸性条件下で硫酸化グリコサミノグリカンや硫酸化糖脂質などを糖分解酵素と協調して連続的に分解する。ヒトSULF1およびSULF2は細胞内局在スルファターゼ群とは異なるタンパク質をコードする遺伝子として2002年に同定された(1)。ヒトSULF1およびSULF2タンパク質はそれまで知られていたスルファターゼと異なり、細胞外に分泌されヘパリン/へパラン硫酸(HS)糖鎖を基質とすることが示された。糖鎖内部の硫酸基にはたらくエンド型スルファターゼであることが初めて明らかにされた。ヘパリン/HS糖鎖内には高度に硫酸化修飾された領域S-ドメインが存在する。SULF1およびSULF2はS-ドメインのIdoA2S-GlcNS6S単位(IdoA、GlcNS、2S、6S は、それぞれイズロン酸、N-硫酸化グルコサミン、2-O-硫酸、6-O-硫酸を表す)の6位硫酸基を遊離する活性をもつことが明らかにされた(1, 2)(図1)。酵素活性に対する至適pHが中性であることはこれらの酵素が細胞外ではたらくことを強く支持した(1)。
ヒトSULF1およびSULF2はそれぞれ全長871アミノ酸(aa)および870 aaでありお互い64%のaa配列が一致する。N末端に約20 aaのシグナルペプチド、約370 aaのリソソーム局在スルファターゼ群と相同性をもつ活性領域を有し、約320 aaの親水性領域(以下、HD領域)およびヒトエキソ型N-アセチルグルコサミン-6-スルファターゼと高い相同性をもつ約100 aaのC末端領域を有する(図1)。SULF1およびSULF2のアミノ酸配列はそれぞれ、ヒト及びマウス種間で93-94%一致し、非常に高い相同性がある(1)。SULF1およびSULF2の酵素活性領域にはSUMF1によりα−ホルミルグリシンに変換されスルファターゼ活性に必須であるシステイン残基が含まれる。SULF1およびSULF2はN-結合型糖鎖で修飾された約125 kDaの分子量タンパク質として生合成される。その後、FurinプロテアーゼによりHD領域内でプロセシングされ75 kDaと50 kDaのフラグメントとなる(1, 3-5)。これらのフラグメントはジスルフィド結合により結合する。ある条件下では、SULF1もしくはSULF2は二量体形成を示し(3)、またSULF2はHD領域内でコンドロイチン硫酸付加修飾を受ける(6)。SULF1およびSULF2のHD領域はSULFタンパク質の細胞表面局在においても重要なはたらきをする(1, 3, 7, 8)。ヒトSULF1およびSULF2は脂質ラフトと呼ばれる細胞膜に形成される動的な膜ミクロドメインに濃縮されており(3)、細胞外に分泌される活性型SULF2は超高速遠心によりペレットとして回収できる(9)。大変興味深いことに、Furinによるプロセシングは4-メチルウンベリフェリル硫酸基質に対するSULF1およびSULF2のスルファターゼ活性、ヘパリン/HS糖鎖基質に対するSULF1およびSULF2のエンドスルファターゼ活性のいずれの活性にも必須ではないが、脂質ラフトへの局在には必要である。脂質ラフトにおける各種タンパク質の相互作用は多くのシグナル伝達において重要である。SULF1およびSULF2のタンパク質プロセシングがWntなどのヘパリン結合性因子シグナル調節機構に深く関わることも示されている(3, 7, 10)。
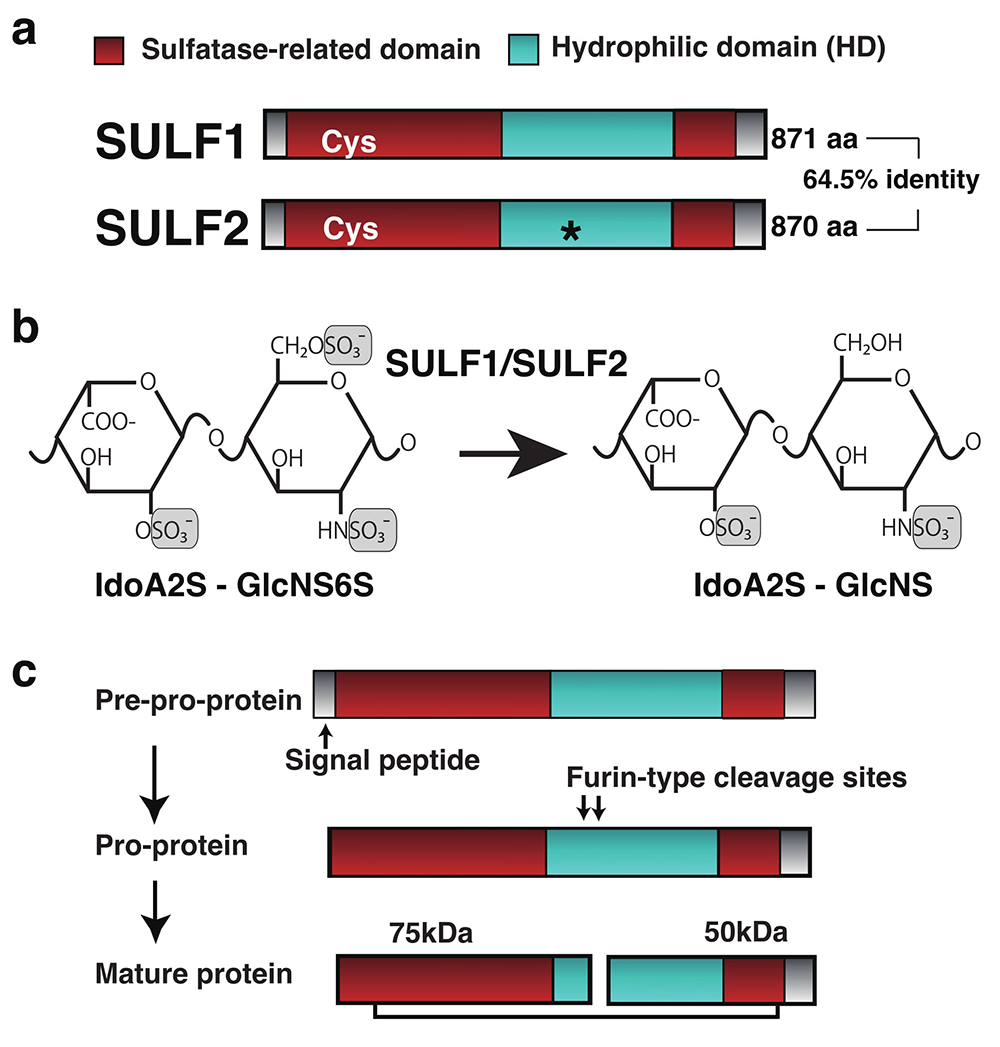
図 1. 細胞外スルファターゼSULF1/SULF2の構造と酵素反応様式
a. ヒトSULF1、SULF2にはα−ホルミルグリシンに変換されるシステイン残基(Cys)が保存されている。ある条件下において、SULF2がコンドロイチン硫酸付加修飾を受けることが知られている(*)。
b. SULF1、SULF2はHS糖鎖内部「S−ドメイン」のIdoA2S-GlcNS6Sの6位硫酸基を遊離する。
c. SULF1/SULF2は小胞体においてシグナルペプチドが切断されプロタンパク質となる。親水性領域(HD)内に存在するFurinプロテアーゼ部位においてプロテアーゼ切断を受ける。これらはジスルフィド結合により連結し、細胞外へ分泌されるか細胞表面に局在する。Furinプロテアーゼ切断はSULF1/SULF2のスルファターゼ活性に影響を与えないが、脂質ラフトへの局在およびWntシグナル伝達促進作用には必須である。
|
SULF1およびSULF2が多くのタンパク質リガンドのヘパリンまたはHS糖鎖への結合を調節していることが明らかにされている(4, 11)。血管内皮増殖因子(VEGF)165、ケモカインC-X-Cモチーフ型リガンド12(CXCL12)、ケモカインC-C モチーフ型リガンド21(CCL21)の固相化ヘパリンへの結合が、SULF2前処理により消失または減少する。さらに、SULF2は固相化ヘパリンに結合したこれらリガンド分子を結合複合体から遊離する作用をもつ。細胞表面や細胞外マトリックスのHSプロテオグリカンに隔離又は貯留されているリガンド分子をSULF1もしくはSULF2が遊離させ、その受容体を発現する細胞への作用を促進するメカニズムの存在が提唱されている。骨形成タンパク質(BMP)のアンタゴニストとしてはたらくNogginがHS糖鎖との結合により細胞表面に限局されているとき、結合分子であるBMPは細胞表面のNogginに強固に捕捉される。SULF1によりNogginの細胞表面での限局が解かれると、BMPのその受容体への到達が容易となり、BMPシグナルの活性化が起こると考えられている。SULF1がNogginの局在をコントロールすることにより、BMPシグナルの受容を細胞レベルで選択している可能性がある。SULF1もしくはSULF2により正に制御されるリガンド分子とは対照的に、ヘパリン結合性上皮成長因子(HB-EGF)、線維芽細胞増殖因子2(FGF2)、肝細胞増殖因子(HGF)のシグナル伝達はSULF1もしくはSULF2発現細胞で負に制御される。細胞表面におけるリガンド-HS-受容体の複合体形成を困難にすることにより、細胞内への増殖シグナルの減少を誘導している可能性がある(11-15)。Sulf1とSulf2の重複分布と、それぞれのSulfが他方の欠失を補う能力は、マウスの発生において示されている。Sulf1とSulf2の二重欠損マウスでは、Sulf1もしくはSulf2の単一欠損マウスに比べて、発生過程の特定の組織で表現型異常がより深刻である(16-22)。病気の発症や進行など、異なる状態におけるSULF1およびSULF2の個々の機能と機能的協調性は今後の課題である。
ヒトがんにおけるSULF1、SULF2の発現上昇が広く報告されている。SULF1は肝細胞がん、膵臓がん、頭頸部扁平上皮がん、胃がん、肺腺がん、肺扁平上皮がんで発現が増加している。SULF2は、肝細胞がん、肺腺がん、肺扁平上皮がんで発現が増加している。SULF1およびSULF2のスプライシングバリアントの生成も報告されている。詳細は他文献を参照されたい(4, 11, 23-27)。ヒトがんにおいてSULF1およびSULF2は腫瘍促進的に作用することも抑制的に作用することもあると考えられている。対象となる疾患においてどのような分子シグナリングが発症および進行において支配的なのかがわかれば、SULF1およびSULF2の病因病態への関与の解明につながる。
内村 健治(フランス国立科学研究センター構造機能糖鎖生物学研究部門)
| References |
| (1) |
Morimoto-Tomita M, Uchimura K, Werb Z, Hemmerich S, Rosen SD: Cloning and characterization of two extracellular heparin-degrading endosulfatases in mice and humans. J. Biol. Chem. 277, 49175-49185, 2002 |
| (2) |
Saad OM, Ebel H, Uchimura K, Rosen SD, Bertozzi CR, Leary JA: Compositional profiling of heparin/heparan sulfate using mass spectrometry: Assay for specificity of a novel extracellular human endosulfatase. Glycobiology 15, 818-826, 2005 |
| (3) |
Tang R, Rosen SD: Functional consequences of the subdomain organization of the sulfs. J. Biol. Chem. 284, 21505-21514, 2009 |
| (4) |
Rosen SD, Lemjabbar-Alaoui H: Sulf-2: an extracellular modulator of cell signaling and a cancer target candidate. Expert Opin. Ther. Targets 14, 935-949, 2010 |
| (5) |
Nagamine S, Keino-Masu K, Shiomi K, Masu M: Proteolytic cleavage of the rat heparan sulfate 6-O-endosulfatase SulfFP2 by furin-type proprotein convertases. Biochem. Biophys. Res. Commun. 391, 107-112, 2010 |
| (6) |
El Masri R, Seffouh A, Roelants C, Seffouh I, Gout E, Perard J, Dalonneau F, Nishitsuji K, Noborn F, Nikpour M, Larson G, Cretinon Y, Friedel-Arboleas M, Uchimura K, Daniel R, Lortat-Jacob H, Filhol O, Vives RR: Extracellular endosulfatase Sulf-2 harbors a chondroitin/dermatan sulfate chain that modulates its enzyme activity. Cell Rep. 38, 110516, 2022 |
| (7) |
Ai X, Do AT, Kusche-Gullberg M, Lindahl U, Lu K, Emerson CP, Jr.: Substrate specificity and domain functions of extracellular heparan sulfate 6-O-endosulfatases, QSulf1 and QSulf2. J. Biol. Chem. 281, 4969-4976, 2006 |
| (8) |
Frese MA, Milz F, Dick M, Lamanna WC, Dierks T: Characterization of the human sulfatase Sulf1 and its high affinity heparin/heparan sulfate interaction domain. J. Biol. Chem. 284, 28033-28044, 2009 |
| (9) |
Hossain MM, Hosono-Fukao T, Tang R, Sugaya N, van Kuppevelt TH, Jenniskens GJ, Kimata K, Rosen SD, Uchimura K: Direct detection of HSulf-1 and HSulf-2 activities on extracellular heparan sulfate and their inhibition by PI-88. Glycobiology 20, 175-186, 2010 |
| (10) |
Dhoot GK, Gustafsson MK, Ai X, Sun W, Standiford DM, Emerson CP, Jr.: Regulation of Wnt signaling and embryo patterning by an extracellular sulfatase. Science 293, 1663-1666, 2001 |
| (11) |
Hammond E, Khurana A, Shridhar V, Dredge K: The Role of Heparanase and Sulfatases in the Modification of Heparan Sulfate Proteoglycans within the Tumor Microenvironment and Opportunities for Novel Cancer Therapeutics. Front. Oncol. 4, 195, 2014 |
| (12) |
Viviano BL, Paine-Saunders S, Gasiunas N, Gallagher J, Saunders S: Domain-specific modification of heparan sulfate by Qsulf1 modulates the binding of the bone morphogenetic protein antagonist Noggin. J. Biol. Chem. 279, 5604-5611, 2004 |
| (13) |
Otsuki S, Hanson SR, Miyaki S, Grogan SP, Kinoshita M, Asahara H, Wong CH, Lotz MK: Extracellular sulfatases support cartilage homeostasis by regulating BMP and FGF signaling pathways. Proc. Natl. Acad. Sci. U S A 107, 10202-10207, 2010 |
| (14) |
Wang S, Ai X, Freeman SD, Pownall ME, Lu Q, Kessler DS, Emerson CP, Jr.: QSulf1, a heparan sulfate 6-O-endosulfatase, inhibits fibroblast growth factor signaling in mesoderm induction and angiogenesis. Proc. Natl. Acad. Sci. U S A 101, 4833-4838, 2004 |
(15) |
Lai JP, Sandhu DS, Yu C, Han T, Moser CD, Jackson KK, Guerrero RB, Aderca I, Isomoto H, Garrity-Park MM, Zou H, Shire AM, Nagorney DM, Sanderson SO, Adjei AA, Lee JS, Thorgeirsson SS, Roberts LR: Sulfatase 2 up-regulates glypican 3, promotes fibroblast growth factor signaling, and decreases survival in hepatocellular carcinoma. Hepatology 47, 1211-1222, 2008 |
| (16) |
Ai X, Kitazawa T, Do AT, Kusche-Gullberg M, Labosky PA, Emerson CP, Jr.: SULF1 and SULF2 regulate heparan sulfate-mediated GDNF signaling for esophageal innervation. Development 134, 3327-3338, 2007 |
| (17) |
Holst CR, Bou-Reslan H, Gore BB, Wong K, Grant D, Chalasani S, Carano RA, Frantz GD, Tessier-Lavigne M, Bolon B, French DM, Ashkenazi A: Secreted sulfatases Sulf1 and Sulf2 have overlapping yet essential roles in mouse neonatal survival. PLoS ONE 2, e575, 2007 |
| (18) |
Ratzka A, Kalus I, Moser M, Dierks T, Mundlos S, Vortkamp A: Redundant function of the heparan sulfate 6-O-endosulfatases Sulf1 and Sulf2 during skeletal development. Dev. Dyn. 237, 339-353, 2008 |
| (19) |
Hayano S, Kurosaka H, Yanagita T, Kalus I, Milz F, Ishihara Y, Islam MN, Kawanabe N, Saito M, Kamioka H, Adachi T, Dierks T, Yamashiro T: Roles of heparan sulfate sulfation in dentinogenesis. J. Biol. Chem. 287, 12217-12229, 2012 |
| (20) |
Freeman SD, Keino-Masu K, Masu M, Ladher RK: Expression of the heparan sulfate 6-O-endosulfatases, Sulf1 and Sulf2, in the avian and mammalian inner ear suggests a role for sulfation during inner ear development. Dev. Dyn. 244, 168-180, 2015 |
| (21) |
Takashima Y, Keino-Masu K, Yashiro H, Hara S, Suzuki T, van Kuppevelt TH, Masu M, Nagata M: Heparan sulfate 6-O-endosulfatases, Sulf1 and Sulf2, regulate glomerular integrity by modulating growth factor signaling. Am. J. Physiol. Renal Physiol. 310, F395-408, 2016 |
| (22) |
Okada T, Keino-Masu K, Nagamine S, Kametani F, Ohto T, Hasegawa M, van Kuppevelt TH, Kunita S, Takahashi S, Masu M: Desulfation of Heparan Sulfate by Sulf1 and Sulf2 Is Required for Corticospinal Tract Formation. Sci. Rep. 7, 13847, 2017 |
(23) |
Lemjabbar-Alaoui H, van Zante A, Singer MS, Xue Q, Wang YQ, Tsay D, He B, Jablons DM, Rosen SD: Sulf-2, a heparan sulfate endosulfatase, promotes human lung carcinogenesis. Oncogene 29, 635-646, 2010 |
| (24) |
Phillips JJ, Huillard E, Robinson AE, Ward A, Lum DH, Polley MY, Rosen SD, Rowitch DH, Werb Z: Heparan sulfate sulfatase SULF2 regulates PDGFRalpha signaling and growth in human and mouse malignant glioma. J. Clin. Invest. 122, 911-922, 2012 |
| (25) |
Gill RM, Mehra V, Milford E, Dhoot GK: Short SULF1/SULF2 splice variants predominate in mammary tumours with a potential to facilitate receptor tyrosine kinase-mediated cell signalling. Cell Biol. 146, 431-444, 2016 |
| (26) |
Yang Y, Ahn J, Edwards NJ, Benicky J, Rozeboom AM, Davidson B, Karamboulas C, Nixon KCJ, Ailles L, Goldman R: Extracellular Heparan 6-O-Endosulfatases SULF1 and SULF2 in Head and Neck Squamous Cell Carcinoma and Other Malignancies. Cancers (Basel) 14, 2022 |
| (27) |
Luo X, Campbell NA, He L, O'Brien DR, Singer MS, Lemjabbar-Alaoui H, Ahn KS, Smoot R, Torbenson MS, Rosen SD, Roberts LR: Sulfatase 2 (SULF2) Monoclonal Antibody 5D5 Suppresses Human Cholangiocarcinoma Xenograft Growth Through Regulation of a SULF2-Platelet-Derived Growth Factor Receptor Beta-Yes-Associated Protein Signaling Axis. Hepatology 74, 1411-1428, 2021 |
2023年 6月15日
|
|---|







