 |
ヒアルロン酸合成酵素(HAS)遺伝子を欠損するノックアウト(KO)マウスは、実験動物や疾患モデル動物として、個体におけるヒアルロン酸(HA)の機能を解析するための強力なツールである。3種のHAS遺伝子のうち、Has1やHas3遺伝子を欠損するマウスは、生存可能で繁殖力もあるため、成体における機能解析が可能である。一方、Has2 KOマウスは、主に心臓の形成不全、卵黄嚢の異形成や血管形成の異常により、胚発生9.5日目に胎生致死となる(1)。心臓の形態形成において、心房と心室を結ぶ房室管で心内膜隆起が形成される。Has2 KO胚では、心内膜隆起形成の間、心内膜細胞から間葉系細胞への転換が障害されている(図1)。時間的、組織特異的な遺伝子欠損を可能にするコンディショナルノックアウト(cKO)マウスは、各胚発生時期あるいは成体において、組織特異的な方法でHas2の役割を解析するために有用である。
Has1 KOとHas1/Has3ダブルKO(dKO)マウスは、アキレス腱の形態に顕著な違いを示さないが、HAリッチな液体で満たされた後踵骨滑液包の出生後の形成が阻害される(2)。このことは、Has1によるHA代謝が、後踵骨滑液包の形成や維持に重要な役割を果たしていることを示唆している。
Has1/Has3 dKOマウスの創傷治癒モデルでは、皮膚創傷部位の閉鎖が促進される(3)。この異常な創傷治癒と一致して、dKOマウスでは、表皮と真皮のHAの著しい減少と皮膚血管からの好中球の流出増加、そして筋線維芽細胞分化の促進がみられる。皮膚創傷治癒において筋線維芽細胞分化は重要な過程であり、TGF-βシグナル伝達経路がその過程を制御する。Has1/Has3 dKOマウスから分離した初代皮膚線維芽細胞では、p38 MAPキナーゼの活性化を介した非古典的なTGF-βシグナル伝達経路が、筋線維芽細胞分化を促進している。
HAは脳の細胞外マトリックスの主要な構成成分である。Has1 KO、Has2 cKOおよびHas3 KOマウスは、いずれもてんかん様活動を示す。このうち、Has3 KOマウスはてんかん発作の頻度が最も高く、海馬のHAマトリックスの著しい減少を示した(4)。その高い水和力のため、HAの欠乏は脳の細胞外スペース容積の減少をもたらす。細胞外スペース容積の減少は、主にエファプス相互作用の増強と細胞外カリウム濃度の上昇により、てんかん様活動を促進すると考えられる。
アポリポタンパク質E(ApoE)KOマウスでは、アテローム性動脈硬化病変に集積するマクロファージにおいて、Has3の発現が増加する。Has3/ApoE dKOマウスでは、動脈硬化病変におけるマクロファージの集積と炎症が減少し、アテローム性動脈硬化症の発症が軽減する(5)。また、Has3 KOマウスの頸動脈結紮モデルでは、動脈中膜におけるHAの蓄積が減少し、新生内膜の過形成が強く抑制される(5)。Has3 KOマウスでは、血管平滑筋細胞の活性化や遊走に関連する遺伝子の発現が減少していることから、新生内膜の過形成にHas3の合成するHAの関与が示唆されている。虚血・再灌流による心筋梗塞モデルでは、Has3遺伝子の欠損により心筋の収縮機能が低下し、心不全の症状を示す(6)。心筋梗塞の治癒過程において、CD4陽性T細胞サブセットが重要なはたらきをもつとされるが、Has3 KOマウスの心臓では、心筋梗塞後、CD4陽性T細胞サブセットであるTh1細胞とTreg細胞が共に減少している。このことは、心筋梗塞後の心臓治癒において、Has3の合成するHAが、生理的なT細胞の反応制御に重要な決定因子であることを示唆している。
発生中の四肢においてHas2遺伝子を組織特異的に欠損させると、四肢骨格の成長、指のパターン形成、軟骨細胞の成熟、および関節形成に異常が生じる(7)。Has2変異マウスの四肢では、骨格は著しく短くなり、近位指骨は二重となる。さらに、変異マウスでは骨格の成長板が著しく乱れ、肥大化軟骨細胞の数が著しく減少する。このことは、Has2の合成するHAが、骨格の成長と成熟において、細胞外マトリックスの主要成分として極めて重要な機能をもつことを示唆している。
以上のように、Has KOマウスの解析から、胚発生や形態形成、創傷治癒におけるHAの生理機能や、てんかんや動脈硬化などの疾患におけるHA代謝の意義が明らかとなってきた。今後、Has KOマウスの詳細な解析により、HAの多様な機能の全貌が明らかになることが期待される。
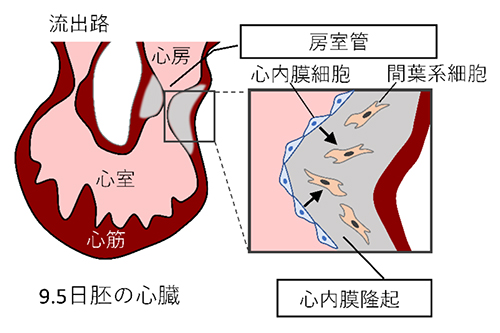
図1.心臓の形態形成における心内膜から間葉系への転換
心臓の形態形成の間、房室管の心内膜細胞は間葉系細胞へと転換し、心内膜隆起に侵入してリモデリングする。HAに富む細胞外マトリックスは、心内膜隆起の形成に関与する細胞の移動と転換に重要な役割を果たす。
|
板野 直樹(京都産業大学生命科学部)
| References |
| (1) |
Camenisch TD, Spicer AP, Brehm-Gibson T, Biesterfeldt J, Augustine ML, Calabro A Jr, Kubalak S, Klewer SE, McDonald JA: Disruption of hyaluronan synthase-2 abrogates normal cardiac morphogenesis and hyaluronan-mediated transformation of epithelium to mesenchyme. J. Clin. Invest. 106, 349-360, 2000 |
| (2) |
Sikes KJ, Renner K, Li J, Grande-Allen KJ, Connell JP, Cali V, Midura RJ, Sandy JD, Plaas A, Wang VM: Knockout of hyaluronan synthase 1, but not 3, impairs formation of the retrocalcaneal bursa. J. Orthop. Res. 36, 2622-2632, 2018 |
| (3) |
Mack JA, Feldman RJ, Itano N, Kimata K, Lauer M, Hascall VC, Maytin EV: Enhanced inflammation and accelerated wound closure following tetraphorbol ester application or full-thickness wounding in mice lacking hyaluronan synthases Has1 and Has3. J. Invest. Dermatol. 132, 198-207, 2012 |
| (4) |
Arranz AM, Perkins KL, Irie F, Lewis DP, Hrabe J, Xiao F, Itano N, Kimata K, Hrabetova S, Yamaguchi Y: Hyaluronan deficiency due to Has3 knock-out causes altered neuronal activity and seizures via reduction in brain extracellular space. J. Neurosci. 34, 6164-6176, 2014 |
| (5) |
Fischer JW: Role of hyaluronan in atherosclerosis: Current knowledge and open questions. Matrix Biol. 78-79, 324-336, 2019 |
| (6) |
Piroth M, Gorski DJ, Hundhausen C, Petz A, Gorressen S, Semmler D, Zabri H, Hartwig S, Lehr S, Kelm M, Jung C, Fischer JW: Hyaluronan synthase 3 is protective after cardiac ischemia-reperfusion by preserving the T cell response. Matrix Biol. 112, 116-131, 2022 |
| (7) |
Matsumoto K, Li Y, Jakuba C, Sugiyama Y, Sayo T, Okuno M, Dealy CN, Toole BP, Takeda J, Yamaguchi Y, Kosher RA: Conditional inactivation of Has2 reveals a crucial role for hyaluronan in skeletal growth, patterning, chondrocyte maturation and joint formation in the developing limb. Development 136, 2825-2835, 2009 |
2023年 6月15日
|
|---|







