この作品はクリエイティブ・コモンズ 表示 4.0 |
 |
|---|
ヘパラン硫酸/ヘパリンの生合成機構 | ||||||||||||||
 |
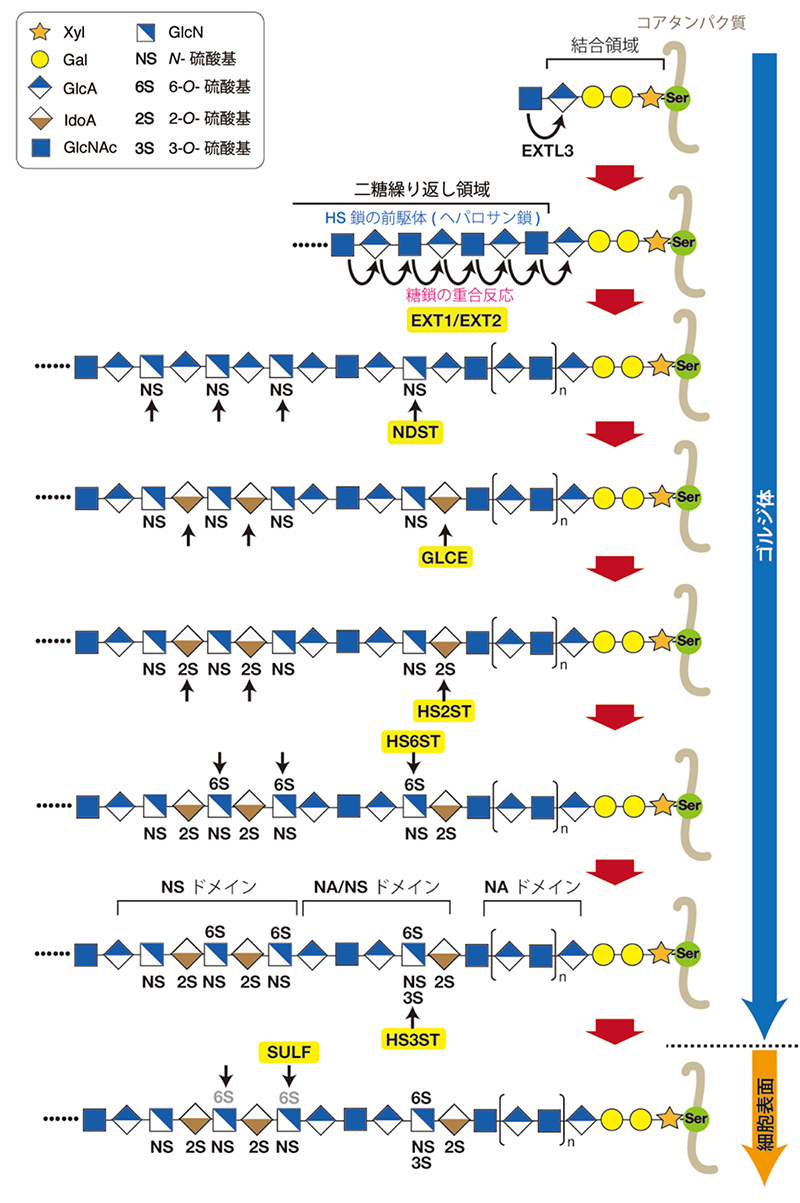
ヘパラン硫酸(HS)はプロテオグリカン(PG)として体内のいたるところに存在し、成長因子やモルフォゲンなどを含む多くのタンパク質リガンドと相互作用することによって細胞機能の制御に関わる (1)。 ヘパリン(Hep)はHSと共通の骨格構造をもつが、硫酸化の度合いと発現部位が異なっており、HepはHSよりも高度に硫酸化され、その発現は肥満細胞に限局されている。肥満細胞に存在するHepは、ヒスタミンやプロテアーゼなどの分泌顆粒に含まれる成分の貯蔵にはたらいている。硫酸化の程度や発現部位は異なるが、HSとHepは同じ生合成経路でつくられる。 図1に示すように (2-4)、HS鎖はコアタンパク質のセリン残基に、グリコサミノグリカンとコアタンパク質をつなぐ橋渡し四糖構造GlcAβ1-3Galβ1-3Galβ1-4Xylβ1-O-Ser(“グリコサミノグリカン鎖に共通の糖―タンパク質結合領域を構成する四糖構造の生合成機構”の項目を参照)を介して共有結合している(GlcA, グルクロン酸; Gal, ガラクトース; Xyl, キシロース; Ser, セリン)。この結合領域四糖に、N-アセチルグルコサミン(GlcNAc)残基がExostosin-like 3(EXTL3)によって転移すると (5)、これに続いてEXT1とEXT2からなるポリメラーゼ複合体によりGlcAとGlcNAcが交互に転移されながらヘパロサン鎖の伸長反応が起こり、HSの骨格構造である二糖繰り返し領域 [(-4GlcAβ1-4GlcNAcα1-)n] がつくられる。ヘパロサン鎖は伸長される間にN-脱アセチル化/N-硫酸化酵素(NDSTs: N-deacetylase/N-sulfotransferases)、 ᴅ-グルクロン酸C5-異性化酵素(GLCE)および種々のO-硫酸基転移酵素(HS2ST, HS6STs, HS3ST)などの多数の修飾酵素によって前駆体のヘパロサンから成熟HSに変換される。どの硫酸基転移酵素も、3′-ホスホアデノシン5′-ホスホ硫酸(PAPS)を硫酸基供与体として利用し、糖残基の特定の位置に硫酸基を転移する。合成後に、6-O-硫酸基を加水分解する細胞膜結合性エンド型脱硫酸化酵素 SULF1およびSULF2 によって硫酸化糖鎖構造が編集される場合、あるいはヘパラナーゼによって切断され、HSが断片化される場合がある (3). 特異的な硫酸化パターンは様々なタンパク質によって認識され、この糖―タンパク質間の特異的相互作用が、HSが担う多彩な生理機能の基盤となっている。 上述したように、重合反応でつくられるHS前駆体はヘパロサン鎖である。続いて、二糖繰り返し領域内のGlcNAc残基がNDSTsによってグルコサミン(GlcN)を経て N-硫酸化グルコサミン(GlcNS)に変換される。GlcNS残基に隣接するGlcA残基は高い確率でイズロン酸(IdoA)に異性化される。これらの修飾反応の結果生じたGlcNS/IdoAを豊富に含むドメイン(NSドメイン)は、さらにO-硫酸基転移酵素群によって修飾を受け、NSドメインの構造に多様性が生み出される。成熟したHS鎖内には、上述した修飾反応を受けずに未修飾のまま残った二糖単位(GlcA-GlcNAc)が並ぶ領域(NAドメイン)が存在する。それゆえ、HS鎖には、N位がアセチル化された二糖から構成される領域(NAドメイン)、N位が硫酸化された二糖が高密度に存在する領域 (NSドメイン)、N位が硫酸化された二糖とN位がアセチル化された二糖が混在する領域(NA/NSドメイン)、このような3種類の特徴的なドメイン構造が存在する (2)。NSドメインは、1本の HS鎖の一部に限局するわけでなく、NAドメインが介在することによりHS鎖の所々に散在している。NA/NSドメインは、NSドメインと NAドメインの接する遷移領域に存在する。HS結合配列をもった多くのタンパク質はHS鎖中のNSドメインと相互作用することが知られている。NAドメインは、HS鎖中にNSドメインを適当な間隔で配置するためにはたらくと考えられている。
灘中 里美 / 北川 裕之(神戸薬科大学 生化学研究室)
|
|||||||||||||
2023年12月13日