 |
コンドロイチン硫酸(CS)鎖およびデルマタン硫酸(DS)鎖は、代表的な硫酸化グリコサミノグリカン(GAG)多糖であり、一群のコアタパク質に共有結合したプロテオグリカン(PG)の形で存在している。CSPGおよびDSPGは、細胞表面や細胞外マトリックスに普遍的に分布し、細胞の様々な機能を支える微小環境形成の一翼を担っている。こうしたCSPGおよびDSPGの多彩な機能の多くは、生合成酵素群の協調的あるいは競合的なはたらきによって構造多様性を獲得したCS/DS鎖部分を介して発揮される(1, 2)。CS鎖は、グルクロン酸(GlcA)とN–アセチルガラクトサミン(GalNAc)の二糖ユニットが繰り返した、単純で直鎖状の糖鎖骨格(コンドロイチン:Chn)から成る。一方、DS鎖は、CS鎖の構造異性体に相当し、GlcAの代わりにイズロン酸(IdoA)を含む。こうしたGAG鎖のIdoA含有率は、生物種や組織によって様々であり、しばしばCS/DSハイブリッド糖鎖として存在している(1)。
CS鎖の糖鎖骨格の生合成は、CS/DS鎖とコアタンパク質との橋渡しの役割を果たす特徴的な四糖構造(GlcA-Gal-Gal-Xyl、本シリーズ「グリコサミノグリカン鎖に共通の糖―タンパク質結合領域を構成する四糖構造の生合成機構」を参照)の非還元末端のGlcA残基にGalNAcが転移されることにより開始される。この最初のGalNAcの転移は、GalNAc転移酵素I(GalNAcT-I)によって触媒される。CS鎖の繰返し二糖領域は、GlcAとGalNAcが交互に転移していくことにより形成され、それぞれの単糖転移は、GlcA転移酵素II(GlcAT-II)とGalNAc転移酵素II(GalNAcT-II)によって担われる。GlcAT-IIとGalNAcT-IIの両酵素活性は、構造的に類似した6つの糖転移酵素群(コンドロイチン合成酵素:ChSy-1、ChSy-2、ChSy-3、コンドロチン重合化因子:ChPF、コンドロチンGalNAc転移酵素:ChGn-1、ChGn-2)の協働的はたらきにより発揮されることが証明されている(1, 2)。各酵素の遺伝子名や別名表記については表1にまとめた。In vitroにおいて、前者4つ(ChSy-1、ChSy-2、ChSy-3、ChPF)のうち、いずれか2つの組み合わせでChnの重合化が促進されることから、これらの酵素は、“Chn重合化酵素”としての役割を担っている(図1)。一方、後者2つの酵素(ChGn-1、ChGn-2)には、Chnの重合化活性はなく、むしろChn/CS鎖の鎖長や本数を制御してCS鎖の発現量を微調整する役割があり、このはたらきには、後述するChn 4-O-硫酸基転移酵素(C4ST)との協調作用が不可欠である(図1)。
Chnの糖鎖骨格は、硫酸化やウロン酸の異性化などの修飾を受けて成熟体へと変貌する。Chnの硫酸化は、参画する硫酸基転移酵素の基質特異性に基づき、“4-O-硫酸化経路”と“6-O-硫酸化経路”の2つに分類される(1-3)。まず、基本骨格の二糖ユニットであるOユニット[GlcA-GalNAc]が、反応特性の異なる2種類の硫酸基転移酵素の共通基質となって硫酸化が進行する(図1)。すなわち、C4STにより、Oユニット中のGalNAcの4位が硫酸化されるとAユニット[GlcA-GalNAc(4-O-硫酸)]が、Chn 6-O-硫酸基転移酵素(C6ST)により、GalNAcの6位が硫酸化されるとCユニット[GlcA-GalNAc(6-O-硫酸)]が形成される。さらに、Aユニットの一部がGalNAc 4-硫酸6-O-硫酸基転移酵素(GalNAc4S-6ST)により硫酸化されると、Eユニット[GlcA-GalNAc(4,6-O-ジ硫酸)]が、Cユニットの一部がウロン酸2-O-硫酸基転移酵素(UST)により硫酸化されると、Dユニット[GlcA(2-O-硫酸)-GalNAc(6-O-硫酸)]が形成される(表1、図1)。興味深いことに、この2つの硫酸化経路の選択的指向性が、上述の四糖橋渡し構造中のキシロース残基のリン酸化を担うFAM20BおよびFAM20C(本シリーズ「グリコサミノグリカン鎖に共通の糖―タンパク質結合領域を構成する四糖構造の生合成機構」を参照)によって制御されうるという知見も最近得られている(4, 5)。
Chn基本糖鎖骨格中のGlcA残基は、2つのGlcA C5異性化酵素(DS-epi1、DS-epi2)の触媒作用によりIdoAに異性化されうる(表1、図1)。この異性化反応により、Chn鎖のDS鎖への構造転換が開始される(1-3)。CS鎖の構造異性体であるDS鎖は、IdoAを含む二糖ユニットをもつ点で特徴的である。IdoAを含む二糖ユニットとしては、生合成中間体であるiOユニット[IdoA-GalNAc]、その硫酸化誘導体であるiAユニット[IdoA-GalNAc(4-O-硫酸)]、iBユニット[IdoA(2-O-硫酸)-GalNAc(4-O-硫酸)]、iEユニット[IdoA -GalNAc(4,6-O-ジ硫酸)]が挙げられる(1-3)。DS-epiを介したウロン酸の異性化反応は可逆的であるため、デルマタン4-O-硫酸基転移酵素(D4ST)によるiOユニットの4-O-硫酸化(iAユニットの生成)には、生成したばかりのIdoAがGlcAに逆変換されてしまうのを防ぐ役割があるようである。iBユニットおよびiEユニットは、iAユニットのさらなる硫酸化により生合成される(図1)。
上述の生合成経路によって形成されるCS/DS鎖は、硫酸化パターンの異なる特徴的な二糖ユニット(O、A、C、D、E、iA、iB、iE)の組合せから構成される多糖と捉えることができ、構造多様性を示すようになる(図1)。この構造多様性こそが、CS/DS鎖の多様な機能を生み出す源となっている。
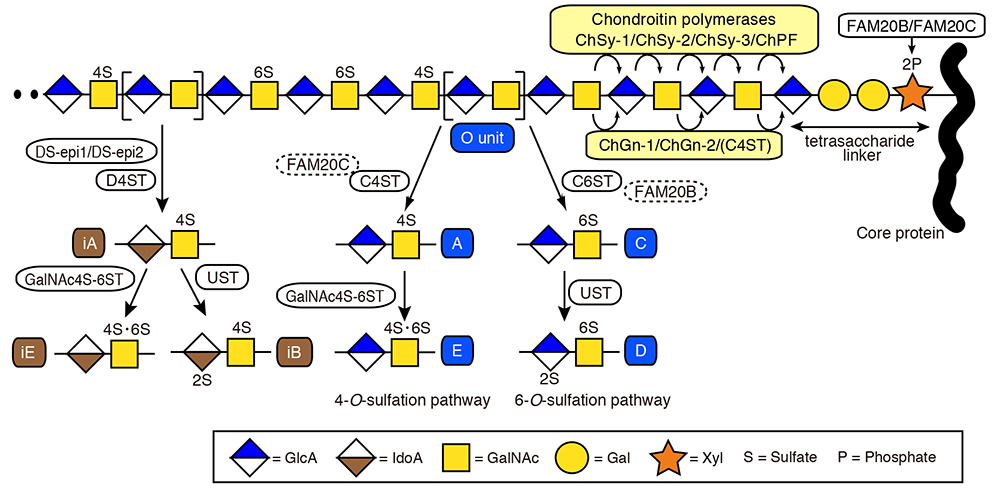
図 1. CS/DS鎖の生合成経路
Gal、Xylはそれぞれガラクトース、キシロースを表す。2S、4S、6Sは、それぞれ2位、4位、6位のヒドロキシ基が硫酸基で置換されること、2Pは、2位のヒドロキシ基がリン酸基で置換されることを示す。
|
表 1. ヒトにおけるCS/DS生合成酵素
| 酵素名 |
略称 |
遺伝子名 |
別名 |
コンドロイチン合成酵素 |
ChSy-1 |
CHSY1 |
— |
ChSy-2 |
CHSY2 |
CSS3 |
ChSy-3 |
CHSY3 |
CHPF2, CSGlcA-T |
コンドロイチン重合化因子 |
ChPF |
CHPF |
CSS2 |
コンドロチンGalNAc転移酵素 |
ChGn-1 |
CSGALNACT1 |
— |
ChGn-2 |
CSGALNACT2 |
— |
コンドロイチン4-O-硫酸基転移酵 |
C4ST-1 |
C4ST1 |
CHST11 |
C4ST-2 |
C4ST2 |
CHST12 |
C4ST-3 |
C4ST3 |
CHST13 |
デルマタン4-O-硫酸基転移酵素 |
D4ST-1 |
D4ST1 |
CHST14 |
コンドロイチン6-O-硫酸基転移酵素 |
C6ST-1 |
C6ST1 |
CHST3 |
ウロン酸2-O-硫酸基転移酵素 |
UST |
UST |
— |
GalNAc 4-硫酸6-O-硫酸基転移酵素 |
GalNAc4S-6ST |
GALNAC4S6ST |
CHST15, BRAG |
GlcA C5異性化酵素 |
DS-epi1 |
DSE |
SART2 |
DS-epi2 |
DSEL |
C18orf4 |
三上 雅久、北川 裕之(神戸薬科大学 生化学研究室)
| References |
| (1) |
Mikami T, Kitagawa H: Biosynthesis and function of chondroitin sulfate. Biochim. Biophys. Acta 1830, 4719-4733, 2013 |
| (2) |
Kitagawa H: Using sugar remodeling to study chondroitin sulfate function. Biol. Pharm. Bull. 37, 1705-1712, 2014 |
| (3) |
Kusche-Gullberg M, Kjellén L: Sulfotransferases in glycosaminoglycan biosynthesis. Curr. Opin. Struct. Biol. 13, 605-611, 2003 |
| (4) |
Kitazawa K, Nadanaka S, Kadomatsu K, Kitagawa H: Chondroitin 6-sulfate represses keratinocyte proliferation in mouse skin, which is associated with psoriasis. Commun. Biol. 4, 114, 2021 |
| (5) |
Koike T, Mikami T, Tamura JI, Kitagawa H: Altered sulfation status of FAM20C-dependent chondroitin sulfate is associated with osteosclerotic bone dysplasia. Nat. Commun. 13, 7952, 2022 |
2023年 6月15日
|
|---|







