 |
タンパク質や脂質の糖鎖修飾は段階的に起こり、ゴルジ装置内の糖転移酵素によって形成される。例えば、主要なタンパク質糖鎖修飾であるN型糖鎖修飾では、小胞体で新生糖タンパク質に結合した高マンノース型糖鎖が、小胞体内およびゴルジ装置内のマンノシダーゼによってトリミングされる。その後、N-アセチルグルコサミン、ガラクトース、フコース、シアル酸などを付加する糖転移酵素によって、糖鎖構造は多様化する。この複雑な糖鎖修飾の過程には、ゴルジ装置内で糖転移酵素がシステマティックに配置されて働く必要がある。例えば、N型糖鎖のトリミングを担うマンノシダーゼはゴルジ装置のシス側に局在し、糖鎖の非還元末端に結合するシアル酸の付加を担うシアル酸転移酵素はトランス側に分布している。ゴルジ装置はN型糖鎖修飾だけでなく、脂質の糖鎖付加やプロテオグリカン上のグリコサミノグリカン(GAG)鎖の伸長の場としても機能している。後藤らの研究によれば、ショウジョウバエではこれらの異なる糖鎖修飾の過程に関与するタンパク質が、細胞質全体に散在する異なるゴルジスタックに配置されている(1)。一方で、哺乳動物細胞ではゴルジ装置がゴルジリボンと呼ばれる単一の広範な構造を形成している。最近の電子顕微鏡技術の進展により、ゴルジ装置の構造が考えられていたよりも複雑であることが明らかになってきている(2)。こうした複雑なゴルジ体構造の中に糖転移酵素がそれぞれ独自の領域に分布していることが想定される。たとえば、最近我々は、トランス側に存在すると考えられていた3種類のシアル酸酵素がそれぞれゴルジ装置内で異なる分布をしていることを明らかにしている(3)。 また、原田らによって、ゴルジ体は、切断、融合、変形などダイナミックに変動する小さなユニットが集まったオルガネラであり、こうしたユニット内に糖転移酵素がそれぞれ独自のゾーンを形成して存在することが示されている(4)。
ゴルジ装置に存在する糖転移酵素は、触媒ドメイン、ステム領域、膜貫通領域、細胞質領域からなるII型膜タンパク質として存在する(図)。また、いくつかの糖転移酵素には触媒ドメインの隣にAdd-onドメインがあることが知られている(5)。
糖転移酵素の局在はゴルジ装置に存在する分子との相互作用によって規定される。例えば、リソソーム輸送に関わるマンノース6リン酸含有糖鎖の合成を担うGlcNAc-1-phosphotransferaseは、ゴルジ装置に局在するlysosomal enzyme trafficking factor(LYSET, TMEM251)との相互作用によりゴルジ装置に滞留している(6,7)。LYSET欠損細胞では、この酵素がゴルジ装置内に存在できず、リソソーム局在タンパク質に対するマンノース6リン酸含有糖鎖修飾の合成不全が起こり、リソソーム局在できなくなることが示されている。また、多くの糖転移酵素は単独で存在せず、トランスポーターや他の糖転移酵素と相互作用することも知られている("糖転移酵素の複合体形成による制御"の頁参照)。こうした相互作用によって糖転移酵素の局在が規定される可能性もあるが、どの領域が相互作用を担うかについての理解は限定的である。
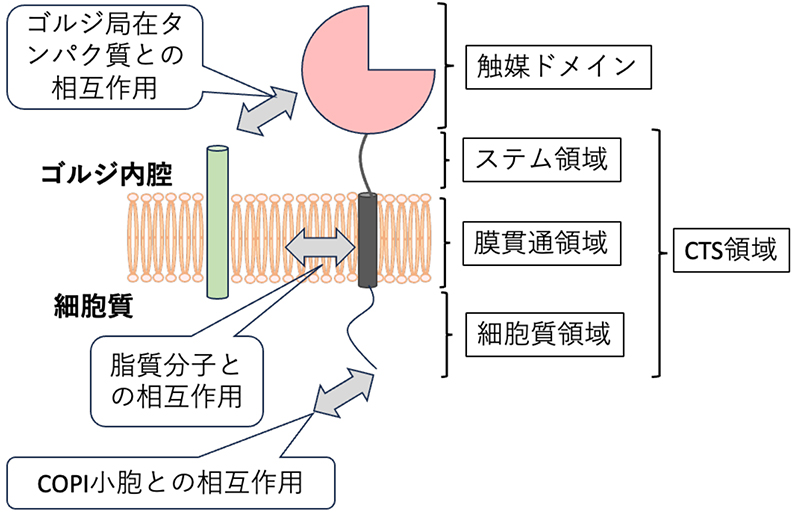
図:糖転移酵素のドメイン構造とその局在を規定する要因
|
膜タンパク質の局在は、膜を構成する脂質分子との相互作用の影響を受けるものと考えられている。電子顕微鏡像から、ゴルジ装置を構成する膜はシス槽からトランス槽に向けて厚みが増すことが知られている(8)。一方で、バイオインフォマティックス解析からも、トランス層に存在する糖転移酵素は、ERやシスゴルジに存在する酵素と比較して膜貫通領域が長い傾向にある(9)。こうしたことから、脂質膜の厚さに対応するように、膜内で安定する糖転移酵素の膜貫通部位の長さが規定され、各々特異的な分布を呈する可能性が想定される。特に糖転移酵素と局在を共にする脂質分子の同定が糖転移酵素の局在メカニズムの解明に重要であるが、分析方法が確立されていないことが現状である。
糖転移酵素の細胞質領域は、COPIコートサブユニットやCOPIアダプター分子(例えばGOLPH3/Vps74)と相互作用し、それらをゴルジ装置に保持することが知られている(10)。例えば、GALNT6の細胞質領域は"MRLLRR"配列が存在しており、これは、δ-COP の結合コンセンサス配列であるϕ-(K/R)-X-L-X-(K/R)に対応しており、δ-COPと直接相互作用することで、シス-ゴルジ装置に局在すると考えられている(11)。ST3GAL4とST6GAL1は細胞質領域の配列(L-X-X-R/K)を介してGOLPH3と相互作用することが示されている(12)。最近では、GOLPH3と同様な機能を持つと考えられるCOPIアダプター分子も見つかっており(13)、各分子の使い分けが注目されている。しかし、同じGOLPH3結合モチーフを持つ糖転移酵素でも、シス槽に存在するものやトランス槽に存在するものがあり、GOLPH3結合モチーフの有無だけでは、糖転移酵素の局在を説明することができない。
我々の研究結果から、B3GALT6とB4GALT1の細胞質、膜貫通、ステム(CTS)領域を入れ替えた組換え酵素とそれぞれの元の酵素との共局在を調べると、触媒ドメインではなくCTS領域を共有する酵素の方が、高い共局在度を示すことが明らかになっている(3)。しかしながら、共通するCTS領域を有する酵素であっても、完全には元の酵素と同じ局在を示しておらず、触媒ドメインによる局在への影響も考えられる。本稿で紹介したように糖転移酵素の局在は、触媒ドメイン、ステム領域、膜貫通領域、細胞質領域の様々な部位における他の分子との相互作用によって規定され、それらの複合的な影響によって決まる可能性がある。
これまでに個別の糖転移酵素の局在制御に関しては一定の知見が蓄積されているが、糖転移酵素の局在の総合的な理解には、より多くの酵素を対象とした網羅的な研究が必要であろう。
矢木 宏和(名古屋市立大学大学院薬学研究科)
| References |
| (1) |
Yano H, Yamamoto-Hino M, Abe M, Kuwahara R, Haraguchi S, Kusaka I, Awano W, Kinoshita-Toyoda A, Toyoda H, Goto S: Distinct functional units of the Golgi complex in Drosophila cells. Proc. Natl. Acad. Sci. U S A 102, 13467-13472, 2005
|
| (2) |
Koga D, Kusumi S, Yagi H, Kato K: Three-dimensional analysis of the intracellular architecture by scanning electron microscopy. Microscopy 73, 215-225, 2024
|
| (3) |
Yagi H, Tateo S, Saito T, Ohta Y, Nishi E, Obitsu S, Suzuki T, Seetaha S, Hellec C, Nakano A, Tojima T, Kato K: Deciphering the sub-Golgi localization of glycosyltransferases via 3D super-resolution imaging. Cell Struct. Funct. advpub, 24008, 2024
|
| (4) |
Harada A, Kunii M, Kurokawa K, Sumi T, Kanda S, Zhang Y, Nadanaka S, Hirosawa KM, Tokunaga K, Tojima T, Taniguchi M, Moriwaki K, Yoshimura SI, Yamamoto-Hino M, Goto S, Katagiri T, Kume S, Hayashi-Nishino M, Nakano M, Miyoshi E, Suzuki KGN, Kitagawa H, Nakano A: Dynamic movement of the Golgi unit and its glycosylation enzyme zones. Nat. Commun. 15, 4514, 2024
|
| (5) |
Yagi H, Takagi K, Kato K: Exploring Domain Architectures of Human Glycosyltransferases: Highlighting the Functional Diversity of Non-Catalytic Add-On Domains. Biochim. Biochim. Biophys. Acta Gen. Subj. in press.
|
| (6) |
Richards CM, Jabs S, Qiao W, Varanese LD, Schweizer M, Mosen PR, Riley NM, Klüssendorf M, Zengel JR, Flynn RA, Rustagi A, Widen JC, Peters CE, Ooi YS, Xie X, Shi PY, Bartenschlager R, Puschnik AS, Bogyo M, Bertozzi CR, Blish CA, Winter D, Nagamine CM, Braulke T, Carette JE: The human disease gene LYSET is essential for lysosomal enzyme transport and viral infection. Science 378, eabn5648, 2022
|
| (7) |
Pechincha C, Groessl S, Kalis R, de Almeida M, Zanotti A, Wittmann M, Schneider M, de Campos RP, Rieser S, Brandstetter M, Schleiffer A, Müller-Decker K, Helm D, Jabs S, Haselbach D, Lemberg MK, Zuber J, Palm W: Lysosomal enzyme trafficking factor LYSET enables nutritional usage of extracellular proteins. Science 378, eabn5637, 2022
|
| (8) |
Bykov YS, Schaffer M, Dodonova SO, Albert S, Plitzko JM, Baumeister W, Engel BD, Briggs JA: The structure of the COPI coat determined within the cell. Elife 6, e32493, 2017
|
| (9) |
Sharpe HJ, Stevens TJ, Munro S: A comprehensive comparison of transmembrane domains reveals organelle-specific properties. Cell 142, 158-169, 2010
|
| (10) |
Welch LG, Munro S: A tale of short tails, through thick and thin: investigating the sorting mechanisms of Golgi enzymes. FEBS Lett. 593, 2452-2465, 2019
|
| (11) |
Liu L, Doray B, Kornfeld S: Recycling of Golgi glycosyltransferases requires direct binding to coatomer. Proc. Natl. Acad. Sci. U S A 115, 8984-8989, 2018
|
| (12) |
Isaji T, Im S, Gu W, Wang Y, Hang Q, Lu J, Fukuda T, Hashii N, Takakura D, Kawasaki N, Miyoshi H, Gu J: An oncogenic protein Golgi phosphoprotein 3 up-regulates cell migration via sialylation. J. Biol. Chem. 289, 20694-20705, 2014
|
| (13) |
Welch LG, Peak-Chew SY, Begum F, Stevens TJ, Munro S: GOLPH3 and GOLPH3L are broad-spectrum COPI adaptors for sorting into intra-Golgi transport vesicles. J. Cell Biol. 220, e202106115, 2021
|
|
|---|







