

 |
 |
癌のプログレッションに伴うシアリルルイスx/a発現亢進の機構 |
||||||||||||||||||||||||||||||||||||||
 |
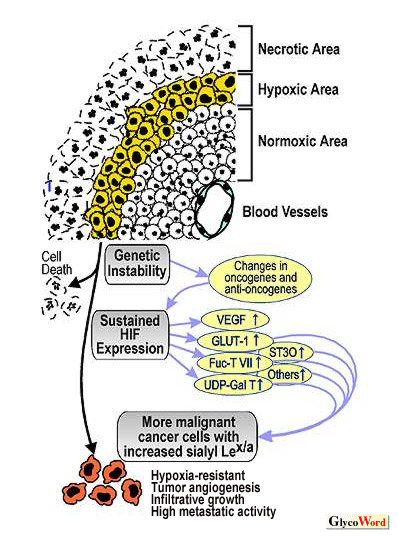
細胞の悪性化に伴って細胞表層の糖鎖に大きな変化が起こる。癌細胞ではシアリルルイスx/a糖鎖の発現が著明に亢進していることはよく知られている。これらの糖鎖は血管内皮細胞などに存在する細胞接着分子セレクチンのリガンドであり、癌細胞の血行性転移を引き起こす。 正常の上皮細胞には多様な糖鎖が発現しており、その一部はシアリルルイスx/aよりも複雑な構造をしている。たとえばシアリル6-スルホルイスxや2→3, 2→6ジシアリルルイスaなどが好例であり、これらはシアリルルイスx/a糖鎖にさらに修飾が加わった構造をもっている(1)。これらの複雑な構造の糖鎖は正常上皮細胞に発現して、シグレクをはじめとする糖鎖認識分子を発現する間質の細胞と上皮細胞の相互作用を媒介している(2)。これらの糖鎖に修飾にかかわる遺伝子の発現は、DNAのメチル化やヒストンの脱アセチル化などのエピジェネティック・サイレンシング機構によって発癌の早期に障害される。発癌の早期にシアリルルイスx/a糖鎖が出現するのは、このような正常細胞の複雑な糖鎖のいわゆる「合成不全現象」の結果である。「合成不全現象」とは、癌化に伴う糖鎖異常のメカニズムの一つとして1980年代の初頭に提唱された古典的なコンセプトである。 癌のプログレッションは長期間、しばしば年余にわたって進行する。癌の進行期においては、癌細胞に遺伝子異常が蓄積してゆき、浸潤能や転移性が強く悪性度のより高い癌細胞があらわれて選択的に増殖する。こうした癌のプログレッションにともなって癌細胞のシアリルルイスx/a糖鎖の発現はさらに増強する。 癌のプログレッションにともなって悪性度の高い癌細胞が選択的に増殖するメカニズムのひとつとして、低酸素に対する抵抗性があげられる。癌細胞は無秩序に増殖するため固形癌の病巣には十分に酸素がゆきわたらず、一部の癌細胞はかならず低酸素環境にさらされる(図1)。転写因子hypoxia inducible factor (HIF)のα鎖は通常の酸素濃度では細胞質でプロテアソームによって速やかに分解されるが、低酸素状態に遭遇すると核に移行する。移行したα鎖は核内でβ鎖とヘテロダイマーを形成したのち、細胞が低酸素に対する抵抗性を獲得するために必要な一連の遺伝子の転写を誘導する。正常細胞ではこれは可逆的な応答である。 しかし癌細胞の場合には、癌遺伝子や癌抑制遺伝子に遺伝的異常が蓄積して、そのためにHIFを構成的・非可逆的に強発現するようになった癌細胞クローンの出現をまねくことになる。 HIFが強発現すると糖代謝が好気的解糖から嫌気的解糖に偏倚する。いわゆるワールブルグ現象であり、解糖系の酵素やグルコース・トランスポーターGLUT1などの遺伝子の発現が誘導される。またHIFの強発現によってvascular endothelial growth factor (VEGF)の産生が増大し、腫瘍血管新生が引き起こされる。 |
|||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
|
最近我々は細胞を低酸素条件下で培養するとシアリルルイスx/a糖鎖の発現が誘導され、その結果E-セレクチンへの接着性も増大することを見いだした(3)。この現象にHIFが関与していることは、ドミナントネガティブ体のHIFを導入するとこれらの現象が観察されなくなることから明らかであった。DNAマイクロアレイとRT-PCRによる解析の結果、低酸素培養によってグルコース・トランスポーターGLUT1、UDP-ガラクトース・トランスポーターUGT1、フコース転移酵素FUT7、シアル酸転移酵素ST3Oなどの遺伝子発現が誘導されることが明らかになった(3)。 これらの結果から、進行期の癌細胞におけるシアリルルイスx/a糖鎖の発現増強は癌のプログレッションと密接に関係しており、より悪性度の高い癌細胞がこれらの糖鎖を発現する傾向をもつと考えられる。発癌の早期にエピジェネティックな遺伝子発現抑制によって出現したシアリルルイスx/a糖鎖が、進行期の癌でさらに発現増強をきたすのは、このメカニズムによっていると思われる。GLUT1, UGT1, FUT7, ST3Oなどの遺伝子の転写は、実際の大腸癌患者の手術材料においても非癌上皮細胞に比べて癌で増大しており、とくにDukes CやDの進行期の患者で増大が著明である(3, 4)。 このことは、HIFによるこれらの遺伝子発現の誘導が実際の患者癌組織においても起きていることを示唆している。 シアリルルイスx/a糖鎖とセレクチンを介した癌細胞と血管内皮細胞との接着は、以前から知られる血行性転移だけではなくて、癌病巣の脈管形成にも関与している可能性がある。癌病巣の脈管形成に対するこの細胞接着の意義をあきらかにするため、我々は最近、セレクチンを発現してシアリルルイスx/a陽性の癌細胞との接着能を持つ培養血管内皮細胞株を用いたin vivoのモデル実験を行った(5)。癌細胞にこの培養血管内皮細胞株を細胞数にして10:1の比で補充してヌードラット背に皮下移植すると、血管内皮細胞から生じた脈管構造が縦横に走る大きな癌腫瘤が生じた。脈管構造の内腔には宿主ヌードラット由来の血球が観察された。抗シアリルルイスx/a抗体を投与した場合には、同数の細胞を移植しているにもかかわらず、形成された癌腫瘤はきわめて小さく脈管を欠いており、血管内皮のみからなる独立した小腫瘤を随伴していた(5)。この実験結果は、シアリルルイスx/a糖鎖とセレクチンを介した細胞接着が、腫瘍の血管形成に深く関与していることを示すものである。 癌細胞はHIFを恒常的に発現し、これによってグルコ−ス代謝を嫌気的解糖にシフトさせ、他方でVEGFの産生を通じて血管の新生をうながし、低酸素抵抗性を獲得する。HIFによるシアリルルイスx/a糖鎖の発現増強も腫瘍巣の脈管形成をうながすという点から見て、こうした一連の変化の一環をなすものと思われる(6)。 |
||||||||||||||||||||||||||||||||||||||
| 神奈木玲児(愛知県がんセンター・分子病態学部) | ||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
| 2004年12月28日 | ||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||