 |
UGGTのフォールディングセンサー機能
小胞体で新生した糖タンパク質上の高マンノース型糖鎖は、様々な糖鎖プロセシング酵素の働きにより、タンパク質部分のフォールディング状態に応じて多様な構造に変換される。それらの糖鎖は糖タンパク質品質管理において、「フォールディング促進」「フォールディングチェック」「分泌経路への輸送」「分解経路への輸送」を制御するシグナルとして活用されている。UDP-Glucose: glycoprotein glucosyltransferase (UGGT) は、動物、植物、菌類、原生動物など様々な生物種に存在し、Man9GlcNAc2型糖鎖をもつ糖タンパク質を受容体基質として認識し、UDP-グルコースを供与体基質として糖鎖非還元末端にグルコースを1残基転移してGlc1Man9GlcNAc2型糖タンパク質へと変換する酵素活性を示す (図1A) (1)。その際、UGGTは受容体糖タンパク質のフォールディング状態を併せて識別し、ミスフォールドした糖タンパク質のみに選択的に糖転移するため、上記の「フォールディングチェック」段階を司るフォールディングセンサー酵素として重要な役割を担っている。UGGTの働きによって生成したGlc1Man9GlcNAc2型ミスフォールド糖タンパク質は、「フォールディング促進」段階を司るカルネキシンやカルレティキュリンというレクチン様分子シャペロンとERp57というタンパク質ジスルフィドイソメラーゼの複合体に受け渡され、正しくフォールディングできるようリサイクルされる。
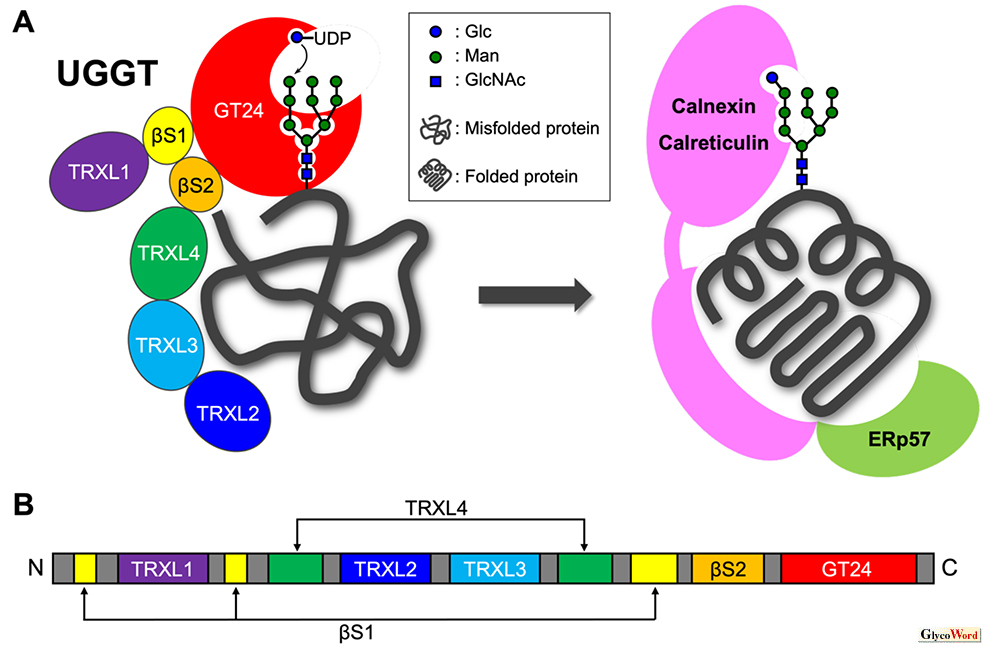
図1
(A) UGGTによる糖タンパク質グルコシル化は、糖タンパク質をカルネキシン/カルレティキュリンとERp57からなる複合体へとリサイクルする (B) UGGTのドメイン構造
UGGTの基質認識
UGGTは基質糖タンパク質を認識する際、どのような認識モチーフを必要としているであろうか?これまでに変性処理を施したチログロブリンや大豆凝集素、リボヌクレアーゼBといった天然糖タンパク質や、S-S結合を意図的に掛け替えることで安定なミスフォールド状態を再現した合成糖タンパク質がUGGTの基質として認識されることが知られている (2)。加えてMan9GlcNAc2糖鎖に疎水性アグリコンを導入した、合成非ペプチド性小分子がUGGTの良い基質となることも報告されている (3)。これらを総合すると、UGGTはミスフォールドタンパク質部分の認識モチーフとして、タンパク質表面に露出した疎水性パッチを認識しているものと考えられる。一方、糖鎖部分に関する認識モチーフとしては、様々な糖鎖部分構造と疎水性アグリコンを有する合成小分子群を用いた阻害実験により、Man9GlcNAc2糖鎖をもつ基質糖タンパク質中のMan3GlcNAc2コア構造を強く認識していることが明らかとなった (3)。
UGGTの構造
哺乳動物のUGGTは約160 kDa の可溶性の糖タンパク質であり、C末端側20%を占める触媒ドメインと、N末端側 80% を占めるフォールディングセンサー機能を有する基質認識ドメインから構成されている。触媒ドメインは Glycosyltrasferase family 24 と相同性を有し、基質認識ドメインは非常に柔軟性の高い4つのチオレドキシン様 (TRXL) ドメインで構成されている (図1B) (4)。触媒ドメインとTRXLドメインとの間は2つのβサンドイッチドメインが橋渡ししている。4つのTRXLドメイン同士の空間配座には柔軟性があり、その柔軟性が多様なミスフォールド糖タンパク質の受け入れに寄与している。また脊椎動物と線虫には2つのUGGTパラログとしてUGGT1 とUGGT2が見出されている。ヒトの場合、両者のアミノ酸配列相同性は55%であるが、触媒ドメインの相同性は70%以上と高い一致を示している。ヒトUGGT2はUGGT1と同様の糖転移活性を有しているが (5)、両者は対象とする基質糖タンパク質の違いによって使い分けられているようだ。さらにUGGT1およびUGGT2は Selenoprotein F (SelenoF) と1 : 1 で複合体を形成している。SelenoFがUGGTの機能に与える影響の詳細は明らかになっていないが、本タンパク質がUGGTの糖転移活性の向上に寄与する可能性が報告されている (5)。
展望
UGGTはMan9GlcNAc2型ミスフォールド糖タンパク質に対して選択的にグルコシル化する機能をもち、フォールディングセンサー酵素として糖タンパク質品質管理の中核を担っている。しかしながら同じMan9GlcNAc2型糖タンパク質に対して働き、糖鎖を分泌シグナル糖鎖あるいは分解シグナル糖鎖へと変換するEDEM1、EDEM2、EDEM3とUGGTとの競合を制御する分子メカニズムはいまだに未解明である。また、最近、糖転移過程でUGGT自身が分子シャペロンとしても機能し、基質糖タンパク質のフォールディングを加速することが示された (6)。糖タンパク質品質管理におけるUGGTの真の機能解明には、さらなる研究展開が期待される。
戸谷 希一郎(成蹊大学 理工学部)
| References |
| (1) |
D’Alessio C, Caramelo JJ, Parodi AJ: UDP-Glc:glycoprotein glucosyltransferase-glucosidase II, the ying-yang of the ER quality control. Semin. Cell. Dev. Biol., 21, 491-499, 2010. |
| (2) |
Izumi M, Kiuchi T, Ito Y, Kajihara Y: Misfolded glycoproteins as probes for analysis of folding sensor enzyme UDP-glucose:glycoprotein glucosyltransferase. Trends Glycosci. Glycotechnol., 25, 1-12, 2013.. |
| (3) |
Totani K, Ihara Y, Tsujimoto T, Matsuo I, Ito Y: The recognition motif of the glycoprotein-folding sensor enzyme UDP-Glc:glycoprotein glucosyltransferase. Biochemistry, 48, 2933-2940, 2009. |
| (4) |
Modenutti, CP, Capurro JIB, Ibba R, Alonzi DS, Song MN, Vasijević S, Kumar A, Chandran AV, Tax G, Marti L, Hill JC, Lia A, Hensen M, Waksman T, Rushton J, Rubichi S, Santino A, Maltí MA, Zitzmann N, Roversi P: Clamping, bending, and twisting inter-domain motions in the misfold-recognizing portion of UDP-glucose: glycoprotein glucosyltransferase. Structure, 29, 357-370, 2021. |
| (5) |
Takeda Y, Seko A, Hachisu M, Daikoku S, Izumi M, Koizumi A, Fujikawa K, Kajihara Y, Ito Y: Both isoform of human UDP-glucose:glycoprotein glucosyltransferase are enzymatically active. Glycobiology, 24, 344-350, 2014. |
| (6) |
Wang N, Seko A, Takeda Y, Ito Y: Glycan dependent refolding activity of ER glucosyltransferase (UGGT). Biochem. Biophys. Acta Gen. Subj. 1864, 129709, 2020. |
2023年 6月15日
|
|---|





