O-グリコシド型糖ペプチドを化学的に合成することは困難である。特に、長鎖のそして分枝した糖鎖を含む糖ペプチドの場合はなおさらである。そこで、酵素的に糖ペプチドを合成する方法も取り入れてみる。エンド型グリコシダーゼを用いてO-グリコシド型糖ペプチドを合成するには、大きく分けて2つの方法がある。1つは、化学的方法と酵素的方法を組み合わせた化学−酵素合成法、もう1つは酵素だけを用いた酵素合成法である。ここでは、化学的合成を使わないで、酵素(エンド− −N−アセチルガラクトサミニダーゼ, endo- −N−アセチルガラクトサミニダーゼ, endo- -GalNAc-ase)のみを使ってO-グリコシド型糖ペプチドを合成する方法について述べる。 -GalNAc-ase)のみを使ってO-グリコシド型糖ペプチドを合成する方法について述べる。
Endo- -GalNAc-aseは、糖タンパク質のセリン(スレオニン)残基に結合するO-結合型糖鎖とタンパク質との結合部位に作用して糖鎖を遊離するエンド型グリコシダ−ゼである。この酵素は、Clostridium perfringens, Diplococcus pneumoniae, Alcaligenes sp.,Bacillus sp. そしてStreptomyces sp. の培養液から見つけられたが、これらの酵素の基質特異性やアグリコン特異性は異なることが知られている。これらのendo- -GalNAc-aseは、糖タンパク質のセリン(スレオニン)残基に結合するO-結合型糖鎖とタンパク質との結合部位に作用して糖鎖を遊離するエンド型グリコシダ−ゼである。この酵素は、Clostridium perfringens, Diplococcus pneumoniae, Alcaligenes sp.,Bacillus sp. そしてStreptomyces sp. の培養液から見つけられたが、これらの酵素の基質特異性やアグリコン特異性は異なることが知られている。これらのendo- -GalNAc-aseは、 -GalNAc-aseは、
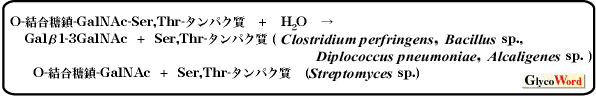
細胞表面のO-結合型糖鎖の構造や機能の研究に有用である。なぜなら、細胞表面糖タンパク質のO-結合型糖鎖を、細胞にダメージをあたえずに遊離できるからである。この中では、Diplococcus pneumoniae由来およびAlcaligenes sp.由来のendo- -GalNAc-aseが、O-結合型糖鎖の糖鎖部分の構造や機能の解析を行うためによく利用されている。 -GalNAc-aseが、O-結合型糖鎖の糖鎖部分の構造や機能の解析を行うためによく利用されている。
また、Diplococcus pneumoniae由来(1)、Bacillus sp. 由来(2)およびStreptomyces sp.由来(3, 4)のendo- -GalNAc-aseは、加水分解活性によって糖タンパク質のO-結合型糖鎖を遊離するとともに、さまざまな受容体(単糖、2糖、糖アルコール、Tris、グリセロール、パラニトロフェノール、セリン、スレオニン、ペプチドなど)の存在下では、遊離した糖鎖を転移付加する糖転移活性を有している。 -GalNAc-aseは、加水分解活性によって糖タンパク質のO-結合型糖鎖を遊離するとともに、さまざまな受容体(単糖、2糖、糖アルコール、Tris、グリセロール、パラニトロフェノール、セリン、スレオニン、ペプチドなど)の存在下では、遊離した糖鎖を転移付加する糖転移活性を有している。

これらの酵素の糖転移活性の、供与体特異性と受容体特異性は異なることが報告されている。Streptomyces sp.由来endo- -GalNAc-aseの糖転移活性を用いて、糖ペプチドを酵素合成する(図1)。Endo- -GalNAc-aseの糖転移活性を用いて、糖ペプチドを酵素合成する(図1)。Endo- -GalNAc-aseの糖転移活性を用いて、糖鎖供与体(糖タンパク質、糖ペプチド、糖鎖誘導体)からペプチドに、O-結合型糖鎖を転移付加して糖ペプチドを合成する。反応生成物は逆相カラムを用いたHPLCによって分離、精製する。この糖ペプチドの構造について確認するために、1H-NMRスペクトルやマススペクトルで解析する。Endo- -GalNAc-aseの糖転移活性を用いて、糖鎖供与体(糖タンパク質、糖ペプチド、糖鎖誘導体)からペプチドに、O-結合型糖鎖を転移付加して糖ペプチドを合成する。反応生成物は逆相カラムを用いたHPLCによって分離、精製する。この糖ペプチドの構造について確認するために、1H-NMRスペクトルやマススペクトルで解析する。Endo- -GalNAc-aseの糖転移活性だけで合成した糖ペプチドの収率は、化学的方法と酵素的方法を組み合わせて合成(図2)した糖ペプチドの収率よりも高い。さらに、糖鎖を転移付加したペプチドについて各種プロテアーゼによる加水分解の違いを比較すると、糖鎖を付加したペプチドは糖鎖をもたないペプチドより各種プロテアーゼに対する抵抗性は高い。Streptomyces sp.由来endo- -GalNAc-aseの糖転移活性だけで合成した糖ペプチドの収率は、化学的方法と酵素的方法を組み合わせて合成(図2)した糖ペプチドの収率よりも高い。さらに、糖鎖を転移付加したペプチドについて各種プロテアーゼによる加水分解の違いを比較すると、糖鎖を付加したペプチドは糖鎖をもたないペプチドより各種プロテアーゼに対する抵抗性は高い。Streptomyces sp.由来endo- -GalNAc-aseは幅広い基質特異性を持っているので、この酵素の糖転移反応を使って種々のO-グリコシド型糖ペプチド、糖タンパク質を合成している。 -GalNAc-aseは幅広い基質特異性を持っているので、この酵素の糖転移反応を使って種々のO-グリコシド型糖ペプチド、糖タンパク質を合成している。
|



