 |
糖ペプチドは糖鎖とペプチド鎖が結合した分子であり、生物学的な機能や薬理作用において重要な役割を果たしている。動物の機能性タンパクのほとんどが糖化されていることから、これらの部分構造体として、ワクチンや抗がん剤、診断薬などの分野で注目される化合物である。
天然の糖タンパクでは糖鎖合成は制御されず均一になっていない為その部分構造である糖ペプチドを天然から得たとき、同一箇所の糖鎖は混合物となる。また、それらを分離精製することも難しいため、結果、天然から単一糖鎖の糖ペプチド体を得るのは容易ではない。そこで人工的な合成が求められるが、ペプチド合成と糖鎖合成の2つの異なる合成手法の融合が必要となる。具体的には、糖鎖をアミノ酸上で構築し糖アミノ酸シントンを用いペプチド合成法にてペプチド鎖伸長させる完全化学合成法や、ペプチド部を合成したのちに酵素で糖合成をすすめるケモエンザイマティック合成法などが有効である。以下、汎用されているペプチド固相合成機で糖ペプチドを完全化学合成することを念頭に、マイクロ波を利用した糖ペプチド固相合成について紹介する。
ペプチド合成では、固相合成法を基盤とした自動合成機が市販されている。ペプチド固相合成とは、固相(レジン、樹脂)の上にアミノ酸を1つずつ伸長してペプチドを得る合成法で(Fig.1)、余剰試薬や試薬由来の副産物などは固相の洗浄という簡便な操作で洗い流すことができる。そして、ターゲットペプチドを合成してレジンから切り出した後にHPLCなどで精製し最終物を得る。固相合成法では各反応後の分離精製をおこなわないため、各合成段階では「100%に近い収率」が求められる。例えば30残基ペプチド合成では、はじめに固相に提示されたアミノ酸(Fig.1のAA0)を基に29個のアミノ酸を順次伸長させるが、もし1残基伸長の収率が90%の場合、所望の30残基ペプチドは90%の29乗で4%でしか得られない。レジンから切り出してHPLCで精製するにしても、多種の化合物群の中から高々4%しか含まれていない目的物を純粋に得るのは容易ではない。もし1残基伸長反応が96%で進行すると、30残基ペプチドは96%の29乗=31%で得られると計算される。すなわち、収率90%の反応というのは化学的に決して悪いものではないし液相合成ではそれ以上改良を試みるものではないが、固相合成法では数%の収率向上が最終物の純度向上やより長鎖のペプチド合成を可能にする。そのため、固相合成法ではアミノ酸シントン試薬は大過剰(3~10当量など)使われることが一般的である。加えて、近年ではマイクロ波迅速加熱特性を利用した収率向上が達成されており、マイクロ波加熱機能を備えた合成装置が市販されている(CEM社、Biotage社など)。ここでは、マイクロ波で反応温度を迅速に100℃前後まで上昇させて1残基伸長反応を数分で終わらせ、高収率化や全合成の短時間化、長鎖のペプチドが得られるなどのメリットがもたらされ、40残基程度のペプチドまで合成可能となった。一方で、HisやCysの導入、保護基や配列などによっては高温にすると副反応が誘発されることもあり、その場合は50℃程度に反応温度を抑えることが推奨される。
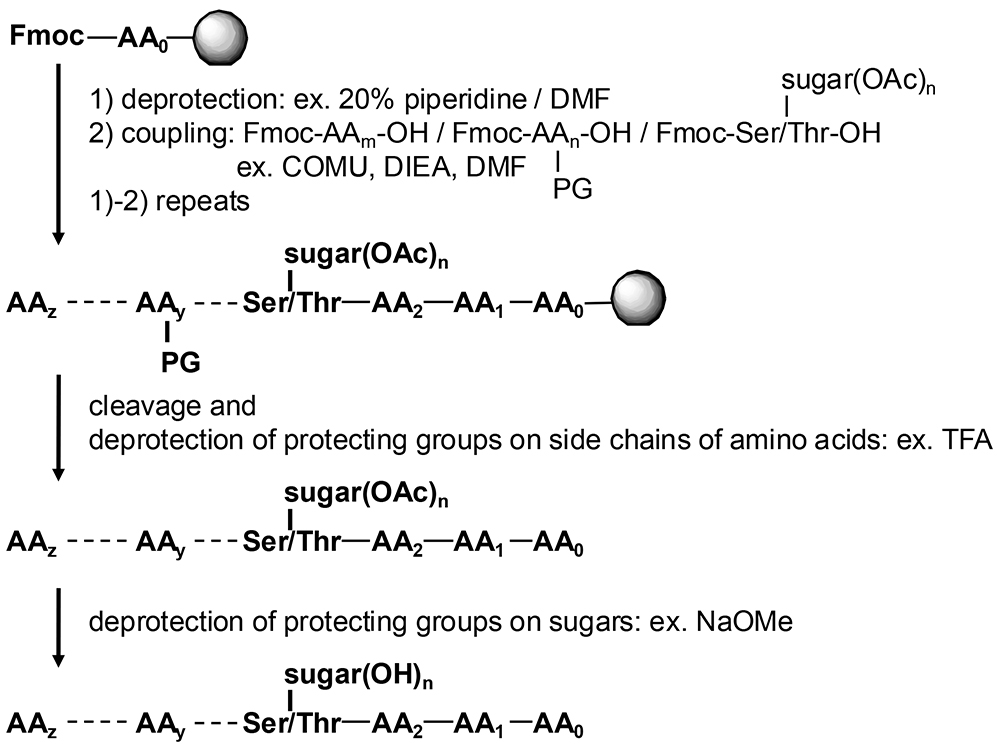
Fig.1. 糖ペプチドFmoc固相合成の概略
1) 固相上のアミノ酸のアミノ基のFmoc基を脱保護し、2)Fmoc保護された次のアミノ酸や糖アミノ酸を導入する。この1)2)を繰り返し所望の糖ペプチドを固相上で合成した後,固相上からの切り出しとアミノ酸側鎖の脱保護(典型的にはどちらも酸(TFAなど)で進行する様にあらかじめデザインされる)、糖ヒドロキシ基の脱保護(アセチル基の場合はNaOMe塩基処理など)をおこなう。AA0,…AAz:アミノ酸,PG:アミノ酸側鎖保護基
|
糖ペプチド合成は、理屈としてはペプチド合成のシントンをアミノ酸誘導体に代えて糖アミノ酸誘導体を使うことで達成できる。しかし、糖アミノ酸シントンは多官能基化合物であり熱や酸、塩基に不安定なものが多く、市販されている糖アミノ酸シントンが高価であることなどから、実践的には容易ではない。例えば、0.1 mmolスケール合成の場合、10当量は1 mmolとなるが、Fmoc-Ser[GalNAc(Ac)3-α-ᴅ]-OH(Aldrich-SIGMAから2024年現在で約15万円/100 mgで市販されている)の場合は656 mg、価格的には100万円となる。単糖を有する糖アミノ酸1残基伸長させるだけで100万円かかると、複数の糖を持つ糖ペプチドやオリゴ糖を有するものを自動合成機で合成しようとすると、コストが莫大になってしまう。
松下らは、MUC1部分構造である3糖体を5か所に有する20残基糖ペプチドの合成を達成している。室温25℃で合成した場合、総収率41%で目的物が得られているが実合成時間が99時間かかっている。ここで、マイクロ波加熱にて反応を50℃に維持し合成をすすめると、実合成時間を7時間に短縮でき、しかも総収率44%で得られている。一方、同じ条件で通常加熱で50℃にして合成をすすめると、同条件での合成なので実合成時間は7時間と変わらないが、総収率は15%まで低下している。すなわち、糖ペプチド合成においてマイクロ波の利用が糖ペプチド合成に有効であり、また同温度での合成においてマイクロ波が高収率化を与えたと、マイクロ波特有の効果の存在も示唆している(1,2)。しかしこの実験では各反応のスケールが異なるなど、マイクロ波効果以外の要素が完全に排除できたと言えるものではなかった。大木らは、同じスケール同じ装置でマイクロ波の有無を検討できる様、反応部をアルミブロックで覆い、アルミブロックの温度設定(-30℃~加熱まで)とマイクロ波照射の2手段で反応温度の制御が可能なマイクロ波合成装置を製作した(3)。横江らはこの装置を用いて、5残基ペプチド固相合成のモデル実験をすすめ、同温度で合成したときマイクロ波を利用した方が高収率で化合物を与えること、より低温でもマイクロ波照射で収率が向上するなど、マイクロ波効果を実験的に実証した。さらに、マイクロ波照射下では、通常大過剰使われる糖アミノ酸がわずか1.3当量で済むことも報告している(3)。すなわち、マイクロ波のメリットは、一般的な「迅速加熱による高収率化」だけでなく、低温での反応の活性化や必要試薬量の低減などももたらすといえる。
現在、清水らは、低温に冷却しつつマイクロ波照射によってシントンの安定性と反応性を同時に向上させ、O-グリカン類であるGalNAc単糖のTn抗原、Sia-Gal-GalNAc3糖であるシアリルT(ST)抗原、Sia-Gal-(Sia)GalNAc4糖であるジシアリルT(diSiaT)抗原が混在する複雑な糖ペプチドの合成に成功し、創薬研究展開をすすめている(unpublished)。北條らは、ベンジル基で保護されたdiSiaT糖アミノ酸を室温にて導入後、数残基のアミノ酸伸長をマイクロ波ペプチド固相合成機で90℃に加熱してすすめた(4)。シアル酸を有する糖アミノ酸シントンは極めて不安定と考えられがちであるが、ペプチド鎖に導入後は比較的熱に安定である様である。
マイクロ波の加熱でない効果が与えられる仕組みや詳細についてはまだ研究途上であるが、長島らは糖加水分解酵素反応において照射マイクロ波周波数を変えることでマイクロ波効果を検討している(5)。ここで、マイクロ波の加熱は双極子分子である水分子にマイクロ波が作用することで発生するが、該当酵素反応ではマイクロ波がイオン選択的に作用したときに促進されたと、反応溶液中の分子選択的な効果付与がマイクロ波効果の一因ではないかと考察している。また筆者は、基質や酵素における水素結合ネットワークへのマイクロ波の寄与もマイクロ波効果の一因となっている可能性があるとも考えており、現在、その実験研究をすすめている。
糖ペプチドの化学合成は、試薬の入手の困難さから、mg以下のスケールや定性的に「できた」という結果ベースの論文報告がされがちで、詳細な反応条件や安定性の検討の報告は極めて少ない。一方、タンパク科学や糖科学の研究分野、創薬などで糖ペプチドの必要性は高まってくると思われる。低温中でもマイクロ波を利用するとメリットが得られることが明らかとなり、diSiaT系列の様な複雑でこれまで合成困難であったO-グリカン糖ペプチドの合成が現実的となってきた。マイクロ波活用が、この状況打破の一手段となることが期待される。(Fig.2)
Fig. 2. 糖ペプチド合成におけるマイクロ波の効果
マイクロ波照射によって低温でも反応活性化や必要試薬の低減などのメリットが得られ、複雑な糖ペプチドの合成が可能となる。
|
清水 弘樹(産業技術総合研究所 細胞分子工学研究部門)
| References |
| (1) |
Matsushita T, Hinou H, Kurogochi M, Shimizu H, Nishimura SI: Rapid Microwave-Assisted Solid-Phase Glycopeptide Synthesis. Org. Lett. 7, 877-880, 2005 |
| (2) |
Matsushita T, Hinou H, Fumoto M, Kurogochi M, Fujitani N, Shimizu H, Nishimura SI: Construction of Highly Glycosylated Mucin-Type Glycopeptides Based on Microwave-Assisted Solid-Phase Syntheses and Enzymatic Modifications. J. Org. Chem. 71, 3051-3063, 2006 |
| (3) |
横江貴之、大木裕太、長島生、高橋直之、清水弘樹: 低温マイクロ波利用が切り開いた糖ペプチド合成の汎用化. 日本電磁波エネルギー応用学会論文誌, Vol3, 32-39, 2019 |
| (4) |
Nagashima K, Ito S, Takei T, Takao T, Kiyozumi D, Hojo H: Synthesis and Structural Analysis of NICOL with O-Linked Glycosylation. 第61回ペプチド討論会P-023, 2024 |
| (5) |
Nagashima I, Sugiyama Ji, Shimizu H: Study of 400 MHz microwave conduction loss effect for a hydrolysis reaction by thermostable β-Glucosidase HT1. Biosci. Biotechnol. Biochem. 87, 158-162, 2023 |
2025年 3月 3日
|
|---|








