 |
天然に存在するシアル酸はαグリコシド結合により糖鎖に結合している。しかしながら、化学合成においては、シアル酸のα結合とβ結合の完全な作り分けが困難であった (図1A)。シアル酸のα結合を得るためには、シアル酸供与体から生じるオキソカルベニウムイオン中間体に対する受容体のヒドロキシ基による求核攻撃をα側へ方向づける仕組みが必要である。しかしながら、シアル酸はアノマー炭素の隣接位 (3位) がデオキシ構造であるため、隣接基効果を利用した立体制御が困難である。加えて、シアル酸のオキソカルベニウムイオン中間体は電子求引性のカルボキシ基により不安定化されるため、副反応の1,2-脱離反応が競合することもα結合形成を妨げる大きな課題であった (1)。これらの課題の解決のため、様々なαシアリル化法が模索されてきた。
これまでに開発されたαシアリル化法の多くは、ニトリルを溶媒として用いる手法と溶媒に依存しない手法に大きく分けられる。ニトリルを溶媒として用いる手法では、アノマー効果により、ニトリルがオキソカルベニウムイオン中間体のβ側に配位した後、糖受容体のヒドロキシ基とSɴ2様の反応をすることで、α結合を優先的に与えていると考えられる (2)(図1B)。この効果は、シアル酸供与体の化学修飾 (脱離基や5位アミノ基の保護基等) により増強することが示されている (1)。一方で、溶媒に依存しない手法として、例えば、シアル酸供与体の1位や3位への補助基の導入によりβ面を遮蔽してSɴ2的にαグリコシドを得る手法や (1,3)、4、5位に環状カーバメート構造を有した供与体を用いる手法が開発されている (4)(図1C)。以上のようなαシアロシド合成技術の飛躍的な発展により、シアロ糖鎖の化学合成が可能となってきた。
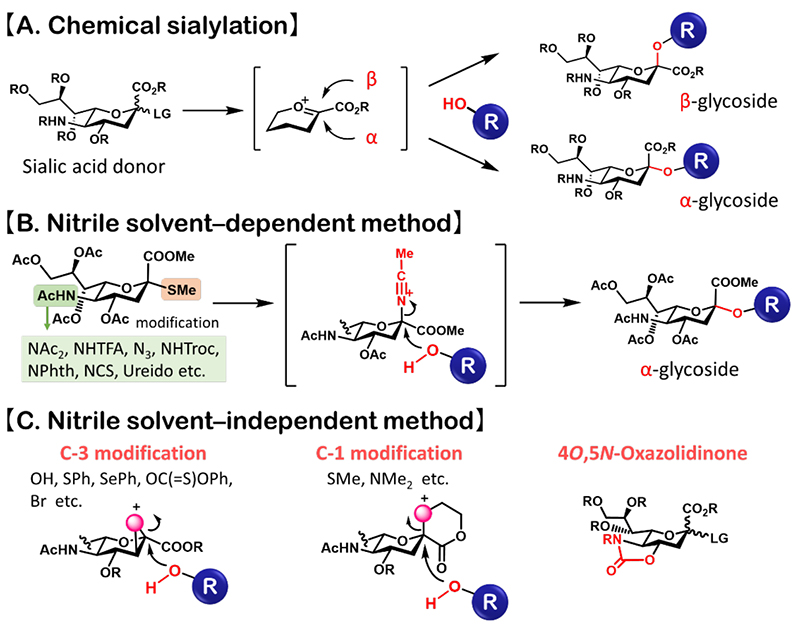
図 1
|
しかしながら、上述のような優れた手法であっても、βグリコシドが生成する可能性は完全には排除されていない。グリコシド化反応後の精製において、極性の近い立体異性体を分離することは困難であることが多いため、βグリコシドの生成はシアロ糖鎖合成において致命的な問題になり得る。筆者らは、α結合のシアル酸の1位カルボキシ基と5位アミノ基がβ側に配向する1,4-cis配置の関係にあることに着目し、これらをβ側で架橋すれば、橋頭位オキソカルベニウムイオン中間体のβ側が完全に遮蔽されるため、結果として生成物はαグリコシドに限定されると考えた (図2)。橋頭位アノマー炭素のカチオン生成はBredt則により不利であるため、anti-Bredtなカチオン生成を許容する架橋部の鎖長をグリコシド化反応により検討した。その結果、生成したグリコシドは鎖長に依らずα結合のみであったが、16員環を与える鎖長の二環性シアル酸供与体が最も高い収率でαグリコシドを与えていた。これより鎖長が短いと、強い環歪みにより二環性シアル酸供与体が活性化されにくくなり、一方で鎖長が長くなるにつれて、1,2-脱離の副反応が進行しやすい傾向が見受けられた。さらに、架橋部末端に塩素置換を施すことで、16員環の二環性シアル酸供与体の反応性が大幅に向上することを見出した。本手法は、シアル酸の完全なα選択的グリコシド化を実現し、従来は困難であったシアロ糖鎖の合成を可能にした (5)。シアリル化反応の立体制御は、シアロ糖鎖の自動合成における課題でもあったため、本手法の応用による更なるシアロ糖鎖合成の簡便化と迅速化が期待される。
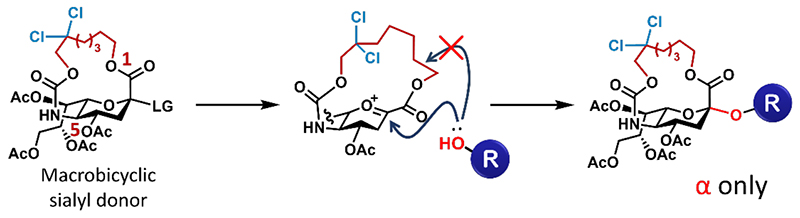
図 2
|
河村 奈緒子(岐阜大学 糖鎖生命コア研究所)
| References |
| (1) |
Vibhute AM, Komura N, Tanaka HN, Imamura A, Ando H: Advanced chemical methods for stereoselective sialylation and their applications in sialoglycan syntheses. Chem. Rec. 21, 3194–3223, 2021 |
| (2) |
Kanie O, Kiso M, Hasegawa A: Glycosylation using methylthioglycosides of N-acetylneuraminic acid and dimethyl(methylthio)sulfonium triflate. J. Carbohydr. Chem. 7, 501–506, 1988 |
| (3) |
Ito Y, Numata M, Sugimoto M, Ogawa T: Synthetic studies on cell-surface glycans. 65. Highly stereoselective synthesis of ganglioside GD3. J. Am. Chem. Soc. 111, 8508–8510, 1989 |
| (4) |
Tanaka H, Nishiura Y, Takahashi T: Stereoselective synthesis of oligo-α-(2,8)-sialic acids. J. Am. Chem. Soc. 128, 7124–7125, 2006 |
| (5) |
Komura N, Kato K, Udagawa T, Asano S, Tanaka HN, Imamura A, Ishida H, Kiso M, Ando H: Constrained sialic acid donors enable selective synthesis of α-glycosides. Science 364, 677–680, 2019 |
2024年 7月17日
|
|---|








